T2值在阿尔茨海默病中的初步研究
2017-07-19郑兴友邓利猛廖伟华周高峰
郑兴友,邓利猛,廖伟华,周高峰
1.长沙市第四医院医学影像科(长沙,410006) 2.中南大学湘雅医院放射科(长沙,410008)
T2值在阿尔茨海默病中的初步研究
郑兴友1,邓利猛1,廖伟华2,周高峰2
1.长沙市第四医院医学影像科(长沙,410006) 2.中南大学湘雅医院放射科(长沙,410008)
目的 对比研究阿尔茨海默病患者与健康中老年人脑内多部位T2值的差异,探讨T2值与简易精神状态量表分的相关性。方法 使用3.0T磁共振T2MAP序列对30例AD与30例NC进行扫描,利用T2MAP软件包进行图像后处理,在T2图上测得双侧齿状核、海马、黑质、红核、苍白球、壳核、丘脑、尾状核头及延髓、脑桥、胼胝体膝部、胼胝体压部的数值。应用统计学软件对各脑区T2值进行组间分析,分析T2值与MMSE评分的相关性。结果 AD组与NC组各对应脑区T2值比较,双侧齿状核、黑质、红核、苍白球、壳核、丘脑及左侧海马、右侧尾状核头、脑桥、延髓的差异具有统计学意义(P<0.05)。AD组左侧海马T2值与MMSE评分有中度正相关性(r=0.519,P<0.05)。结论 AD患者脑内多部位的T2值出现改变。左侧海马的T2值与MMSE评分存在相关性,可以用来评估AD患者病程变化。
阿尔茨海默病;铁沉积;MMSE;T2值
阿尔茨海默(简称AD)是一种由于中枢神经系统变性而导致的进行慢性疾病, 是痴呆症最常见病因。AD的病因及发病机制尚未完全明了, 普遍认为AD是一个多因素致病的复杂病理过程, 脑组织铁过量沉积在AD的发病机制中有重要作用。本研究利用T2MAP序列对AD患者与健康中老年者(以下简称NC)组脑内多部位T2值的进行研究, 探讨T2值与MMSE评分的相关性。
1 资料与方法
1.1 一般资料
30例AD患者进行常规MRI及T2MAP序列检查; 其中男性19例, 女性11例, 年龄48~85岁, 平均年龄62.24±9.23岁; MMSE评分为8~26分, 平均17.21±7.02分。AD患者入选标准采用2011年美国国立神经病、 语言沟通与卒中研究所-老年痴呆及相关疾病学会(NINCDS-ADRDA)制定的标准作出“可能AD”的诊断, 并依据Hachinski缺血指数除外血管性痴呆及混合性痴呆, 既往无神经及精神病史, 头部CT除苍白球见钙化灶外无其他钙化灶, 经MRI检查除脑萎缩及轻度脑白质疏松表现外无其他异常改变。另在患者家属及社区招募与AD组相匹配的健康中老年30位为NC组。
1.2 检查方法
1.2.1 设备和仪器
GE Signa_HDx_3.0T超导型磁共振和8通道头部阵列射频线圈, ADW4.4图像后处理工作站(配有T2MAP序列分析软件), SPSS 22.0统计软件。
2.2.2 扫描方法及参数
T2MAP参数: TR=1 500 ms, 回波数8(TE1=9.4 ms, TE2=18.9 ms, TE3=28.3 ms, TE4=37.8 ms, TE5=47.2 ms,TE6=56.7 ms, TE7=66.1 ms, TE8=75.6 ms), 翻转角度=90°, 层厚=5.0 mm, 层间距=1.5 mm, 重建FOV=24 cm×24 cm, 矩阵=320×192, 激励次数=1.0。总共22个解剖层面, 扫描时间为10 min30 s。
1.3 图像后处理
由一名高年资神经影像学医师进行图像及数据分析, 原始图像数据导入Functool 9.4.05a T2MAP软件包进行后处理。手动绘制ROI的解剖部位包括双侧齿状核、 海马、 黑质、 红核、 苍白球、 壳核、 丘脑、 尾状核头部以及延髓、 脑桥、 胼胝体膝部、 胼胝体压部(见附图)。间隔1个月进行两次T2值测量, 两次的平均值为统计所用数据。
1.4 统计学方法
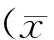
2 结果
2.1 AD组及NC组的一般临床资料比较
如表1所示, AD组与NC组性别和年龄比例的差异无统计学意义, MMSE的差异具有统计学意义, AD组显著低于NC组(P<0.05), 见表1。

表1 AD组及NC组的临床资料比较
2.2 AD组与NC组各解剖部位T2值差异性比较
AD组与NC组各对应解剖部位T2值比较, 如表2所示。其中双侧齿状核、 黑质、 红核、 苍白球、 壳核、 丘脑及左侧海马、 右侧尾状核头、 脑桥、 延髓的差异具有统计学意义(P<0.05), 且AD组的T2值较NC组减小, 而右侧海马、 左侧尾状核头、 胼胝体膝部及胼胝体压部的差异无统计学意义(P>0.05)。
2.3 AD组各解剖部位T2值与MMSE评分的相关性分析
AD组各个解剖部位T2值与MMSE评分进行相关性分析, 左侧海马T2值与MMSE评分有中度正相关性(r=0.519,P<0.05), 余各个解剖部位的T2值与MMSE无统计学意义, 见表3。
3 讨论与结论
3.1 脑铁代谢紊乱与AD
铁广泛存在于脑组织各个部位, 起着重要的生理作用, 而病理生理性脑铁沉积则对疾病的发生及发展有着重要的影响。Connor JR等[1]提出了“至少在某些神经退行性疾病中,脑铁的升高是神经元死亡的始发因素”的假说, 研究脑铁代谢相关基因突变的结果支持这一假说。AD患者脑内铁含量明显增加, 且增高的部位与病变累及部位高度一致, 由此推测, 脑铁含量的异常增加可能是引起AD的重要因素。
3.2 T2MAP序列成像原理
在保持TR、 偏转角、 层厚、 矩阵、 FOV、 采集带宽等参数及解剖位置不变的情况下, 选用SE或FSE序列采集图像, 同一次序列执行中, 利用2个以上的TE获得2组以上的图像。这样基于相同解剖位置所形成的一组图像中, 每一个像素在不同TE上的信号强度与组织T2弛豫的指数曲线是一致的, 利用数学公式可以计算出组织的T2值。本研究选用FSE序列为基本成像序列, 设置8个不同的TE值来采集数据。本研究第1个TE值设为9.4 ms, 第8个TE值设为75.6 ms。
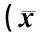
表2 AD组与NC组各对应脑解剖部位T2值(均值±标准差)对比分析

表3 AD组各脑区T2值(均值±标准差)与MMSE评分相关性检验
3.3 T2值与AD
在3.0 T场强下研究发现, 与组织病理学对比, 受试者脑组织T2值与铁含量呈线性关系[2]。而已有的研究显示, 海马是AD最先累及的解剖部位之一。Luo Z等[3]利用10例AD患者与60位正常健康人对比分析发现, AD患者双侧海马的T2值显著减低。一些研究认为, T2值在AD组与NC组之间的差异, 揭示了海马铁浓度的增加与记忆力下降有关。过度的铁沉积将促使β淀粉样蛋白沉积, 而β淀粉样蛋白的毒性导致神经细胞死亡[4]。组织化学染色显示, AD患者脑组织神经元纤维缠结中心的无定形淀粉样蛋白斑块含有铁[5]。这些可能导致严重的脑萎缩, 尤其是颞叶内侧部的海马。但是也有一些研究者发现海马的T2值在AD组与NC组之间无差异性[6]。我们的研究结果显示, AD组左侧海马T2值减小, 提示左侧海马铁含量增高, 而右侧海马T2值未见减小[7]。关于AD的脑组织形态学研究发现, 左侧半球受累比右侧半球严重, 即左侧脑组织萎缩更加明显, 而作为最早期受累部位之一的海马这种差异就更加显著, 萎缩的左侧海马组织铁含量更高[8]。由于病程的差异, 早期AD患者右侧海马铁沉积尚未引起显著升高, 而中晚期则显著升高, 这似乎可以解释本研究AD组右侧海马T2值不降低而左侧海马T2值降低。
Kirsch SJ[9]在AD患者与健康老年人对比研究中发现, AD患者海马的T2值降低, 且T2值与病人的MMSE评分正相关, 这与本研究结果类似, 我们发现左侧海马的T2值与AD患者MMSE评分有中度的正相关性(r=0.519), 与组织病理学发现的海马铁沉积与患者认知功能障碍程度呈负相关性吻合[10]。研究证明, AD患者脑内不同部位的T2值出现改变, 左侧海马的T2值与MMSE评分存在相关性, 可以用来评估AD患者病程变化。
[1] Connor J R, Menzies S L, Martin S M, et al. Cellular distribution of transferrin,ferritin, and iron in normal and aged human brains[J].Neurosci Res,1990, 27:595-611.
[2] Gelman N, Gorell J M, Barker P B, et al. MR imaging of human brain at 3.0 T: preliminary report on transverse relaxation rates and relation to estimated iron content[J]. Radiology,1999,210(3):759-767.
[3] Luo Z, Zhuang X, Kumar D, et al. The correlation of Hippocampal T2-mapping with neuropsychology test in patients with Alzheimer's disease[J]. PLoS ONE, 2013, 8(9): e76203.
[4] Jacobsen J S, Wu C-CC, Redwine J M, et al. Early-onset behavioral and synaptic deficits in a mouse model of Alzheimer's disease [J]. Proc Natl Acad Sci, 2006, 103(13):5161-5166.
[5] Honda K, Casadesus G, Petersen R B, et al. Oxidative stress and redox-active iron in Alzheimer's disease[J]. Ann N Y Acad Sci,2004,1012: 179-182.
[6] LeVine S M. Iron deposits in multiple sclerosis and Alzheimer's disease brains [J]. Brain Res, 1997, 760: 298-303.
[7] House M J, St Pierre T G, Foster J K, et al. Quantitative MR imaging R2 relaxometry in elderly participants reporting memory loss[J]. AJNR Am J Neuroradiol, 2006, 27(2): 430-439.
[8] Wang H, Yuan H, Shu L, et al. Prolongation of T2relaxation times of hippocampus and amygdala in Alzheimer's disease[J]. Neurosci Lett, 2004, 363: 150-153.
[9] Kirsch S J, Jacobs R W, Butcher L L, et al. Prolongation of magnetic resonance T2time in hippocampus of human patients marks the presence and severity of Alzheimer's disease [J]. Neurosci Lett, 1992, 134(2):187-190.
[10] Laasko M P, Partanen K, Soininen H, et al. MR T2relaxometry in Alzheimer's disease and age-associated memory impairment[J]. Neurobiol Aging, 1996, 17:535-540.
A Preliminary Study of T2Value in Alzheimer's Disease
ZHENG Xingyou1, DENG Limeng1,LIAO Weihua2, ZHOU Gaofeng2
1. Department of Radiology,The Fourth Hospital of Changsha City(Changsha, 410006) 2. Department of Radiology,Xiangya Hospital,Central South University(Changsha, 410008)
Objective To compare the difference of T2values between the Alzheimer's disease patients and healthy adults, and to explore the correlation between the T2values and the mini mental state scale. Methods 30 AD cases and 30 healthy elderly cases were scanned by 3.0T magnetic resonance machine, and the images were processed by T2MAP software. Using the T2map, the corresponding values at the hippocampus, dentate nucleus, substantia nigra, red nucleus, globuspallidus, putamen, thalamus, caudate head, medulla, pons, genu and splenium on both sides were obtained. The SPSS 22.0 statistical software was used to analyze the T2value at different regions. Results There was significant difference in T2value at bilateral dentate nucleus, substantia nigra, red nucleus, globus pallidus, putamen, thalamus and left hippocampus, right caudate nucleus, pons, medulla between AD group and NC group (P<0.05). A significant positive correlation was seen between AD group and MMSE score (r=0.519,P<0.05) at the left hippocampus. Conclusion There are some changes of T2values in various region of brain in patients with Alzheimer's disease. T2values of the left hippocampus can be used as evaluation of progression in patients with AD biomarkers
Alzheimer's disease, iron deposits, MMSE, T2values
10.3969/j.issn.1674-1242.2017.02.003
郑兴友:E-mail:1504822517@qq.com
R445.2;R749.16
文章编号:1674-1242(2017)02-0069-03
2017-01-20)
