添加外源硫对农田土壤挥发性含硫气体释放的影响
2017-07-19高珍珍汪丽玲景伟文
高珍珍,汪丽玲,景伟文
(1.新疆农业大学化学工程学院, 新疆 乌鲁木齐 830052; 2.巴州绿环环境科学技术研究所, 新疆 库尔勒 841000)
添加外源硫对农田土壤挥发性含硫气体释放的影响
高珍珍1,2,汪丽玲1,景伟文1
(1.新疆农业大学化学工程学院, 新疆 乌鲁木齐 830052; 2.巴州绿环环境科学技术研究所, 新疆 库尔勒 841000)
选择新疆地区代表性农田土壤为样品,采用气相色谱法进行测定,通过室内培养的方式考察了各种添加外源硫和环境条件对土壤挥发性含硫气体释放的影响。结果表明:不同添加源对挥发性含硫气体种类及数量的影响各不相同。添加胱氨酸、半胱氨酸、甲硫氨酸、硫酸钠和硫代硫酸钠后,释出的挥发性含硫气体在总硫中所占的比例依次为1.71%、0.52%、11.5%、0.0016%和0.0014%,表明转化率均较低,其中无机硫的转化率最低,甲硫氨酸的转化率最高,有机硫是主要来源。在土壤微生物分解作用下,胱氨酸、半胱氨酸的主要分解产物是H2S,分别占总释放量的97.9%、90.8%;甲硫氨酸能够释放较多的CH3SH气体,占总释放量的88.3%。在一定范围内(1~10 mg·g-1),含硫气体的释放量随半胱氨酸添加量的增加而增加。碳、氮源加入的影响与挥发性含硫气体的种类有关。环境条件对挥发性含硫气体的释放也有影响,培养用水的影响远高于土壤类型,是相对重要的因素。
添加剂;外源硫;农田土壤;挥发性含硫气体;释放
挥发性含硫气体主要包括硫化氢(H2S)、羰基硫(COS)、二甲基硫(DMS)、二硫化碳(CS2)、甲硫醇(CH3SH)和二甲基二硫(DMDS),是自然界硫循环的重要组成部分,对环境有着较大的影响,如酸沉降加剧、能见度降低、辐射平衡破坏、阳伞效应(反温室效应)乃至臭氧层耗损等[1-2]。挥发性含硫气体依靠其挥发特性成为连接大气、陆地、海洋生态系统的重要纽带,因而成为硫素生物地球化学研究的一个重要组成部分。
陆地生态系统是硫循环的构成系统之一,农田是陆地生态系统中比较活跃的部分。农田生态系统挥发性含硫气体的释放/吸收过程与土壤密切相关。因此,作为挥发性含硫气体重要的释放源之一,土壤也常被作为陆地硫源中一个非常重要的独立部分进行研究。硫素经由土壤中的生化反应过程产生、释放挥发性含硫气体推动硫循环,对环境生态、气候变化和生物代谢产生重要影响[3]。不同的土壤除了其中有机质构成和土壤微生物的特性有差别外,其温度、湿度、pH值、氧化还原条件、土壤结构等情况也各有差异,因此不同类型的土壤往往会产生不同的释放行为。当前随着对硫作为植物营养元素重要性认识的不断提高,硫肥施用日益增加,导致硫对全球变化和环境的影响日益加剧,迫切需要我们深入研究硫在土壤中的氧化还原反应及转化过程,尤其是结合不同地区的土壤特性来考虑这一问题。
干旱区生态系统是与全球气候变化联系比较密切的生态类型,也是全球陆地硫循环的重要组成部分之一。新疆地处特殊的干旱区,绿洲是新疆人类赖以生存和发展的物质载体和基本地理空间。由于自然条件恶劣,绿洲地区相对脆弱的生态环境和日益增加的人口承载压力之间的矛盾需要我们特别重视科学地进行生态环境保护和建设[4]。新疆地处中、高纬度区,绿洲土壤具有明显的地域特色,其性质有别于其它地区的农田土壤[5],因此必然影响硫的存在形态及氧化还原过程,进而衍生出硫的生物地球化学循环研究的特有内容。另外,干旱区绿洲具有独特的人-地相互作用特点,也是受到人类活动影响比较明显的区块,但是目前比较缺乏该方面的研究报道。本研究采用实验室培养的方法,通过考察不同添加源对绿洲土壤挥发性含硫气体释放的影响,探讨绿洲土壤中挥发性含硫气体产生和释放的途径及基本的转化规律,说明土壤的地域性差异对土壤挥发性含硫气体(以下简称气体)释放的影响。
1 材料与方法
1.1 土样的采取与制备
培养所用的土壤均采自乌鲁木齐市近郊农田(0~10 cm表层土。水田土壤采自稻田,为潜育型水稻土,前身为典型灰漠土;旱田土壤采自旱田,为黄土质棕钙土)。其理化性状见表1。把土样通风晾干,拣去石块、根茎等杂物,研细后用40目的筛子过筛,充分混合后用四分法取出一部分作测定土壤成分之用,其余放入广口瓶,冰箱冷藏备用。

表1 土壤基本理化性质
1.2 培养实验
称取约50 g土壤,置于螺口玻璃培养瓶中,加入75 mL离子交换水,保持淹水状态,定量加入添加物质(有机硫源:胱氨酸、半胱氨酸、甲硫氨酸;无机硫源:硫酸钠、硫代硫酸钠;氮源:硝铵;碳源:葡萄糖;碳、氮源:尿素)并调节土壤pH值近中性,摇匀后拧紧瓶盖,放入振荡器中38℃恒温下全天光照培养。设定相应对照。每8~10 d为一个培养周期,从培养次日起每天以注射器抽取瓶中顶空气体进行气相色谱测定,连续分析各挥发性含硫气体的产生释放情况。每次气体取样时注意不能摇动培养瓶。
1.3 分析测定条件
岛津GC-2014型气相色谱仪,配火焰光度检测器,色谱柱RTX-5(30 m×0.25 mm)。采用程序升温,初温30℃,恒温4 min后以15℃·min-1的速度升至80℃,恒温5 min,然后再以15℃·min-1的速度升至120℃,恒温5 min。载气为N2,流速0.8 ml·min-1,分流比50,进样口温度150℃,检测器温度200℃。
2 结果与分析
2.1 不同添加源的影响
2.1.1 有机硫源 向土样中分别加入胱氨酸、半胱氨酸和甲硫氨酸后进行培养,所测结果如图1和表2。作为对照,发现加热灭菌后的土壤培养后没有测到有关气体,证明挥发性含硫气体主要来自于微生物的作用。相比于空白样品(不加入添加源),加入这些有机含硫氨基酸后释放的气体种类和数量都显著增加。生成气体的释放过程大致呈峰型曲线变化,一般在培养数天后达到峰值,然后逐渐下降。气体浓度的逐渐下降一方面是与环境中的羟基或其它自由基反应而被氧化,另一方面也与气体的水溶性、土壤的吸附性和瓶壁效应有关[6-7]。
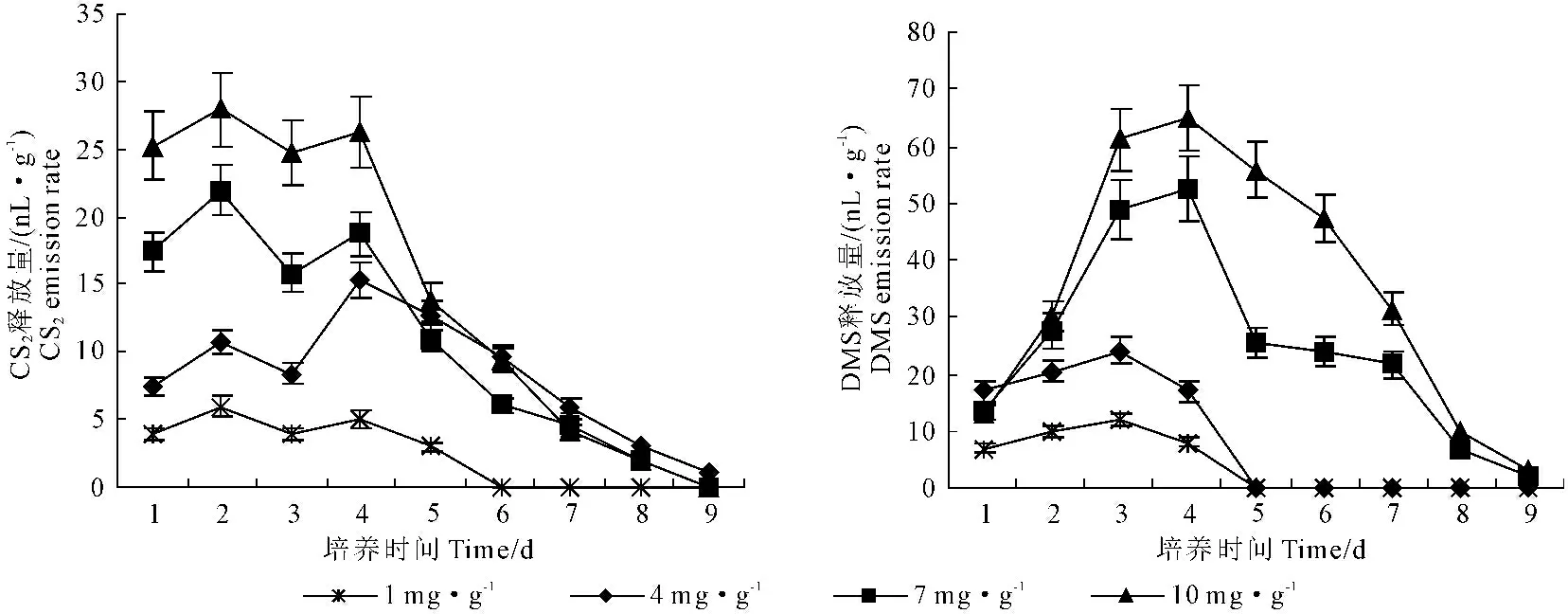
图1 不同半胱氨酸添加量对挥发性含硫气体释放量的影响
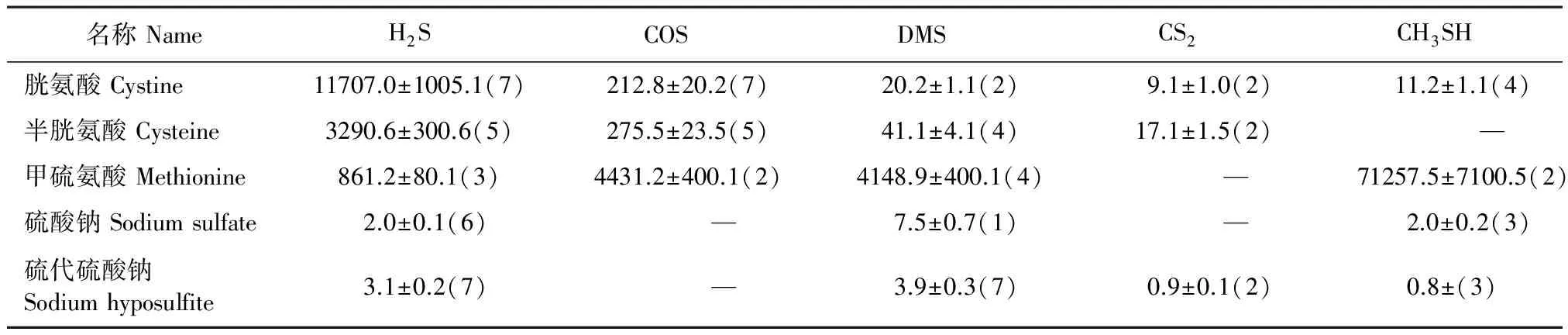
表2 添加不同物质后以单位硫含量计土壤释放的挥发性含硫气体(nL·mg-1·g-1)
注:“—”代表低于检出限;括号前的数值代表检测到该气体最高累积浓度,括号内的数值代表此时的培养天数。
Note: “—”: not detected (below detection limit). Data before the parentheses was the maximum measured value of volatile sulfur gases and data in the parentheses was the days of incubation.
添加半胱氨酸和胱氨酸培养数天以后,培养瓶中的土壤颜色逐渐变黑,提示有H2S的生成,测定结果中也显示有大量H2S的生成(H2S分别占总释放量的97.9%、90.8%)。H2S的水溶性较好,能够较快转化成FeS,故土壤呈黑色[8]。释放的其它气体主要还有COS、CS2和DMS。土壤微生物分解甲硫氨酸释出的挥发性含硫气体种类与胱氨酸和半胱氨酸有所不同。甲硫氨酸能够释放较多的CH3SH气体(占总释放量的88.3%),同时还检测到相对少量的H2S、COS和DMS。
2.1.2 无机硫源 硫酸盐可经微生物还原过程生成挥发性含硫气体。培养结果表明(表2),与有机硫源相比,加入无机硫源后土壤释放的气体种类减少,释放量也大大降低。
不同硫源对气体释放产生的影响不同。将各硫源换算为单位硫含量后比较不同硫源对气体释放的影响(表2)。从表2中可以看出,释出的气体在添加物中所占的比例依次为1.71%、0.52%、11.5%、0.0016%和0.0014%,表明转化率均不高,其中,无机硫的转化率最低,甲硫氨酸的转化率最高。
在实验条件下,土壤中添加有机和无机硫源后生成挥发性含硫气体,表明有机和无机硫源是微生物的营养物质。土壤中挥发性含硫气体释放的途径主要有两个[9],一是硫酸盐的同化(还原)过程,另一个是含硫氨基酸和其它有机物的分解,一些微生物,如放线菌、丝状菌等能以含硫氨基酸为营养物和碳、硫源对含硫氨基酸进行分解、利用,生成中间产物或终产物挥发性含硫气体[8]。从实验结果来看,后一个途径显然是主要的。硫酸盐需经同化作用,才能完成由无机硫到有机硫的转变,故此作用结果不显著,且能够还原硫酸盐的菌种也比较少。如Swary等的结果表明[9],其所试验的四种嗜温性菌难以还原硫酸盐,而四种嗜热性菌则完全不能还原硫酸盐。同样是有机硫源,相比于半胱氨酸和胱氨酸,添加甲硫氨酸后气体的释放量显著增加。由于甲硫氨酸的分解反应可以直接进行,且作用酶的种类多,故释放量显著增加[10-11]。半胱氨酸是合成甲硫氨酸的起始物质,也是硫酸盐同化的终产物,因此作用效果弱于甲硫氨酸而强于硫酸盐。
H2S可以由半胱氨酸经胱硫醚β-合成酶(cystathionineβ-synthase,CBS)和γ-裂解酶(cystathionineγ-lyase,CSE)通过转硫作用生成[10]:

或者:

胱氨酸也有类似反应[11]:

能够利用甲硫氨酸生成CH3SH气体的微生物比较多,主要有曲霉菌属、帚霉属、镰刀菌、链霉菌或酵母菌等[10]。甲硫氨酸可由胱硫醚β-裂解酶、胱硫醚γ-裂解酶、甲硫氨酸-β裂解酶三种酶直接脱氨基生成CH3SH。CH3SH进一步氧化生成DMS、DMDS。反应式如下[11]:
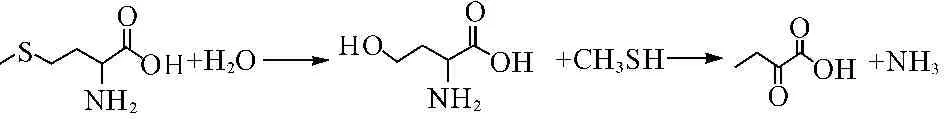
甲硫氨酸也可以通过转氨基反应生成巯基丁酮酸,再经裂解生成丁酮酸和甲硫醇,还可以直接通过γ-裂解酶直接脱氨基并生成甲硫醇[11]。利用甲硫氨酸或甲硫醇生成DMS的途径尚不清楚[11-12]。
作为氧化态硫,硫酸盐被微生物利用的方式有两种[13]:一条途径是硫的同化还原,即还原硫的专性厌氧菌把从环境中吸收的无机态硫经ATP硫酸化酶激活为3'-磷酸腺苷-5'-磷酰硫酸(PAPS)或5'-腺苷酰硫酸(APS),同化还原为亚硫酸盐、硫化物等各种含硫化合物,最后释出气体或合成半胱氨酸和胱氨酸,这些含硫氨基酸也可经还原降解进一步生成气体。另一条途径是硫的异化还原,即在微生物参与下,硫酸盐作为电子受体氧化有机物,同时硫被还原为H2S。从反应产物判断,硫的同化还原过程可能是主要的。
作为还原性硫,硫代硫酸钠可被自养细菌(如硫杆菌属,Thiobacillus)和异养硫细菌微生物利用发生氧化反应[14]:
S2O32-+H2O+2O2→2SO42-+2H+
因此,添加硫代硫酸钠后的情况与硫酸钠类似。
综上,半胱氨酸、胱氨酸、甲硫氨酸和硫酸盐添加后气体释放种类和量的不同主要源自这些含硫物质的可转化性以及一些化学(其分子结构的差别)和生物的因素(作用酶的不同)等。
2.1.3 氮源的影响 以半胱氨酸(350 mg)为硫源,分别以硝铵(1.5 g)、尿素(1.125 g)为氮源,培养后的测定结果见图2(a~d)。图2(a~d)的结果表明,与只加入硫源的对照相比,添加硝铵后COS气体已检测不到,H2S和DMS的释放量减少,尤以H2S明显,但是CS2的释放量却显著增加。尿素的作用效果与硝铵类似,但对CS2的促进作用弱于硝铵,对H2S、DMS的抑制作用则强于硝铵。
以半胱氨酸为硫源,加入不同量的硝铵(0.5、1.5、3 g)为氮源,比较不同氮素含量对挥发性含硫气体释放的影响。测定结果(表3)表明,H2S、COS和DMS释放量随硝铵用量的增加而减小,表现出明显的氮抑制。当氮的含量增加时,CS2的释放量反而增加,表现为明显的氮促进作用,说明该类微生物对氮素的需求较多,氮素增加有利于该类微生物活性的增强。
氮和硫是合成含硫有机物的主要元素,因此,氮、硫养分供应状况对微生物的活性有着非常重要的影响。向土壤中添加氮源后,一般认为微生物的活性增加,生长加快,导致气体释放量增加,如CS2的结果即是如此。土壤中氮源的添加保证了氮素供应充足,产生CS2的微生物对氮素的响应较快,活性增强后能将可资利用的氮素转化成含硫氨基酸[15],由于有机硫的利用率高,导致CS2的释放量增加。同时该结果也说明产生CS2的微生物耐酸、碱性也比较强。但施氮导致H2S、DMS和COS释放量降低。Jerry等[16]关于施氮对气体释放量的影响也有类似的结论。Simmons等[17]认为过量的可利用硫素可能限制了这类微生物将将氮素转化成含硫氨基酸的过程。刘松忠等[18]的研究认为,高硫条件下ATP硫酸化酶(ATPS)和O-乙酰丝氨酸水解酶(OASS)的活性相对较低。Arnerbrandt等[19]的研究也表明,施用氮肥对土壤微生物群落,特别是腐生菌和菌根真菌有直接的抑制作用,其机制是抑制酶活力和积累毒性化合物。另外,施氮改变了土壤的酸碱度,也可能导致微生物活性受到抑制。施氮同时也能改变土壤的氧化还原电位,如硝铵有抑制土壤氧化还原电位持续下降的作用[20]。土壤氧化还原电位越低,越趋于厌氧环境,对微生物产生气体有利[21]。因此,施氮破坏厌氧条件,减少了气体的释放。最后氮素在土壤溶液中被分解后的产物对H2S、COS和DMS气体的吸收溶解能力增强也是一个可能的原因。可见,氮与硫代谢密切相关。对不同的气体来说,氮对硫代谢的影响是不尽相同的。
不同的氮肥对气体释放的影响基本一致,但强度有差异。硝铵所含氮素容易经过反硝化过程而有所损失,相当于相对降低了施氮水平,故抑制作用弱于尿素。培养初期尿素在土壤脲酶的参与下先水解成氨,释放出的氨大多被土壤吸附,夺取土壤溶液中的H+而形成NH4+,然后再同铵态氮肥一样进行硝化作用[20]。因此,对于氮促进效应来说,尿素弱于硝铵。尿素含可甲基化碳源,碳源的添加对微生物的生长有利,但本实验的结果没有体现出碳的影响,可能是添加量较少未达显著性效应的原因。

图2 添加碳、氮源后对挥发性含硫气体释放量的影响(以cysteine为对照)

from cysteine-added soils (cysteine taken as substrate)
2.1.4 碳源的影响 以葡萄糖为有机碳源,若只加入碳源,发现气体的释放量与空白相比没有明显差异,几乎检测不到。向土壤中同时添加半胱氨酸(350 mg)和葡萄糖(5 g)再次培养,测定结果见图2(a~d)。图2(a~d)的结果表明,与只加入硫源的对照相比,同时加入C、S源后DMS的释放量变化不大,CS2和H2S的释放量明显增加,而COS的释放量则明显下降。以上结果表明以半胱氨酸为固定硫源,添加有机碳源葡萄糖后对不同气体释放量的影响是不同的。
考察不同碳添加量下气体的释放情况。土壤本身的C/N为 20/1,分别加入5、10、15 g葡萄糖后(以半胱氨酸为硫源),将土壤的C/N分别调整为38/1、52/1和65/1。在此条件下的测定结果(表4)表明,当C/N的比例增加到38/1时,H2S、CS2的释放量较大,继续增加C/N的比例后,释放量不再增加反而有所下降。葡萄糖的增加对COS的释放产生抑制作用,对CH3SH的释放则影响不明显。

表4 葡萄糖不同添加量的影响(以最高累积释放量计)
对化能异养型微生物来说,有机碳既是能源,也是微生物生长的碳源。当土壤中的有机碳增加后,微生物的生长有了充足的可资利用的能源和碳源,微生物的活性和数量增加。土壤中虽本身有一定的硫,但这些硫素主要以无机硫的形式存在。由于微生物对无机硫的利用率较低,所以在只添加碳源的条件下气体释放不明显,只有同时添加有机硫源后,微生物可对其进行充分利用,加速分解,导致H2S、CS2的释放量增加。COS的释放量下降反映了作用酶的特点。微生物的活性和数量增加后,释放的COS也相应增多。但土壤中的碳酸酐酶(CA)能利用COS,将其水解转化成CO2和H2S[22],因此导致COS浓度下降。上述结果表明,充足的硫源和碳源有利于土壤的硫释放。
土壤中的C/N比发生变化时,意味着土壤对微生物的养料供应情况发生了相应变化,使得不同种类微生物的活性和竞争能力发生了改变,最终导致气体释放的变化。土壤C/N较低时,可供微生物利用的碳源较少,增加碳源,提高C/N,有利于土壤中微生物的活性增加,但碳源并非越多越好。微生物以一定的比例同化利用一定数量的碳、氮,以满足其生长的需要。在碳源不成为硫释放的限制性因素时再添加碳源,对微生物的硫源利用就不会有影响[6]。另外,虽然通过增加碳源提高了C/N,但是氮素受限,微生物对氮素的需求会有所增加,导致气体的释放量不再增加反而下降。可见,C、N、S代谢之间有着一定的联系,但目前的研究工作较少,需进一步深入。
2.2 添加量的影响
分别在土壤中加入不同量的半胱氨酸(50、200、350、500 mg)进行培养,测定的结果见图1。从图中可以看出,在一定范围内,气体的释放量随半胱氨酸添加量的增加而增加,DMS、CS2和COS的释放量与半胱氨酸添加量大致呈正相关关系。
2.3 土壤环境条件的影响
2.3.1 不同的土壤类型 分别取旱田土壤和水田土壤培养后进行测试,结果(表5)表明,同一条件下水田土壤气体的释放量高于旱地土壤,但差异不明显,说明土壤类型对气体的释放有一定影响。水田土和旱地土壤成土母质本身有一定差别,长期水热管理的不同,使得土壤性质产生一定差别。从表1可以看出,水田土壤中有机碳及全氮含量均高于旱地土壤,且C/N较大。这些都是有利于微生物活性增强的条件。
2.3.2 不同用水 以上结果均用离子交换水进行培养。为考察不同用水的影响,在土壤中加入稻田水(取自试验大田,分蘖期稻田水)培养后进行测试(表6)。与离子交换水的培养结果相比,以稻田水培养后气体的释放种类增多,释放量也明显增加。这是因为稻田水长期和土壤、植物在一起,使得稻田水中微生物种类及数量更多(106~107个·mL-1,远高于离子交换水中102~103个·mL-1的水平),活性也更好。与前述数据相比,表明不同用水对气体释放的影响强度远高于土壤类型,稻田水对气体的释放具有相对重要的作用。

表5 不同类型土壤挥发性含硫气体最高累积释放量/(nL·g-1)
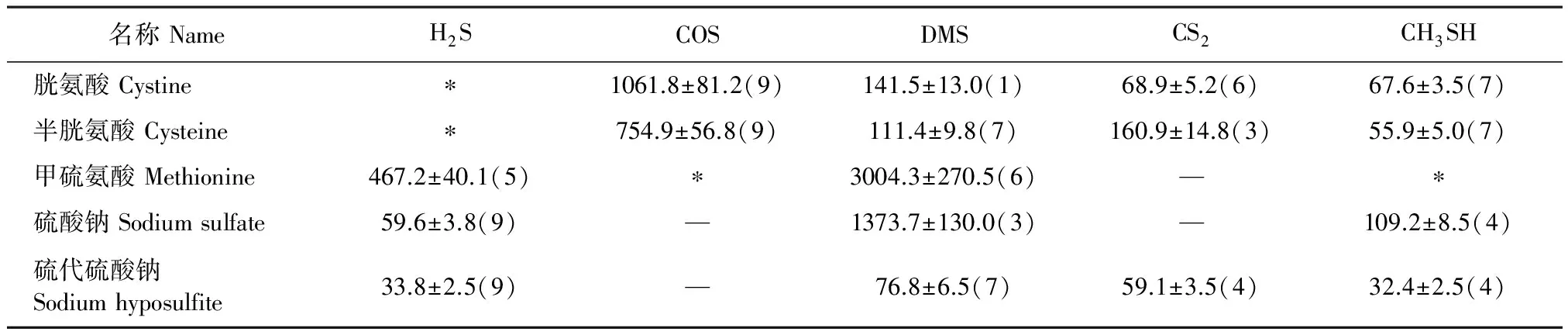
表6 稻田水培养时挥发性含硫气体的最高累积释放量/(nL·g-1)
注:*表示数值较大,超出色谱线性范围。 Note:* indicated the maximum emission rate exceeded the linear range of chromatography.
3 结 论
与张晋华等的结果相比[6],添加营养源后,新疆地区农田土壤挥发性含硫气体的释放显示出与之相同的一些规律,如气体的释放主要来自于微生物的作用,土壤微生物还原有机硫源释放的气体量远大于无机硫源等,但也表现出独特之处,具体有:
(1) 新疆地区农田土壤挥发性含硫气体的释放种类偏少,以H2S、CH3SH、COS和DMS为主,浓度总体上偏低。
(2) 土壤中添加胱氨酸和半胱氨酸后释出的H2S分别占总释放量的97.9%、90.8%,添加甲硫氨酸后释出的CH3SH占总释放量的88.3%。由此表明:胱氨酸和半胱氨酸是H2S的主要前体物,甲硫氨酸是CH3SH的主要前体物。
(3) 在一定的含量范围内(1~10 mg·g-1),气体释放量随硫源添加量增加而增加。在土壤中添加氮源和碳源,对不同气体释放量的影响不尽相同。氮源和碳源的添加改变了土壤微生物活性,最终导致气体的释放量及种类发生变化。
(4) 不同的土壤类型是影响土壤挥发性含硫气体释放的因素之一。水田土壤气体的释放量高于旱作土壤。稻田水对气体释放的影响强度远高于土壤类型的影响,表明其对挥发性含硫气体的释放具有重要的作用,凸显了微生物的影响。
[1] Andreae M O, Crutzen P J. Atmosphere aerosols: biogeochemical sources and role in atmosphere chemistry[J]. Science, 1997,276:1052-1058.
[2] Charlson R J, Loveloek J E, Andreae M O, et al. Oceanic phytoplankton, atmosphere sulfur, cloud albedo and climate[J]. Nature, 1987,326:655-661.
[3] 李新华,刘景双,于君宝,等.土壤硫的氧化还原及其环境生态效应[J].土壤通报,2006,37(1):159-163.
[4] 潘晓玲,马映军,顾峰雪.中国西部干旱区生态环境演变与调控研究进展与展望[J].地球科学进展,2003,18(1):50-57.
[5] 赖先齐.中国绿洲农业学[M].北京:中国农业出版社,2005.
[6] 张晋华.土壤-植物生态系统中挥发性含硫化合物释放研究[D].南京:南京理工大学,2005.
[7] Zhang Jinhua, Wang Lei, Yang Zhen. Emission of biogenic sulfur gases from the microbial decomposition of cystine in Chinese rice paddy soils[J]. Bulletin of Environmental Contamination and Toxicology, 2004,72(4):850-857.
[8] Ronald B, Thomas G C. Environmental VOSCs-formation and degradation of dimethyl sulfide, methanethiol and related materials[J]. Chemosphere, 2004,55:291-317.[9] Swaby R J, Fedel R. Microbial production of sulphate and sulphide in some Australian soils[J]. Soil Biology & Biochemistry, 1973,5:773-781.[10] Minami K, Fu kush K S. Volatilization of carbonyl sulfide from paddy soils treated with sulfur-containing substances[J]. Soil Science and Plant Nutrition, 1981,27:339-345.
[11] Lu C Y, Adam K A, Eugene Lu K, et al. S-sulfhydration/desulfhydration and S-nitrosylation/denitrosylation: A common paradigm for gasotransmitter signaling by H2S and NO[J]. Methods, 2013,62:177-181.
[12] Hendrik S, Natalia M, Rich B. Microbial degradation of dimethylsulphide and related C1-sulphur compounds: organisms and pathways controlling fluxes of sulphur in the biosphere[J]. Journal of Experimental Botany, 2010,61(2):315-334.
[13] 郝瑞颖,王肇悦,张博润,等.葡萄酒中酿酒酵母产生的重要香气化合物及其代谢调控[J].中国食品学报,2012,12(11):121-127.
[14] 侯建平,杭 锋,王渊龙,等.干酪蛋白质和氨基酸的代谢及其对干酪风味的作用[J].中国乳品工业,2013,41(10):23-29.
[15] Swiegers J H, Pretorius I S. Modulation of volatile sulfur compounds by wine yeast[J]. Applied Microbiology and Biotechnology, 2007,74:954-960.
[16] Jerry M M, Paul A S. The effect of nitrogen fertilization on the COS and CS2emissions from temperature forest soils[J]. Journal of Atmospheric Chemistry, 1989,9:411-417.
[17] Simmons J S, Klemedtsson L, Hultberg H. Consumption of atmospheric carbonyl sulfide by coniferous boreal forest soils[J]. Journal of Geophysical Research, 1999,104(D9):11569-11576.
[18] 刘松忠,陈 清,冯 固,等.氮硫供应对大葱含硫有机物及其代谢关键酶活性的影响[J].西北农业学报,2010,19(6):148-152.
[19] Arnebrandt K, Bààth E, Derstr S. Changes inmicro-fungal community structure after fertilization of scots pine forest soil with ammonium nitrate or urea[J]. Biology and Fertility of Soils, 1990,22:309-312.
[20] 周 毅,陶 战,杜道灯.控制稻田甲烷排放的农业技术选择[J].农村生态环境学报,1994,10(3):6-8.
[21] Yi Zhigang, Wang Xinming, Sheng Guoying, et al. Exchange of carbonyl sulfide (OCS) and dimethyl sulfide (DMS) between rice paddy fields and the atmosphere in subtropical China[J]. Agriculture, Ecosystems & Environment, 2008,123:116-124.
[22] Protoschill-Kress G, Wilhelm C, Kesselmeier J. Consumption of carbonyl sulphide (COS) by higher plant carbonic anhydrase (CA)[J]. Atmospheric Environment, 1996,30(18):3151-3156.
Effectsofexogenoussulfuronvolatilesulfurgasesemittingfromthefarmland
GAO Zhen-zhen1,2, WANG Li-ling1, JING Wei-wen1
(1.DepartmentofChemicalEngineering,XinjiangAgriculturalUniversity,Urumqi,Xinjiang830052,China; 2.LvHuanEnvironmentalScienceandTechnologyResearchInstituteinBayingolinPrefecture,Korla,Xinjiang841000,China)
In this paper, the influences of different exogenous sulfur and environmental conditions on the emissions of volatile sulfur gases from soil were investigated by gas chromatography for the representative farmland soil samples in arid area of Xinjiang. The results showed that sources of exogenous sulfur had different influences on the kind and the amount of volatile sulfur gases emitting from incubation soils. Volatile sulfur gases released from the soil with cystine, cysteine, methionine, sodium sulfate and sodium thiosulfate addition contributed fewer to total sulfur emission, being 1.71%, 0.52%, 11.5%, 0.0016% and 0.0014%, respectively. The conversion rate was the highest for methionine but lowest for inorganic sulfate. Organic sulfur acted as a major contributor to volatile sulfur gases emission from soil. As the main product, H2S accounted for 97.9% and 90.8% of the total emissions from cystine and cysteine by microbial decomposition. CH3SH was the main product detected from methionine decomposition and accounted for 88.3% of the total emissions. The amounts of volatile sulfur gases were positively proportional to the amounts of added cysteine (1~10 mg·g-1). The influence of added carbon and nitrogen fertilization was related to the kind of evolved volatile sulfur gases. Incubation conditions such as the soil types and irrigation water had substantial effect on sulfur gases emissions, with the moisture in incubation soil having the larger influence.
additives; exogenous sulfur; farmland soil; volatile sulfur gases; emission
1000-7601(2017)03-0253-07doi:10.7606/j.issn.1000-7601.2017.03.39
2016-03-20
:2017-02-27
:国家自然科学基金(41263004);霍英东教育基金(111019)
高珍珍(1988—),女,山东泰安人,硕士,研究方向为环境化学。 E-mail:396938909@qq.com。
景伟文(1972—),女,陕西华县人,教授,主要从事环境化学研究。 E-mail:479218061@qq.com。
S152.6; X13
: A
