苦豆子内生真菌对宿主培养物生长及喹诺里西啶类生物碱合成的影响
2017-07-19孙牧笛徐全智张庆宸顾沛雯
高 媛,孙牧笛,徐全智,吕 茜,张庆宸,顾沛雯
(1.宁夏大学农学院, 宁夏 银川 750021; 2.山东大学药学院, 山东 济南 250012; 3.淮安出入境检验检疫局, 江苏 淮安 223001)
苦豆子内生真菌对宿主培养物生长及喹诺里西啶类生物碱合成的影响
高 媛1,3,孙牧笛1,徐全智1,吕 茜1,张庆宸2,顾沛雯1
(1.宁夏大学农学院, 宁夏 银川 750021; 2.山东大学药学院, 山东 济南 250012; 3.淮安出入境检验检疫局, 江苏 淮安 223001)
利用苦豆子健康植株中分离鉴定的8株内生真菌菌株为真菌诱导子,分别制备灭活菌丝和菌液浓缩物,研究内生真菌诱导子不同种类、浓度和诱导时间对苦豆子无菌苗和愈伤组织的生长以及喹诺里西啶生物碱含量的影响。结果表明:8株苦豆子内生真菌诱导子中,菌液浓缩物的诱导效果要强于灭活菌丝。菌株HMGKDF1菌液浓缩物和灭活菌丝都能明显促进愈伤组织的生长,净生长率是对照的1.82和1.42倍;菌株NDZKDF13菌液浓缩物对愈伤组织生物碱的合成效果明显,生物碱含量为0.5483 mg·g-1,是对照的23.8倍;在一定浓度范围内(0.01~1.0 mg·L-1),苦豆子内生真菌诱导子能够促进宿主植物喹诺里西啶生物碱的合成。内生真菌诱导子处理苦豆子无菌苗12 d时,喹诺里西啶生物碱含量最高,是对照的2.65倍。在苦豆子无菌苗或愈伤组织中添加一定量的苦豆子内生真菌诱导子,对宿主的生长以及提高喹诺里西啶生物碱含量是一种有效的方法。
苦豆子;内生真菌;真菌诱导子;植物培养物;喹诺里西啶生物碱
近年来,利用真菌诱导子刺激植物组织提高次生代谢物产量的研究一直是个热点。真菌诱导子是来源于真菌的一种特定的化学信号[1],具有诱导植物细胞中防卫基因表达、诱发植物过敏反应和促进植物细胞中特定次生代谢产物的合成等多种功能[2]。大量研究结果表明,真菌诱导子能够有效地促进植物和某些微生物次生代谢产物的合成和积累[3-4],其作用效果与细胞的生长阶段[5]、诱导子的浓度[6]和作用时间等多种因素有关[7]。为了有效提高植物次生代谢产物的含量,在栽培或组织培养过程中加入真菌诱导子被认为是一种有效的手段[8-9]。
植物内生真菌是指在生活史的某段时期生活于植物组织内部,对宿主没有造成明显病害症状的真菌。研究表明,内生真菌与宿主植物在长期的生态系统演化过程中形成了互惠共生关系,内生真菌可促进植物生长、增强抗病能力、提高抗逆性、促进宿主植物活性成分的积累等作用[10]。2009年,方芳等[11]通过添加内生真菌诱导子,促进了茅苍术悬浮细胞的生长及挥发油积累。2010年,张瑞芬等[12]发现在盾叶薯蓣无菌苗或细胞培养中添加一定量的内生真菌灭活菌丝或菌液浓缩物对于提高薯蓣皂苷元含量和产量是一种有效的方法。2015年,王亚洲等[13]筛选得到一株产黄青霉代谢产物内生真菌诱导子对纳他霉素生物合成的促进效果最强,较原始产量提高231.6%。
苦豆子(SophoraalopecuroidesL.)豆科槐属多年生草本植物,是我国西北荒漠化地区广泛分布的一种重要沙生药用植物,是我国传统常用大宗中药材品种之一,药用历史悠久,具有清热解毒、祛风燥湿、止痛杀虫、增强免疫等多种功效[14-15]。喹诺里西啶生物碱是其主要的活性成分,目前国内外对于苦豆子品质及其道地性的研究主要集中于化学成分、遗传多样性、药理药效分析以及外部环境(气候因子、光照、土壤、水分)等方面,而忽视了苦豆子植物体内环境的作用,特别是植物体内生真菌的作用。2012年,顾沛雯等[16]从宁夏野生苦豆子中分离得到214株内生真菌,筛选抑菌高活性菌株;2013年,余永涛等[17]从宁夏苦豆子中分离筛选得到产苦参碱的内生真菌;周星辰等[18]初步筛选得到产喹诺里西啶生物碱的内生真菌。但到目前为止,利用苦豆子内生真菌为诱导子提高宿主植物中次生代谢物产量的研究还鲜见报道。本试验以苦豆子内生真菌灭活菌丝和菌液浓缩物为诱导子,研究其对宿主植物喹诺里西啶生物碱等活性成分积累的影响,从而有助于探索内生真菌与苦豆子药材道地性之间的相关性,为苦豆子的持续发展利用探索新的途径。
1 材料与方法
1.1 试验材料
苦豆子无菌苗:挑选健康的苦豆子种子,经严格消毒后,无菌水吸胀,置于铺有无菌滤纸的培养皿中,培养3~5 d进行催芽。再次消毒后,接种于MS基本培养基(即不添加任何激素),用于无菌苗的继代培养和相关的研究。培养条件为25℃,每天连续光照12 h,光强为1 000 lx,无菌苗每25天继代1次。
苦豆子愈伤组织:以苦豆子子叶为外植体,经严格消毒后,在培养基MS+NAA 0.5 mg·L-1+6-BA 1.0 mg·L-1+2,4-D 0.5 mg·L-1上诱导愈伤组织,在MS+NAA 1.0 mg·L-1+6-BA 4.0 mg·L-1+2,4-D 1.0 mg·L-1培养基上继代培养。培养条件为25℃,每天连续光照12 h,光强为1 000 lx,愈伤组织每25天继代培养1次。
苦豆子内生真菌菌株:本实验室2013—2014年从健康苦豆子植株中分离鉴定保存(表1)。内生真菌的分离、保存和鉴定参照本研究小组的方法和相关文献[19-21]。
氧化槐果碱(批号:13012907)、氧化苦参碱(批号:13021902)、槐定碱(批号:13032002)、槐果碱(批号:130827)、苦参碱(批号:1302194)对照品(纯度>99%)均为上海融禾医药科技有限公司购置。
1.2 方法
1.2.1 内生真菌诱导子的制备 将苦豆子内生真菌菌株接种到马铃薯葡萄糖液体培养基中,25℃,150 r·min-1在摇床中暗培养,7 d后收获,分别得到8株内生真菌菌株的发酵液,发酵液进行高压抽滤分离菌丝和菌液。收获的菌丝冰冻干燥至恒重,研磨成粉,菌液减压浓缩。称量一定量的菌丝干粉或菌液浓缩物,加入到无菌苗或愈伤组织培养基中,终浓度为1.00 mg·L-1,121℃灭菌20 min,备用。
1.2.2 内生真菌诱导子多糖含量测定 用蒽酮比色法测定制备的菌丝和菌液真菌诱导子中多糖的含量,单位为mg·L-1。
1.2.3 内生真菌诱导子的筛选
(1) 内生真菌灭活菌丝和菌液浓缩物的筛选
以苦豆子无菌苗和第2次继代培养的愈伤组织为研究对象,添加浓度20%(v/v)的内生真菌灭活菌丝和菌液浓缩物作为诱导子,使培养基中诱导子含量的终浓度为1.00 mg·L-1(多糖计),培养条件为25℃,每天连续光照12 h,光强为1 000 lx,处理15 d后取样。

表1 苦豆子内生真菌菌株
(2) 诱导子添加浓度的筛选
以苦豆子无菌苗为研究对象,分别添加浓度5%,10%,15%,20%和25%(V/V)的内生真菌NDZKDF13菌株菌液浓缩物作为真菌诱导子,使培养基中诱导子含量的终浓度依次为0.01 mg·L-1,0.02 mg·L-1,0.75 mg·L-1,1.00 mg·L-1和1.25 mg·L-1(多糖计),25℃,每天连续光照12 h,光强为1 000 lx,处理15 d后取样。
(3) 诱导时间的筛选
以苦豆子无菌苗为研究对象,添加20%(V/V)的内生真菌NDZKDF13菌株的菌液浓缩物作为真菌诱导子,使培养基中诱导子含量的终浓度为1.00 mg·L-1(多糖计),25℃,每天连续光照12 h,光强为1 000 lx,每3 d取样1次,共取样5次。
1.2.4 苦豆子培养物生长的测定 在组培瓶中加入50 mL MS基本培养基,每瓶接种1 g苦豆子无菌苗;在组培瓶中加入50 mL MS继代培养基,每瓶接种1 g苦豆子愈伤组织,光照培养箱中培养15 d后收获,用吸水纸吸干表面水分,分别称量后计算平均值即得鲜重。
1.2.5 苦豆子无菌苗和愈伤组织中喹诺里西啶生物碱含量的测定
(1) 样品与喹诺里西啶生物碱标品的制备
精确称取1 g的苦豆子无菌苗和愈伤组织,加入4 mL无水乙醇于研钵中充分研磨,超声震荡处理30 min,置于4℃冰箱冷藏溶解24 h后,于10 000 r·min-1离心10 min,取上清液置于新离心管并旋转蒸发,溶解于1 mL甲醇(色谱级),过0.45 μm滤膜后,即为样品制备液,于4℃冰箱中保存。
分别精确称取氧化槐果碱、氧化苦参碱、槐定碱、苦参碱、槐果碱标品0.02 g,置于10 mL容量瓶中,用甲醇溶解并稀释,制成含的2 mg·mL-1的混合标准溶液,备用。
(2) 色谱条件
色谱柱为:Ultimate ○RAQ-C18 (4.6×250 mm, 5μm);流动相:0.01 mol·L-1磷酸缓冲液(K2HPO4=5.59 g·L-1,KH2PO4=0.41 g·L-1,pH为7.5)-甲醇(50∶50, V/V);检测波长:216 nm;柱温:35℃;流速:1.0 mL·min-1。
(3) 线性关系的确定
利用氧化槐果碱、氧化苦参碱、槐定碱、苦参碱、槐果碱标准样品作为对照(图1),并考察5种单碱标准品标准曲线的线性关系,R2值均在0.9999及以上(表2)。

1.氧化槐果碱;2.氧化苦参碱;3.槐定碱;4.槐果碱;5.苦参碱
2 结果与分析
2.1 内生真菌灭活菌丝和菌液浓缩物对苦豆子培养物的影响
2.1.1 内生真菌灭活菌丝和菌液浓缩物对苦豆子愈伤组织的影响 由表3可知,8种菌液浓缩物中,HMGKDF1,NDZKDF13菌液浓缩物能促进愈伤组织的生长,净生长率分别为182.48%和102.60%,是对照的1.82和1.02倍。其他6种菌液浓缩物对苦豆子愈伤组织的生长有一定的抑制作用,净生长率均低于对照组。由表4可以看出,经SAS方差分析(F=92.50,P<0.0001),各处理组与对照组间差异极显著,说明8种菌液浓缩物均能提高愈伤组织中喹诺里西啶生物碱的含量,其中NDZKDF13菌液浓缩物处理组与其他处理组间差异显著,愈伤组织生物碱含量最高,为0.5483 mg·g-1,是对照的23.80倍。

表2 标准曲线

表3 内生真菌灭活菌丝和菌液浓缩物对苦豆子愈伤组织生长的影响
此外,8种灭活菌丝中,HMGKDF1,NDZKDF13灭活菌丝对苦豆子愈伤组织的生长有一定的促进作用,净生长率分别为141.93%和103.20%,是对照的1.41和1.03倍。其他6种灭活菌丝对愈伤组织的生长有抑制作用,净生长率均低于对照组(表3)。经SAS方差分析(F=25.63,P<0.0001),各处理组与对照组间差异极显著(表4),说明8种灭活菌丝均能提高愈伤组织中喹诺里西啶生物碱的含量,其中NDZKDF13灭活菌丝处理组与其他处理组间差异显著,苦豆子愈伤组织中生物碱含量增加较为明显,为0.1931 mg·g-1,是对照的8.35倍;XKZKDF11,XKZKDF27,HMGKDF1和FJJKDF41菌液浓缩物处理组间差异不显著。
2.1.2 内生真菌菌液浓缩物对苦豆子无菌苗的影响 由表5可知,8种菌液浓缩物中,NDZKDF13菌液浓缩物能促进无菌苗的生长,净生长率为102.82%,是对照的1.03倍,其他7种菌液浓缩物对无菌苗的生长有一定的抑制作用,净生长率均低于对照。经SAS方差分析(F=156.20,P<0.0001),各处理组与对照组间差异极显著(表6),说明8种菌液浓缩物均能不同程度地提高苦豆子无菌苗中喹诺里西啶生物碱的含量,其中XKYKDF40菌液浓缩物处理组与其他处理组间差异显著,苦豆子无菌苗中生物碱含量增加较为明显,为2.8283 mg·g-1,是对照的2.01倍;NDZKDF13,XKZKDF11和XKZKDF27菌液浓缩物处理组间差异不显著,喹诺里西啶生物碱含量分别为2.4928、2.4814和2.4542 mg·g-1,分别是对照的1.77、1.76和1.74倍。
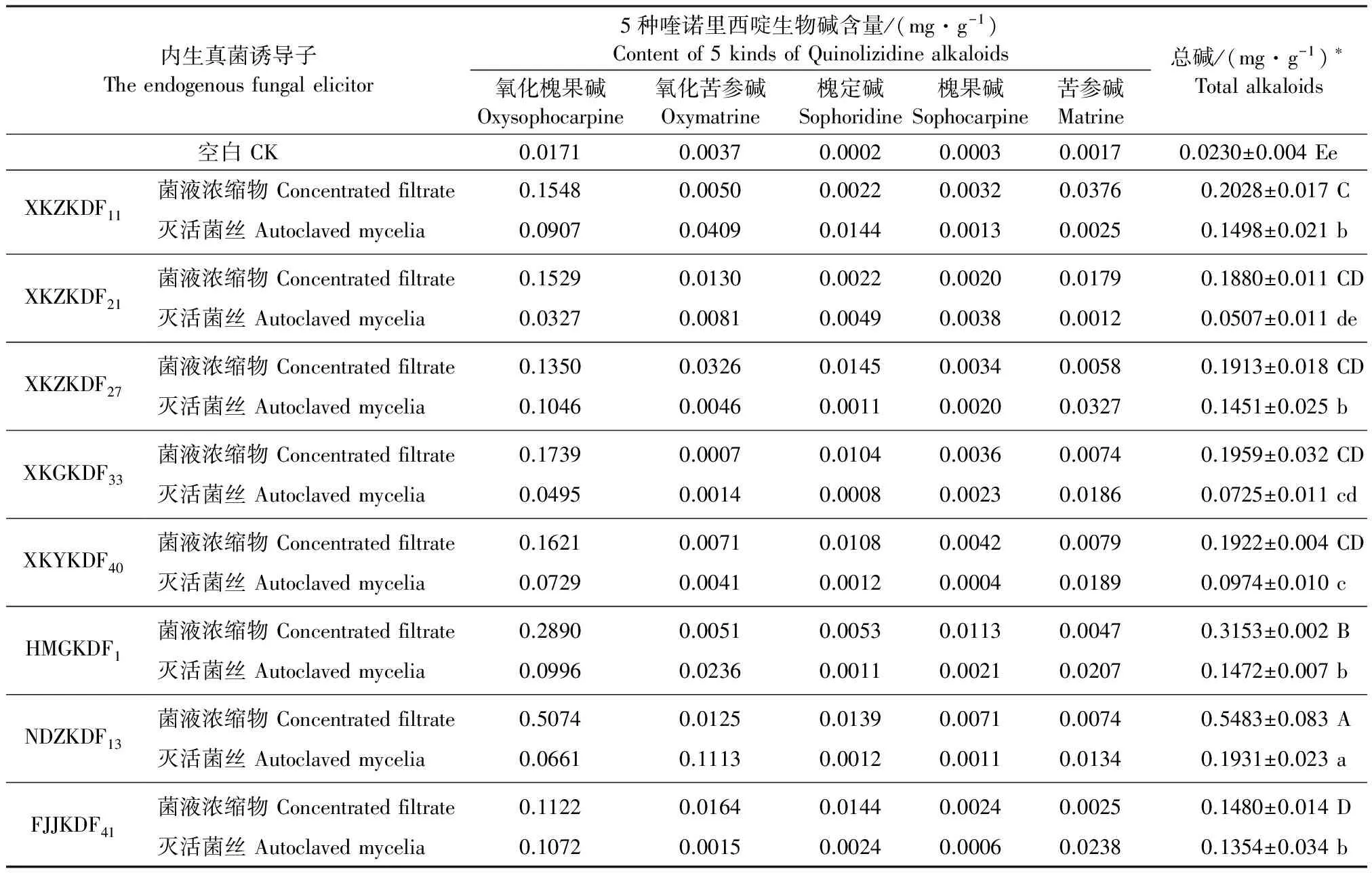
表4 内生真菌灭活菌丝和菌液浓缩物对苦豆子愈伤组织中喹诺里西啶生物碱合成的影响
注:大写字母代表各菌液浓缩物处理组间的差异水平,同列中不同的大写字母代表差异显著(P<0.0001);小写字母代表各灭活菌丝处理组间的差异水平,同列中不同的小写字母代表差异显著(P<0.0001)。
Note:Capital letter mean different level among concentrated filtrate groups, with the different letter mean significantly different in same column(P<0.0001); Lowercase letter mean different level among autoclaved mycelia groups, with the different letter mean significantly different in same column(P<0.0001).

表5 内生真菌菌液浓缩物对苦豆子无菌苗生长的影响
2.2 添加不同浓度内生真菌菌液浓缩物对苦豆子无菌苗的影响
如图2可知,不同浓度真菌诱导子对苦豆子无菌苗生物碱含量有一定的影响,低浓度的真菌诱导子有利于苦豆子生物碱的合成,在一定范围内(诱导子含糖量0.01~1.00 mg·L-1),苦豆子无菌苗中喹诺里西啶生物碱的含量与真菌诱导子的浓度呈正相关。当真菌诱导子的浓度超过1.00 mg·L-1时,抑制苦豆子无菌苗的生长,生物碱含量下降,可见诱导子浓度对苦豆子无菌苗喹诺里西啶生物碱合成的影响很大。
2.3 不同诱导时间对苦豆子无菌苗的影响
如图3可知,不同的诱导处理时间对苦豆子无菌苗中喹诺里西啶生物碱合成的影响不同,其促进作用不同。在诱导处理9~12 d时,喹诺里西啶生物碱含量呈直线上升,处理12 d生物碱含量最高,为3.0721 mg·g-1,是对照的2.65倍。

表6 内生真菌菌液浓缩物对苦豆子无菌苗中喹诺里西啶生物碱合成的影响
注:*大写字母代表各组间的差异水平,同列中相同的大写字母代表差异不显著(P<0.0001)
Note:Capital letter means different level of groups, with the same letter are not significantly different in same column(P<0.0001)

图2 不同浓度内生真菌菌液浓缩物对苦豆子无菌苗喹诺里西啶生物碱类生物碱含量的影响

图3 不同诱导时间对苦豆子无菌苗喹诺里西啶生物碱含量的影响
3 结论与讨论
Zhao等[22]认为,在长期的协同进化过程中,内生真菌能够产生与宿主植物相同或相似的活性代谢产物。长期以来,真菌诱导子广泛应用于植物细胞培养中,被认为是提高次生代谢产物产量最有效的途径之一[23]。真菌诱导子可以对植物无菌苗、愈伤组织、毛状根、悬浮细胞培养物生长产生明显的影响,可以诱导培养物产生和积累次生代谢产物,其诱导效果与诱导子的种类、浓度、添加时间、处理时间、培养条件等因素有关[24]。到目前为止,已有大量关于经高温灭菌处理的真菌菌丝、菌液或孢子促进植物培养物次生代谢产物生产的例子。赵建娜等[25]发现野生春兰和华石斛根部分离的内生真菌菌丝提取物可以促进象牙白种子萌发形成的原球茎的生长和分化。袁亚菲等[26]人的研究表明,内生青霉菌(Penicilliumsp.)的菌液和菌丝能较好的促进黄花蒿组培苗的生长,促进青蒿素的合成。在茅苍术细胞悬浮培养体系中添加灭活菌丝和菌液混合物,可以提高苍术素的产量[24]。
本研究发现8株内生真菌诱导子均能提高宿主苦豆子喹诺里西啶生物碱的含量,与对照组相比差异极显著。部分内生真菌如菌株NDZKDF13(Alternariatenuissima)和菌株XKYKDF40(Exophialasp.)能有效地提高宿主植物培养物(愈伤组织和无菌苗)的生长和喹诺里西啶生物碱的含量。由于无菌苗中的生物碱含量明显高于愈伤组织细胞,内生真菌对无菌苗中生物碱的提高也更明显。菌株XKYKDF40中的菌液浓缩物的生理效应要明显强于灭活菌丝,推测活性成分主要存在于菌液浓缩物中,具体是哪些成分起作用值得深入研究。研究表明,大部分内生真菌的灭活菌丝和菌液浓缩物对苦豆子无菌苗和愈伤组织细胞的生长有抑制作用,说明内生真菌中存在一定量的抑制活性成分(如真菌毒素等)[27]。添加不同浓度内生真菌菌液浓缩物作为诱导子,对苦豆子无菌苗喹诺里西啶生物碱含量有一定的影响,低浓度的真菌诱导子有利于苦豆子生物碱的合成,在0.01~1.0 mg·L-1浓度范围内,苦豆子无菌苗生物碱的含量与真菌诱导子的添加量呈正相关,当浓度为1.0 mg·L-1时,诱导效果最好。此外,诱导子处理时间对苦豆子无菌苗的影响较大,处理9 d起喹诺里西啶生物碱含量迅速增加,处理12 d达到最大值,这与文涛等[28]的研究结果相似。
近年来,人们陆续从黑麦草、疯草、苦豆子等禾本科、豆科植物中分离到能够产生宿主植物生物碱的内生真菌,确定该类内生真菌与宿主植物生物碱的合成密切相关[29-30]。类似的结果在其它的培养物中也有发现,在长春花(Catharanthusroseus)细胞培养中选取的3种真菌,绿色木霉(Trichodermavirride)诱导子最有利于阿马里新的积累[6]。在长春花细胞培养中,畸雌腐霉(Pythiumirregulare)对阿马里新的合成最有利,而镰刀菌(Fusariumsolani)对长春质碱的诱导效果最好[8]。不同的真菌诱导子对不同的培养物具有不同的效果。迄今为止,还没有找到普遍适用的某一类或某一种真菌,这使得研究者必须寻找针对某种培养物具有最佳诱导效果的真菌诱导子,因此,真菌种类的选择至关重要[23]。
总之,在苦豆子无菌苗或细胞培养物中添加一定量的内生真菌灭活菌丝或菌液浓缩物,对于提高宿主喹诺里西啶生物碱的含量是一种有效的方法。研究也暗示了通过内生真菌调控宿主植物次生代谢产物的可能性,为进一步研究内生真菌促进宿主植物生长及次生代谢的调控机制奠定了基础。
[1] 肖春桥,高 洪,池汝安.诱导子促进植物次生代谢产物生产的研究进展[J].天然产物研究与开发,2004,16(5):473-476,472.
[2] 高兴喜,姚 强,王 磊,等.真菌激发子对灵芝液体发酵生产多糖和三萜类物质的影响[J].食品科学,2009,30(23):309-313.
[3] 韩建荣,高宇英,赵文婧.几种诱导子对青霉PT95菌株固态发酵产生类胡萝卜素的影响[J].应用与环境生物学报,2005,11(2):208-210.
[4] Xu M J, Dong J F, Wang H Z, et al. Complementary action of jasmonic acid on salicylic acid in mediating fungal elicitor-induced flavonol glycoside accumulation of Ginkgo bioba cells[J]. Plant Cell Environ, 2009,32(8):960-967.
[5] 翟俏丽,范桂枝,詹亚光.真菌诱导子促进白桦悬浮细胞三萜的积累[J].林业科学,2011,47(6):42-47.
[6] Namdeo A, Patil S, Fulzele D P. Influence of fungal elicitor on production of ajmalicine by cell culture of Catharathus roseus[J]. Biotechnol Prog, 2002,18(1):159-162.
[7] 魏宝东,潘娅慧,王亚男,等.促进纳他霉素合成的真菌诱导子筛选及诱导条件优化[J].食品科学,2013,34(7):196-200.
[8] Zhao J, Zhu W H, Hu Q. Selection of fungal elicitors to increase indole alkaloid accumulation in Catharanthus roses suspension cell culture[J]. Enzyme and Microbial Technology, 2001,28(7):666-672.
[9] Xu C M, Zhao B, Ou Y, et al. Elicitor-enhanced ayringin production in suspension cultures of Saussurea medusa[J]. World J Microbiol Biotechnol, 2007,23(7):965-970.
[10] 姚领爱,胡之璧,王莉莉,等.植物内生菌与宿主关系研究进展[J].生态环境学报,2010,19(7):1750-1754.
[11] 方 芳,戴传超,张 波,等.茅苍术悬浮细胞系建立及内生真菌诱导子对其挥发油积累的影响[J].中草药,2009,40(3):452-455.
[12] 张瑞芬,李培琴,赵江林,等.盾叶薯蓣内生真菌及其对宿主培养物生长和皂苷元生产的影响[J].天然产物研究与开发,2010,22(1):11-15.
[13] 王亚洲,古绍彬,刘胜男,等.真菌诱导子对纳他霉素生物合成的影响[J].中国食品添加剂,2015,(2):63-68.
[14] 张守润,纪 瑛,蔺海明.施氮对苦豆子生物性状和生物量积累动态的响应[J].草业科学,2008,25(3):37-42.
[15] 刘 军,熊元君,李 勇,等.苦豆子研究近况[J].新疆中医药,2006,24(6):60-63.
[16] 顾沛雯,郝 丽,徐 润,等.宁夏白芨滩自然保护区苦豆子内生真菌的区系组成及其抑菌活性[J].西北农林科技大学学报:自然科学版,2012,40(5):209-216.
[17] 余永涛,何生虎,赵清梅.宁夏苦豆子中产苦参碱内生真菌的分离与鉴定[J].中国农业科学,2013,46(13):2643-2654.
[18] 周星辰,郝 丽,张 伟,等.产喹诺里西啶碱苦豆子内生真菌的筛选与鉴定[J].农业科学研究,2013,34(1):28-32.
[19] 张延威,韩燕峰.石斛内生真菌多样性的初步研究[J].贵州教育学院学报:自然科学版,2009,25(6):9-12.
[20] 周星辰.苦豆子内生真菌遗传多样性及其产喹诺里西啶生物碱菌株的筛选[D].银川:宁夏大学,2014.
[21] 刘建利,林 勤,闫兴富.宁夏地区苦豆子内生真菌的分离与初步鉴定[J].干旱地区农业研究,2012,35(5):193-199.
[22] Zhao J, Shan T, Mou Y, et al. Endophytic fungi for producing bioactive compounds originally from their host plants[J]. Mini-Reviews in Medicinal Chemistry, 2011,11(2):159-168.
[23] 张瑞芬,李培琴,周立刚.真菌诱导子对植物培养物生长和次生代谢产物合成影响之研究进展[J].中国农学通报,2008,24(9):260-264.
[24] 陶金华,濮雪莲,江 曙.内生真菌诱导子对茅苍术细胞生长及苍术素积累的影响[J].中国中药杂志,2011,36(1):27-31.
[25] 赵建娜,刘红霞.真菌诱导子对象牙白原球茎生长的影响[J].生态科学,2008,27(3):134-137.
[26] 袁亚菲,董 婷,王剑文.内生青霉菌对黄花蒿组培苗生长和青蒿素合成的影响[J].氨基酸和生物资源,2011,33(4):1-4.
[27] 潘学武,董妍玲,石亚亚.真菌诱导子和抗褐变剂对喜树悬浮细胞生长及喜树碱生物合成的影响[J].中国农学通报,2010,26(20):21-26.
[28] 文 涛,曾 杨,喻 晓,等.真菌诱导子对虎杖愈伤组织中白藜芦醇合成的影响[J].核农学报,2008,22(4):435-438.
[29] Di M M, Finch S C, Popay A J, et al. A review of the Neotyphodium lolii or Lolium perenne symbiosis and its associated effects on animal and plant health, with particular emphasis on ryegrass staggers[J]. New Zealand Veterinary Journal, 2012,60(6):315-328. [30] Cook D, Gardner D R, Grum D, et al. Swainsonine and endophyte relationships in Astragalus mollissimus and Astragalus lentiginosus[J]. Journal of Agricultural and Food Chemistry, 2011,59:1281-1287.
EffectofSophoraalopecuroidesL.endophyticfungionthegrowthofthehostplantcultureandsynthesisofquinolizidinealkaloids
GAO Yuan1,3, SUN Mu-di1, XU Quan-zhi1, LV Xi1, ZHANG Qing-chen2, Gu Pei-wen1
(1.AgriculturalCollege,NingxiaUniversity,Yinchuan,Ningxia750021,China; 2.SchoolofPharmaceuticalSciences,ShandongUniversity,Jinan,Shandong250012,China; 3.Huai'anEntryandExitInspectionandQuarantineBureau,Huai'an,Jiangsu223001,China)
Eight strains of endophytic fungi were isolated and identified as the fungal elicitors from the healthy plant ofS.alopecuroidesL. and then their autoclaved mycelia and concentrated filtrates were made respectively to study the effect of different types, concentration and eliciting time of endophytic fungal elicitors on the growth of aseptic seedling and callus tissue ofS.alopecuroidesL., and the content of quinolizidine alkaloids. Among the 8 strains of endophytic fungal elicitors, the elicitation effect of the concentrated filtrate was stronger than those of the autoclaved mycelia. The autoclaved mycelia and concentrated filtrates of HMGKDF1promoted the growth of callus, with the rate of growth being 1.82 and 1.42 times higher than that in CK, respectively. The concentrated filtrate of NDZKDF13has a strong effect on the accumulation of quinolizidine alkaloids ofS.alopecuroidesL. The content of total alkaloids was 0.5483 mg·g-1, 23.8 times higher than that in CK. Within a certain range (0.01~1.0 mg·L-1), endophytic fungal elicitors promoted the synthetic accumulation of quinolizidine alkaloids of the host plant. After 12 days of induction by endophytic fungal elicitors, the content of quinolizidine alkaloids reached the highest amount, 2.65 times higher than that in CK. Addition of the autoclaved mycelia or concentrated filtrates from the endophytic fungi into aseptic seedlings and callus tissues ofS.alopecuroidesL. could be an effective way to increase the content of quinolizidine alkaloids and to improve the growth of the plant.
SophoraalopecuroidesL.; endophytic fungal; fungal elicitor; plant culture; quinolizidine alkaloids
1000-7601(2017)03-0212-07doi:10.7606/j.issn.1000-7601.2017.03.33
2016-04-12
:2017-03-15
:国家自然基金项目“苦豆子内生真菌促进宿主喹诺里西啶生物碱合成积累的机制研究”(31260452)
高 媛(1988—),女,山东日照市人,硕士,主要从事生物防治与菌物资源利用。 E-mail:elfish521@163.com。
顾沛雯(1969—),女,教授,主要从事生物防治与菌物资源利用研究。 E-mail:gupeiwen2013@126.com。
Q949.32; S567.23
: A
