男性年龄与精子质量和精浆生化的关系
2017-07-18毛金观彭忠英李琴
毛金观,彭忠英,李琴
(1.南京市仙林鼓楼医院,南京 210046;2.嘉兴市妇幼保健院,嘉兴 314000)
男性年龄与精子质量和精浆生化的关系
毛金观1*,彭忠英2,李琴2
(1.南京市仙林鼓楼医院,南京 210046;2.嘉兴市妇幼保健院,嘉兴 314000)
目的 探讨不同年龄段男性精子质量与精浆弹性硬蛋白酶和精浆中性α-葡萄糖苷酶的关系。 方法 回顾性分析在嘉兴市妇幼保健院门诊检测精子质量和精浆生化(精浆弹性硬蛋白酶、精浆中性α-葡萄糖苷酶)的3 262例患者的临床资料。根据年龄分为5组:<25岁组、25~29岁组、30~34岁组、35~39岁组和≥40岁组;并按精子质量分为少弱精子症(301例)、少精子症(193例)、弱精子症(1 335例)及正常精子组(1 433例)。统计分析不同精子质量不同年龄段男性的精浆弹性硬蛋白酶、精浆中性α-葡萄糖苷酶资料。 结果 (1)3 262例精液分析,精浆中性α-葡萄糖苷酶异常发生率7.14%,精浆弹性硬蛋白酶水平确诊感染率29.25%;(2)各年龄组总体精浆中性α-葡萄糖苷酶异常发生率相似(P>0.05),生殖道感染发生率随年龄增加有增高趋势(P<0.05);(3)不同精子质量各组总体精浆中性α-葡萄糖苷酶异常发生率不同(P<0.05),其中少精子症和少弱精子症组均显著高于弱精子症组及精子正常组(P<0.05),但生殖道感染发生率相似(P>0.05);(4)随着年龄增加,不同精子质量各组精浆中性α-葡萄糖苷酶异常发生率相似(P>0.05),而精浆弹性硬蛋白酶异常发生率有增高趋势(P<0.05),其中少弱精子症、少精子症患者各年龄组间比较均有统计学差异(P<0.05);(5)各精子质量组精浆弹性硬蛋白酶测定值均随着年龄增加呈增高趋势,且正常精子组的精浆弹性硬蛋白酶测定值在35~39岁组及≥40岁组均显著高于<25岁组(P<0.05)。 结论 男科门诊患者中生殖道感染具有普遍性;伴随难以自愈的生殖道感染的少弱精子症、少精子症和弱精子症可能与男性患者年龄增加有关,亦可能与附性腺病变严重程度、病程进展所处不同阶段有关。
年龄; 精子质量; 弹性硬蛋白酶; 中性α-葡萄糖苷酶
(JReprodMed2017,26(7):679-684)
男性不育患者以精子数量减少、精子活力异常多见。精浆弹性硬蛋白酶检测是一种敏感、特异性炎症指标[1]。中老年年龄增加会使机体免疫力下降,可能更容易发生生殖道感染。生殖道感染可能会影响男性生殖腺,尤其是附睾炎症,影响附睾分泌精浆中性α-葡萄糖苷酶。精浆中性α-葡萄糖苷酶含量和活力与精子活力及精子浓度都有密切关系[2-3]。本文通过回顾性分析本院门诊检测的不同年龄段的男性精子质量与精浆生化资料,探讨男性年龄与精子质量与精浆弹性硬蛋白酶和精浆中性α-葡萄糖苷酶的关系。
资料与方法
一、对象及分组
回顾性分析2014年1月至2015年12月在嘉兴市妇幼保健院门诊检测精子质量并同时行精浆弹性硬蛋白酶和精浆中性α-葡萄糖苷酶检测者3 262例。根据年龄分为5组:<25岁组、25~29岁组、30~34岁组、35~39岁组和≥40岁组;并按精液质量分为少弱精子症、少精子症、弱精子症及正常精子组。
二、精液分析及精子质量判定
取样前3 d禁酒并且禁欲3~7 d精液检查。精液采集后置37℃恒温箱内液化,采用SCA精子质量分析仪(西班牙)检测精子浓度和活力。
精子质量诊断标准参照第五版《世界卫生组织人类精液检查与处理实验室手册》[4]。参考值下限:精液体积1.5 ml,精子总数39×106/一次射精,精子浓度15×106/ml,前向运动(PR)32%。
正常精子:精子总数(或浓度,取决于报告结果)、前向运动(PR)精子百分率均等于或高于参考值下限;
弱精子症:前向运动(PR)精子百分率低于参考值下限;
少弱精子症:精子总数(或浓度,取决于报告结果)和前向运动(PR)精子百分率低于参考值下限;
少精子症:精子总数(或浓度,取决于报告结果)低于参考值下限。
三、精浆生化检测
精液分析的同时采用相应的定量检测试剂盒(深圳华康生物)行精浆弹性硬蛋白酶和精浆中性α-葡萄糖苷酶定量检测;检测仪器为深圳雷杜RT-6000酶标分析仪,实验操作按试剂盒说明书。
精浆弹性硬蛋白酶定量测定结果判断:正常者<290 ng/ml,隐行感染者290~1000 ng/ml,确诊感染者>1 000 ng/ml。
精浆中性α-葡萄糖苷酶定量测定结果判断:正常参考值为≥20 mU/一次射精。
四、分析指标
精浆生化检测异常的总体发生率、在各年龄组的发生率以及在不同精子质量组的发生率;不同精子质量在不同年龄段的精浆生化异常发生率和精浆生化测定值。
五、统计方法
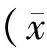
结 果
一、一般情况
3 262例精液分析结果,精浆中性α-葡萄糖苷酶异常233例,发生率7.14%;精浆弹性硬蛋白酶>1 000 ng/ml为确诊感染者954例,发生率29.25%。
二、总体各年龄组精浆生化异常发生率比较
各年龄组精浆中性α-葡萄糖苷酶异常发生率比较,无统计学差异(χ2=4.448,P=0.349);总体各年龄组精浆弹性硬蛋白酶确诊感染异常发生率比较,差异有统计学意义(χ2=47.365,P=0.000)(表1)。
三、不同精子质量各组精浆生化异常发生率比较
少精子症、少弱精子症、弱精子症、正常精子者中的精浆中性α-葡萄糖苷酶异常发生率不同,差异有统计学意义(χ2=3.355E2,P=0.000),其中少精子症异常发生率显著高于弱精子症和正常精子者(χ2=2.496E2、1.766E2,均P=0.000),少弱精子症异常发生率显著高于弱精子症和正常精子者(χ2=1.514E2、98.220,均P=0.000);精浆弹性硬蛋白酶异常发生率相似,差异无统计学意义(χ2=5.545,P=0.136)(表2)。

表1 不同年龄各组总体精浆生化异常发生率比较
注:各年龄组总体比较,*P<0.05
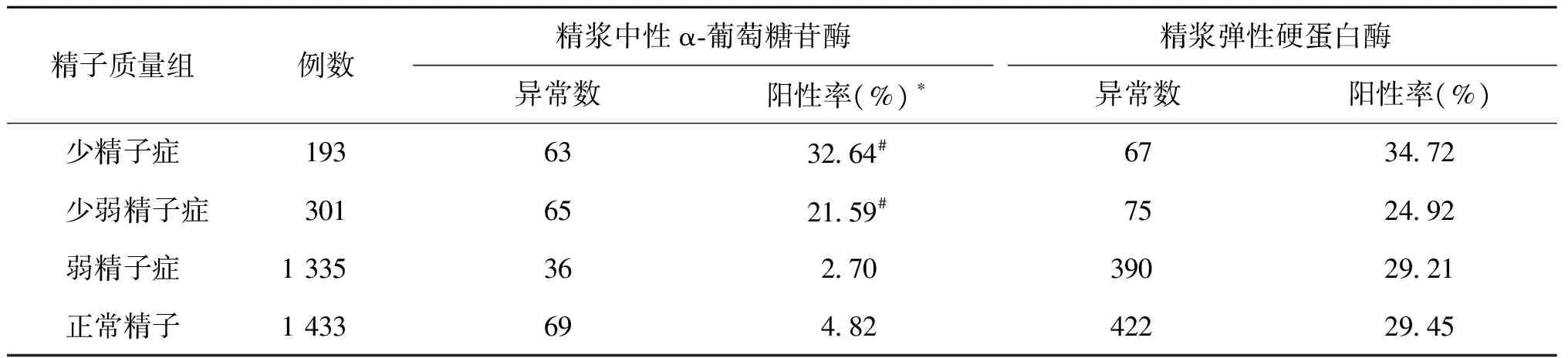
表2 不同精子质量各组精浆生化异常发生率比较
注:精子质量各组总体比较,*P<0.05;与弱精子症和正常精子组比较,#P<0.05
四、不同精子质量组各年龄段的精浆生化异常发生率比较
1.少弱精子症组:各年龄组精浆中性α-葡萄糖苷酶异常发生率相似(P>0.05);随年龄增加精浆弹性硬蛋白酶异常发生率增高(P<0.05),其中≥40岁组显著高于<25岁组(P<0.05)。
2.少精子症组:各年龄组精浆中性α-葡萄糖苷酶异常发生率相似(P>0.05),其中<25岁组最低;年龄增加精浆弹性硬蛋白酶异常发生率增高(P<0.05),其中35~39岁组和≥40岁组显著高于<25岁组(均P<0.05)。
3.弱精子症组:各年龄组精浆中性α-葡萄糖苷酶异常发生率相似(P>0.05),其中以<25岁组最高;精浆弹性硬蛋白酶异常发生率在25~29岁组显著低于其他各组(均P<0.01)。
4.正常精子组:各年龄组精浆中性α-葡萄糖苷酶异常发生率相似(P>0.05);随年龄增加,精浆弹性硬蛋白酶异常发生率增高(P<0.01),其中35~39岁组和≥40岁组显著高于<25岁组(均P<0.05)(表3)。
五、不同精子质量各组精浆弹性硬蛋白酶检测结果比较
不同精子质量各年龄组精浆弹性硬蛋白酶检测结果比较显示,大部分随年龄增加,检测结果有增高趋势,但只有正常精子组中35~39岁组和≥40岁组显著高于<25岁组(均P<0.05)(表4)。

表3 不同精子质量不同年龄段各组精浆生化异常发生率比较[%(n)]
注:同一精子质量组各年龄组总体比较,※P<0.05;与同一精子质量组<25岁组比较,*P<0.05;与同一精子质量组其他各年龄组比较,#P<0.01
讨 论
本研究结果显示,男科门诊患者精浆弹性硬蛋白酶>1 000 ng/ml确诊感染者的总体发生率为29.25%,少弱精子症、少精子症等不同精子质量各组检测精浆弹性硬蛋白酶异常为确诊感染者大约为25%~35%,男性患者生殖道感染具有普遍性。不同精子质量各组生殖道感染普遍存在且发病率都很高,少精子症确诊感染者占34.72%,与文献报道的32.9%[5]相似,郑九嘉等[6]报道IVF-ET治疗的男性不育患者中感染发生率高达37.57%(275/732)。不同精子质量各组精浆弹性硬蛋白酶检测异常的总体发生率相似,但精浆中性α-葡萄糖苷酶异常的总体发生率在不同精子质量组间有统计学差异,生殖道感染对附睾的影响值得深入研究。
我们2011~2012年男科门诊筛查精液者的确诊感染发生率为31.87%(363/1139)[7],前期研究资料弱精子症患者确诊感染发生率为34.85%(92/264),精子检查正常者的确诊感染发生率为31.30%(41/131)[8]。男性生殖道感染普遍存在,大部分随着年龄增加,精浆弹性硬蛋白酶异常发生率和精浆弹性硬蛋白酶测定值有增高趋势。临床上经
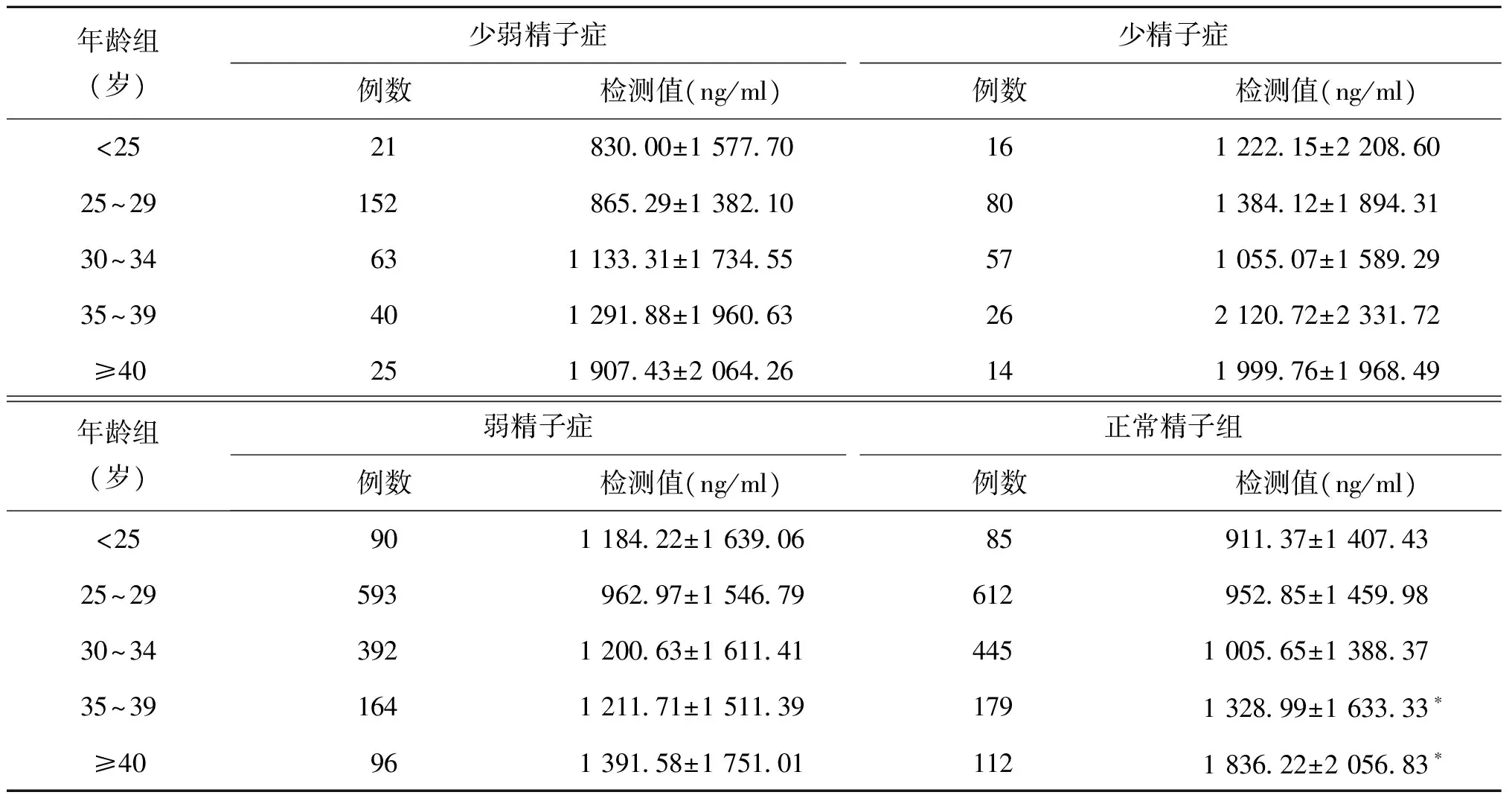
表4 不同精子质量各年龄组精浆弹性硬蛋白酶检测结果比较(x-±s)
注:与同一精子质量组内<25岁组比较,*P<0.05
常遇见精液量增多超过正常范围者,可能为感染早期,可能与感染早期各生殖腺腺体分泌量增多有关。
少弱精子症和弱精子症患者中确诊感染者的精液量及精子总数均降低[9],梗阻性无精子症、严重少精子症等精子质量越差,精浆果糖异常发生率越发增高[10],弱精子症和精子检查正常者中确诊感染者的精浆果糖测定值降低[8]。生殖道感染很难自愈也很难彻底治愈,男性患者生殖道感染随年龄增加,生殖腺病变时间更久,慢性感染持续存在,部分患者病情越来越严重。一个35岁的男性患者,可能在30岁时感染,精子浓度、精子活力、精子总数出现下降,35岁来院检查时,有的精子质量可能还在正常范围,有的可能已经为少弱精子症。男科门诊经常遇见间隔6个月、一年或更久要求复查精液的男性不育患者精子质量越来越差,生殖道感染可能是重要的致病因素之一。男科门诊中我们需要关注精子检查正常者,他们随年龄增加,也有可能存在精浆生化异常,更有可能因为生殖道感染已经引起精子浓度、精子活力、精子总数下降,但尚未到不正常状态,增加精浆生化检查有可能尽早发现男性不育病因。
不同年龄各组测定精浆中性α-葡萄糖苷酶异常发生率相似,不同精子质量各组测定精浆中性α-葡萄糖苷酶异常发生率在少精子症和少弱精子症中较高,而且属于同一精子诊断学分类的各年龄组精浆中性α-葡萄糖苷酶异常发生率随年龄增加有增高趋势,提示生殖道感染随患者的年龄增加附睾破坏越来越严重。精浆中性α-葡萄糖苷酶定量检测结果异常者,其一次射精精液量及一次射精精子总数均降低[11]。确诊感染者的精浆中性α-葡萄糖苷酶异常发生率增加;精子活力小于10%者,精浆中性α-葡萄糖苷酶异常发生率及精浆中性α-葡萄糖苷酶测定值也是显著降低[9]。本研究显示,男性患者年龄增长导致精浆生化异常发生率增加。由此我们推测,男性患者的慢性生殖道感染随年龄增长,慢性炎症长期影响附睾等生殖腺病变严重,可能会导致少弱精子症等男性不育患者精液量、精子总数和精子活力明显降低。
精浆弹性硬蛋白酶含量<290 ng/ml的男性不育患者的精子DNA碎片指数明显低于精浆弹性硬蛋白酶含量>1 000 ng/ml的患者[12]。生殖道感染的男性不育患者的精子DNA损伤程度增加[13]。生殖道感染是导致男性不育患者精子DNA损伤的重要因素之一。40岁及以上男性不育患者的精子DNA碎片率的检出值明显高于40岁以下者[14]。与<35岁者和35~39岁者相比,≥40岁的男性不育患者的DNA完整精子百分率降低[15];精子DNA完整性差,影响辅助生殖技术临床结局[16]。因此,我们也建议,评价辅助生殖技术临床结局的影响因素时,应该考虑生殖道感染和年龄因素。
综上所述,男性不育患者尤其是实施辅助生殖技术的患者应常规检查精浆生化,尤其是二胎国策放开后,40岁以上的中年男性更应常规检测精浆生化。
[1] Nieschlag E,Behre HM.Andrology:male reproductive health and dysfunction[M].2nded.Berlin:Springer,2000:177-189.
[2] Elzanaty S,Richthoff J,Maim J,et al.The impact of epididymal and accessory sex gland function of sperm motility[J].Hum Reprod,2002,17:2904-2911.
[3] Roaiah MMF,Mostafa T,Salem D,et al.Alpha-glucosidase actlvity in infertile oligoasthenzoospermic men with and without varicocele[J].Andrologia,2007,39:28-32.
[4] 谷翊群,陈振文,卢文红,等译.世界卫生组织人类精液检查与处理实验室手册[M].第5版.北京:人民卫生出版社,2011:192-193.
[5] 王贺,邹德学,李世勤.精浆弹性硬蛋白酶与精液主要参数及精子功能相关性分析[J].中国男科学杂志,2009,23:55-57,62.
[6] 郑九嘉,郑屹,林杰,等.男性生殖系统感染与精液参数及体外受精-胚胎移植治疗结局的相关性[J].中华传染病杂志,2015,33:168-170.
[7] 毛金观.解脲支原体与精浆柠檬酸、弹性硬蛋白酶相关性分析[J].生殖医学杂志,2013,22:878-880.
[8] 毛金观,李琴.生殖道感染对男性不育患者精浆果糖的影响[J].中华临床医师杂志(电子版),2015,9:82-84.
[9] 毛金观,彭忠英,杨戎威,等.生殖道感染不育患者精浆生化指标与精液参数的相关分析[J].浙江医学,2016,38:1519-1520.
[10] 毛金观,蔡文伟.无精子症、少弱精子症患者精子质量与精浆果糖相关性研究[J].中国卫生检验杂志,2014,24:395-396.
[11] 毛金观,李琴,蔡文伟.1745例精子质量与精浆中性a-葡萄糖苷酶检测结果分析[J].中国优生与遗传杂志,2012,20:109-110.
[12] 魏倩君,杨运霞,张婷婷,等.精浆弹性硬蛋白酶与精子DNA完整性及精液参数的影响分析[J].国际泌尿系统杂志,2015,35:584-586.
[13] 贝华锋,张晓霞,魏任雄,等.精浆弹性蛋白酶与精液常规参数及精子DNA完整性的相关性研究[J].中华男科学杂志,2014,20:902-906.
[14] 张玲,王厚照,田丰丰,等.厦门地区男性低生育能力患者年龄与精子DNA完整性关系的探讨[J].中国优生与遗传杂志,2012,20:123-124.
[15] 乜照燕,吴海峰,张娜,等.不同年龄对精子凋亡率及DNA完整性影响的研究[J].中华男科学杂志,2012,18:1004-1008.
[16] 李洁,杨菁,徐望明,等.精浆piRNA对精子DNA完整性及辅助生殖技术结局的影响[J].生殖医学杂志,2014,23:897-901.
[编辑:罗宏志]
Relationship between ages and sperm quality and seminal plasma biochemical indexes
MAOJin-guan1*,PENGZhong-ying2,LIQin2
1.NanjingXianlin-GulouHospital,Nanjing2100462.JiaxingMaternal&ChildHealthHospital,Jiaxing314000
Objective:To investigate the relationship between age and sperm quality and biochemical indexes of seminal plasma.
Methods:The clinical data of 3 262 patients with sperm quality and seminal plasma biochemistry indicators (seminal plasma elastase & α-glycosidase) in Jiaxing Maternal & Child Health Hospital were analyzed retrospectively.The patients were divided into 5 groups according to the age:<25 year group,25-29 year group,30-34 years group,35-39 years group and≥40 years group.In addition,the patients were divided into oligoasthenospermia (n=301),oligozoospermia (n=193) and asthenospermia (n=1335) and normal sperm group (n=1433) according to sperm quality.The correlation between the age or sperm quality and seminal plasma elastase & α-glycosidase was analyzed.
Results:The abnormal rate of seminal plasma α-glycosidase was 7.14%,and the infection rate confirmed by seminal plasma elastase level was 29.25% in 3 262 patients.The abnormal rate of α-glycosidase was similar among the different age groups (P>0.05).The infection rate was significantly increased with age (P<0.05).The abnormal rate of α-glycosidase was significantly different among the different sperm quality groups (P<0.05).The abnormal rate of α-glycosidase in oligoasthenospermia or oligozoospermia was significantly higher than that of asthenospermia or normal sperm group (P<0.05),while the infection rate was similar (P>0.05).The abnormal rate of α-glycosidase was similar in different sperm quality group with the increase of age (P>0.05),while the abnormal rate of seminal plasma elastase was significantly increased with age (P<0.05),which also was significant different in the patients with oligoasthenospermia or oligozoospermia among the different age group (allP<0.05).The tendency of the seminal plasma elastase levels was increased with age in different sperm quality groups.Compared with<25 years old group,the seminal plasma elastase levels of normal sperm group with 35-39 years old and≥40 years old was significantly increased (P<0.05).
Conclusions:Reproductive tract infection in male clinic patients is universality. Oligoasthenospermia,oligozoospermia,and asthenospermia in patients with difficult to self-healing of reproductive tract infections may be related the patients’ age and the severity and advancement of infertile patients’ accessory sex gland lesions.
Age; Sperm Quality; Elastasey; α-glycosidase
10.3969/j.issn.1004-3845.2017.07.012
2016-12-22;
2017-01-23
嘉兴市科技计划(2015AY23035)
毛金观,男,浙江平湖人,学士,主任医师,生殖医学、男科专业.(*通讯作者,课题主持人原嘉兴市妇幼保健院毛金观于2016年9月入职南京市仙林鼓楼医院)
