枯草芽孢杆菌发酵生产聚-γ-谷氨酸的条件优化
2017-07-18武国慧张蕾高德才李鹏程张鹰石元亮1
武国慧,张蕾,高德才,李鹏程,张鹰,石元亮1,,*
(1.中国科学院沈阳应用生态研究所,辽宁沈阳110016;2.中国科学院大学,北京100049;3.辽宁中科生物工程有限公司,辽宁本溪117004)
枯草芽孢杆菌发酵生产聚-γ-谷氨酸的条件优化
武国慧1,2,张蕾1,2,高德才1,2,李鹏程3,张鹰3,石元亮1,3,*
(1.中国科学院沈阳应用生态研究所,辽宁沈阳110016;2.中国科学院大学,北京100049;3.辽宁中科生物工程有限公司,辽宁本溪117004)
为提高聚-γ-谷氨酸(poly-γ-glutamic acid,γ-PGA)产量,降低其生产成本,利用枯草芽孢杆菌(Bacillus subtilis),采用单因素试验及正交试验优化法,探究培养基组分及发酵条件对γ-PGA发酵产量的影响。结果表明:最佳培养基组成和培养条件为:蔗糖5%,谷氨酸钠6%,氯化铵0.3%,磷酸氢二钾2%,磷酸二氢钾0.1%,硫酸锰0.003%,pH 7.0,接种量为3%,发酵温度33℃,发酵时间48 h。与未优化前γ-PGA产量(15.8 g/L)相比,经优化后的产量达20.8 g/L,提高了31.65%。
聚-γ-谷氨酸;液体发酵;微生物合成;培养基;正交设计
聚-γ-谷氨酸(poly-γ-glutamic acid,γ-PGA)是微生物(主要为芽孢杆菌类)发酵的产物,由L-谷氨酸(L-Glu)、D-谷氨酸(D-Glu)单体通过 γ-酰胺键聚合而成的一种阴离子高分子型聚合物[1]。它的基本碳骨架分子呈直链型,主链上存在着大量的氢键、肽键和游离羧基,使γ-PGA具有水溶性、生物相容性和生物降解性能。另外,游离羧基使γ-PGA具有大量的活性位点,可发生交联、螯合、衍生化等反应[2],便于材料的功能化,易与其它材料聚合形成新型复合材料,使γ-PGA在医药、食品及化妆品、污水处理和农业等领域显示出十分广阔的应用前景[3]。然而,由于γ-PGA发酵产量低、成本高,限制了其广泛的应用。因此,研究如何提高γ-PGA产量具有非常重要的意义。
目前,γ-PGA的生产方法主要有化学合成法、直接提取法、酶转化法和微生物发酵法[4]。与其它方法相比,微生物发酵法具有条件温和、周期短、γ-PGA产量高且分子量分布合适等优点[5],已经成为国内外研究的热点。美国、日本、韩国等在γ-PGA合成与应用方面进行了很多研究,尤其日本味之素和明治制果公司,成功研发并实现了商业化生产。国内对γ-PGA的研究正处于兴起阶段,其中台湾味丹公司已成功实现了工业化,华中农业大学、南京工业大学等高校及研究所也相继开展了发酵和应用方面的研究[6-7]。
然而,采用微生物发酵法生产γ-PGA时,由于菌株代谢途径复杂,至今仍处推测之中,尚欠定论,调节方式也多样化,从而给提高γ-PGA产量带来了较大的困难,使生产成本较高,阻碍了工业化生产。因此,本试验采用单因素试验并结合正交试验优化法,对该枯草芽孢杆菌的生产条件进行优化,以期提高γ-PGA产量和生产强度,降低其生产成本,为工业化生产提供理论基础和数据支撑。
1 材料与方法
1.1 试验材料
1.1.1 菌种
枯草芽孢杆菌(Bacillus subtilis):土壤养分高效利用工程研究室保存。
1.1.2 培养基
种子培养基:葡萄糖2%,谷氨酸钠1%,蛋白胨0.5%,磷酸氢二钾0.2%,pH 7.0;发酵培养基:葡萄糖5%,谷氨酸钠4%,硫酸铵0.5%,磷酸氢二钾2%,磷酸二氢钾0.1%,硫酸锰0.003%,pH 7.0。
1.2 设计与方法
1.2.1 菌种培养方法
种子培养:250 mL三角瓶内装50 mL种子培养基,接种甘油管种子100 μL,温度30℃,转速220 r/min,摇床振荡培养20 h,得发酵种子。
发酵培养:按5%的接种量将种子液接种于发酵培养基,250 mL三角瓶装液量为50 mL,30℃,220 r/min摇床振荡培养48 h。
1.2.2 摇瓶发酵条件优化方法的设计
分别考察不同接种量(1%、3%、5%、7%、9%)、初始 pH 值(5.0、6.0、7.0、8.0、9.0)、发酵温度(27、30、33、37、40 ℃)和发酵时间(24、36、48、60、72 h)对枯草芽孢杆菌生产γ-PGA的影响;另外,对碳源(葡萄糖、蔗糖、柠檬酸、糖蜜、味精渣)和氮源(硫酸铵、氯化铵、酵母膏、蛋白胨、玉米浆)种类及浓度进行了筛选,进而对蔗糖、氯化铵、谷氨酸钠和磷酸氢二钾组分浓度进行了正交优化。摇瓶试验均采用250 mL三角瓶,装液量为50 mL,30℃下220 r/min摇床振荡培养48 h。重复3次。
1.2.3 分析方法
细菌浓度的测定:发酵液稀释50倍,以蒸馏水作参比,可见光分光光度计660 nm下测定吸光度。谷氨酸含量的测定:SBA-40E型生物传感仪。γ-PGA的测定[8]:首先对发酵液离心,取上清液测谷氨酸单体的含量,然后对上清液用6 mol/L HCl,100℃水解4 h,再测定谷氨酸总量,2次测定的谷氨酸含量之差为聚谷氨酸含量。
1.3 数据处理与统计检验
所有试验数据均采用Microsoft Excel 2010进行整理,不同处理之间差异采用SPSS19.0软件进行单因素方差分析(one-way ANOVA),Duncan法进行显著性检验(P<0.05),所有结果的数据均以平均值±标准误的形式来表达,文中图均采用Origin 8.6软件绘制。
2 结果与分析
2.1 培养基组分对γ-PGA发酵产量的影响
2.1.1 碳源种类对γ-PGA发酵产量的影响
不同碳源对γ-PGA产量的影响见图1。
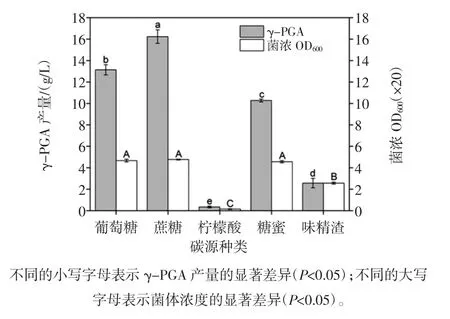
图1 不同碳源对γ-PGA产量的影响Fig.1 Effects of different carbon sources on γ-PGA yield
由图1可知,单一碳源菌体量的大小顺序为蔗糖≈葡萄糖≈糖蜜>味精渣>柠檬酸,统计结果表明,蔗糖、葡萄糖和糖蜜的菌体量无显著差异,并均显著高于味精渣和柠檬酸(P<0.05);γ-PGA发酵产量大小顺序为蔗糖(16.2 g/L)>葡萄糖(13.1 g/L)>糖蜜(10.2 g/L)>味精渣(2.6 g/L)>柠檬酸(0.3 g/L),t检验结果表明,两两之间均达到显著水平(P<0.05)。表明蔗糖作为碳源,γ-PGA发酵产量最高,葡萄糖次之,柠檬酸的γ-PGA发酵产量最低,与前人研究结果一致[9]。而Goto等[10]发现Bacillus subtilis IF03335以柠檬酸为单一碳源时却能够获得较高的γ-PGA产量,与本试验结果相反,这可能是由于本试验供试菌种缺少糖合成循环过程中的某种酶所造成的[11]。
2.1.2 氮源种类对γ-PGA发酵产量的影响
不同氮源对γ-PGA产量的影响见图2。
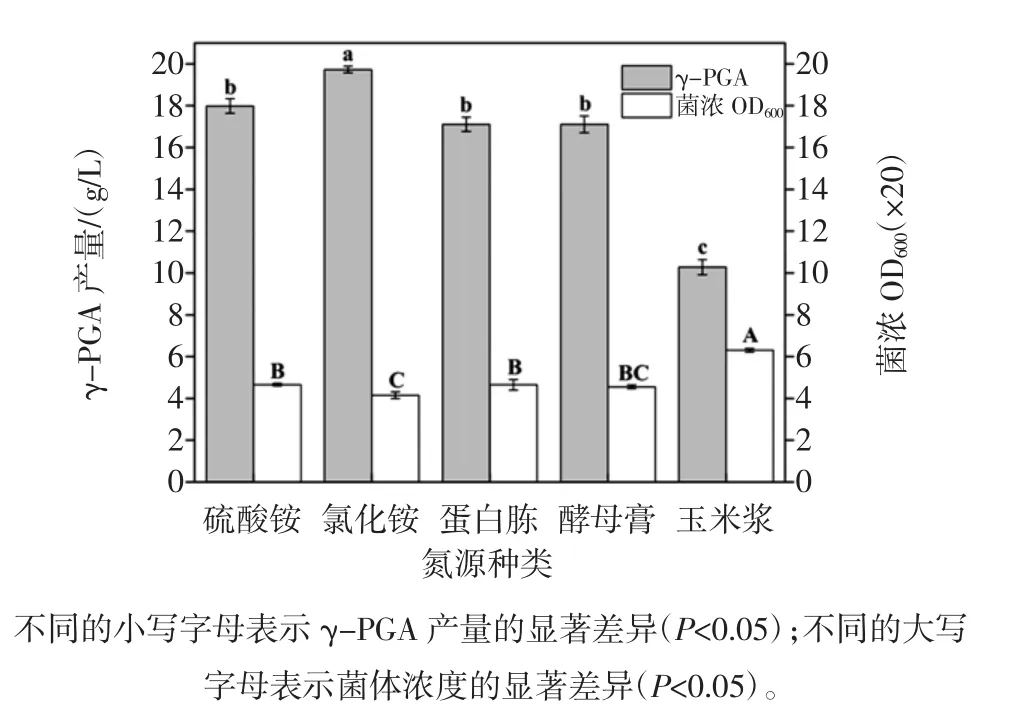
图2 不同氮源对γ-PGA产量的影响Fig.2 Effects of different nitrogen sources on γ-PGA yield
由图2可得,不同氮源菌体量大小顺序:玉米浆>蛋白胨>硫酸铵>酵母膏>氯化铵,统计结果表明,玉米浆的菌体量均显著高于其它氮源的菌体量(P<0.05);γ-PGA发酵产量大小顺序为氯化铵(19.7 g/L)>硫酸铵(18.0 g/L)>蛋白胨(17.1 g/L)=酵母膏(17.1 g/L)>玉米浆(10.2 g/L),统计结果表明,以氯化铵为氮源的γ-PGA发酵产量显著高于硫酸铵(P<0.05),且二者均显著高于以蛋白胨、酵母膏和玉米浆为氮源的γ-PGA发酵产量(P<0.05),由此可得,以无机氮(硫酸铵和氯化铵)作为氮源时,γ-PGA发酵产量较高,且无机氮中以氯化铵作为氮源时,γ-PGA发酵的产量最高,与前人研究结果一致。例如,Ito等[12]以NH4Cl作为Bacillus subtilis TAM-4发酵氮源时,也得到较高的γ-PGA产量。同时,与Jung等[13]研究中的高产菌株Bacillus sp.RKY3 KCTC 10412BP以蛋白胨为氮源相比,氯化铵成本较低,更适合工业化生产。
2.1.3 蔗糖、氯化铵、谷氨酸钠、磷酸氢二钾浓度对γ-PGA发酵产量的影响
蔗糖、氯化铵、谷氨酸钠、磷酸氢二钾浓度对γ-PGA产量的影响见图3。
由图3可知,蔗糖、氯化铵、谷氨酸钠、磷酸氢二钾浓度分别达到5%、0.5%、4%、2%时,γ-PGA发酵产量达到最大值,分别为 18.4、17.3、18.5、17.7 g/L。在蔗糖浓度达到5%后,进一步增加蔗糖浓度后,γ-PGA的产量反而降低,这可能是由于过高的蔗糖浓度导致了发酵液渗透压增加,使菌体生长受到抑制,阻碍了γ-PGA的合成,因此,本试验蔗糖的最佳浓度为5%。氯化铵的最佳浓度为0.5%,过高或过低的氯化铵浓度对γ-PGA的合成均不利,因此,本试验确定0.5%的氯化铵浓度更有利于γ-PGA产物的积累。谷氨酸钠的最佳浓度为4%,而较高谷氨酸钠反而不利γ-PGA的合成,这表明添加的谷氨酸钠并没有全部用来合成γ-PGA,可能更多的是作为一种诱导物[11],以激活γ-PGA合成的一系列酶,促使枯草芽孢杆菌合成γ-PGA。磷酸氢二钾的最佳浓度为2%,过高或过低的磷酸氢二钾浓度反而使γ-PGA的产量降低。
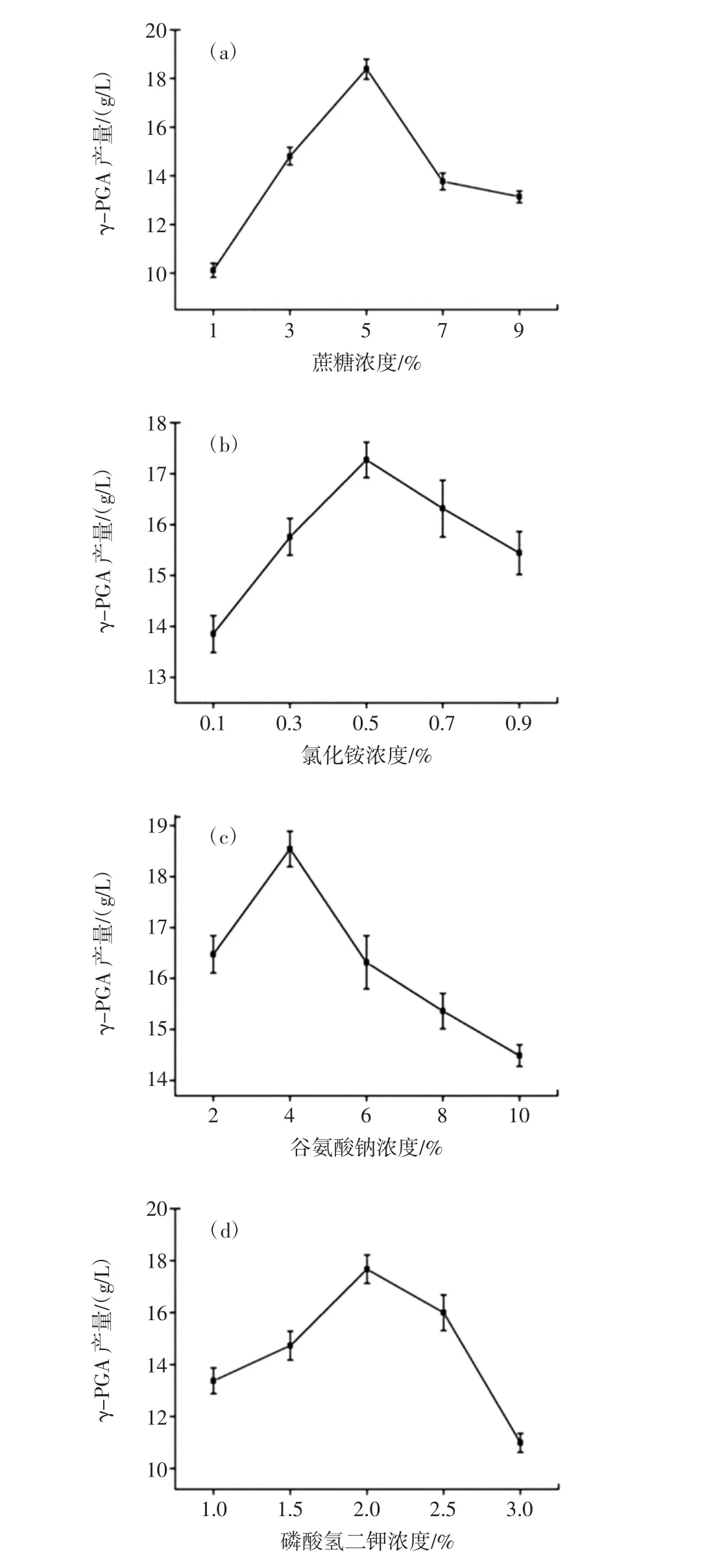
图3 蔗糖(a)、氯化铵(b)、谷氨酸钠(c)、磷酸氢二钾(d)浓度对 γ-PGA产量的影响Fig.3 Effects of different concentration of sucrose(a),NH4Cl(b),sodium glutamate(c)and K2HPO4(d)on γ-PGA yield
2.2 培养基组分正交试验结果
在单因素试验的基础上,综合试验结果,以γ-PGA产量为指标,选取蔗糖、氯化铵、谷氨酸钠、磷酸氢二钾4个因素为考察因素,每个因素设置3个水平,安排四因素三水平正交方案。因素水平表见表1。
按照确定的因素水平,参照L9(34)试验设计,设置3组平行试验以估计试验误差。极差分析结果显示:谷氨酸钠是影响γ-PGA产量的最重要因素,余者依次是氯化铵、蔗糖、磷酸氢二钾(表2)。
通过比较表2各因素各水平的均值,得出每个因素的最佳水平分别是:蔗糖选择水平2,即5%;氯化铵选择水平1,即0.3%;谷氨酸钠选择水平3,即6%;磷酸氢二钾选择水平2,即2.0%。
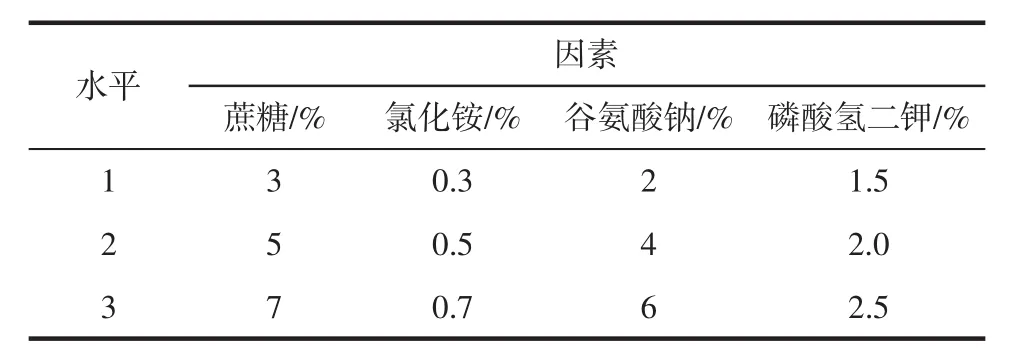
表1 正交设计因素与水平Table 1 Factors and levels of orthogonal design
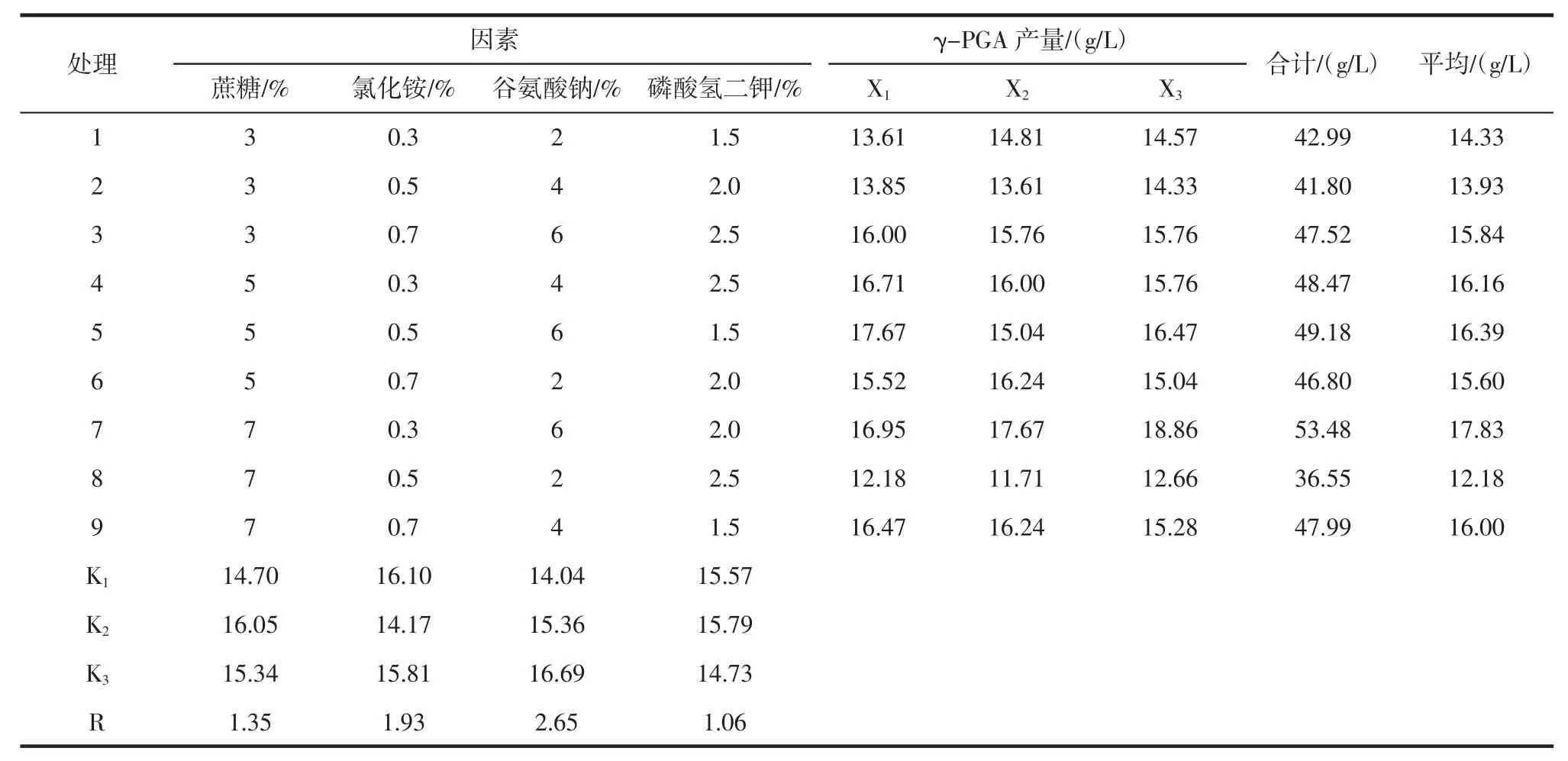
表2 正交试验结果与分析Table 2 Results and analysis of orthogonal design
2.3 培养条件对γ-PGA发酵产量的影响
2.3.1 不同接种量、初始pH、温度对γ-PGA发酵产量的影响
接种量、初始pH、培养温度对γ-PGA产量的影响见图4。
图4表明,当接种量、初始pH和培养温度分别达到3%、7和33℃时,γ-PGA发酵产量达到最大值,分别为19.6、15.4、19.8 g/L。采用上述试验确定的最佳发酵条件,将培养20 h的种子培养液,分别以1%、3%、5%、7%、9%的接种量接入发酵培养基,发酵48 h后分别测定γ-PGA的产量,得出最佳接种量为3%,过高或者过低的接种量,γ-PGA的产量反而较低,主要原因是较低的接种量会延长菌体生长的延迟期,导致发酵周期长;过高的接种量会使菌体消耗大量底物生长过快,从而不利于产物的积累[14]。
采用上述试验确定的最佳发酵条件,将pH分别调至 5.0、6.0、7.0、8.0、9.0,按 3%接种量将种子液接入发酵培养基,培养48 h,测定γ-PGA发酵产量,结果表明,pH在6.0~8.0时,γ-PGA产量较高,与前人研究结果不尽一致[15-17],原因是不同菌种所需的最适pH不同,因此应根据不同的菌种选取最适的pH。
采用上述试验确定的最佳发酵条件,按3%接种量将种子液接入pH为7.0的发酵培养基,分别在27、30、33、37、40℃下培养 48 h,测定 γ-PGA 的产量,得出最佳温度为33℃,与前人研究结果不一致[18],原因是不同菌种的最适温度不同,说明该菌种在33℃下菌体生长过程中起作用的酶系和γ-PGA合成酶系都很稳定且活力较高[19],使γ-PGA的产量最高。
2.3.2 发酵时间对γ-PGA发酵产量的影响
发酵时间对γ-PGA产量的影响见图5。
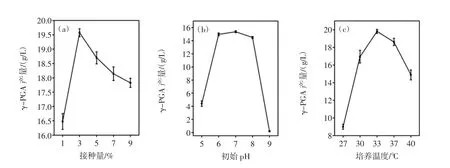
图4 接种量(a)、初始pH(b)、培养温度(c)对 γ-PGA产量的影响Fig.4 Effects of inoculum amount(a),initial pH(b)and temperature(c)on γ-PGA yield
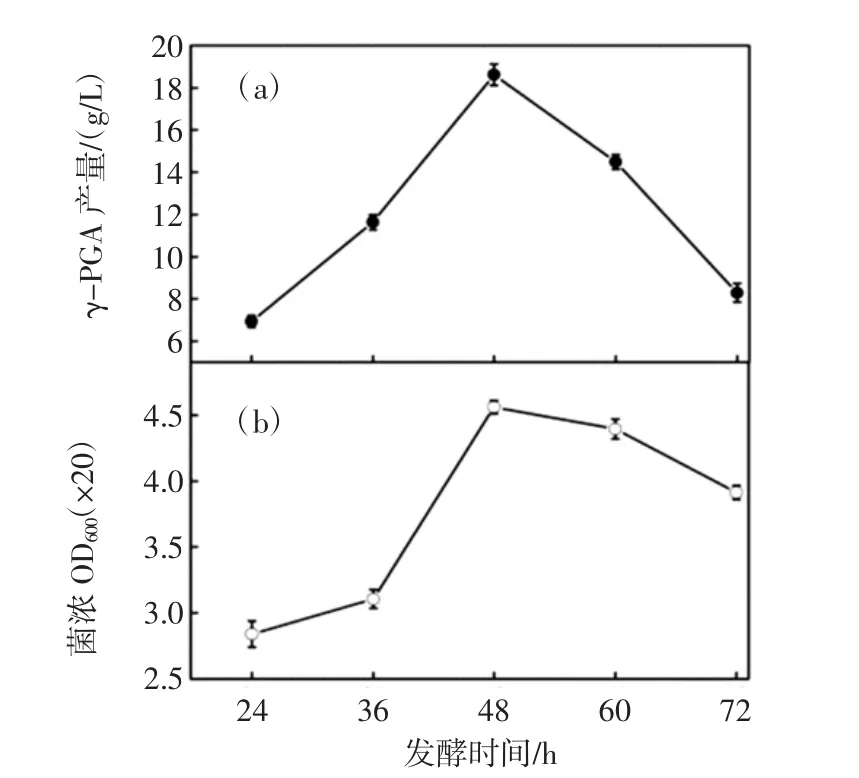
图5 发酵时间对γ-PGA产量的影响Fig.5 Effects of fermentation time on γ-PGA yield
由图5可知,发酵时间达到48 h时,γ-PGA的产量达到最大值(18.6 g/L)。Ju等[20]采用菌株B.subtilis MJ80的发酵周期为3 d,本试验采用枯草芽孢杆菌的发酵周期短,适合工业化生产需要。
2.4 验证试验结果
上述单因素及正交试验结果表明,适于该枯草芽孢杆菌的摇瓶发酵生产γ-PGA的最优组合为:蔗糖5%,谷氨酸钠6%,氯化铵0.3%,磷酸氢二钾2%,磷酸二氢钾0.1%,硫酸锰0.003%,pH 7.0,接种量为3%,发酵温度33℃,发酵时间48 h。为检验正交优化试验所得结果的可靠性,采用上述优化条件进行了3组枯草芽孢杆菌发酵生产γ-PGA的平行试验,结果表明,γ-PGA的平均产量为20.8 g/L,比优化前γ-PGA的产量(15.8 g/L)显著提高了31.65%(P<0.05)。
3 结论
通过对枯草芽孢杆菌发酵生产γ-PGA的发酵条件进行单因素及正交试验优化,筛选出发酵培养基组分和培养条件的最优组合:蔗糖5%,谷氨酸钠6%,氯化铵0.3%,磷酸氢二钾2%,磷酸二氢钾0.1%,硫酸锰0.003%,pH 7.0,接种量为3%,33℃下发酵培养48 h。在此优化条件下,γ-PGA产量达到20.8 g/L,比优化前提高了31.65%。
[1] 严涛,郗洪生.微生物合成γ-聚谷氨酸的相关基因、合成机理及发酵的研究进展[J].生物技术通报,2015,31(3):25-34
[2] 曹名锋,金映红,解慧,等.γ-聚谷氨酸的微生物合成、相关基因及应用展望[J].微生物学通报,2011,38(3):388-395
[3] 彭英云,张涛,缪铭,等.γ-聚谷氨酸的合成、性质和应用[J].食品与发酵工业,2012,38(6):133-138
[4] 石峰.微生物制备γ-聚谷氨酸的研究[D].杭州:浙江大学,2006
[5] 李德衡,赵兰坤,李树标.γ-聚谷氨酸的生物合成及应用研究进展[J].发酵科技通讯,2012,41(3):12-16
[6] 王金忠.γ-聚谷氨酸的发酵生产技术研究[D].济南:齐鲁工业大学,2012
[7]金鑫强.高产聚谷氨酸纳豆芽孢杆菌选育及其发酵特性研究[D].芜湖:安徽工程大学,2013
[8] 冯志彬,程仕伟,缪静,等.γ-聚谷氨酸生产菌的选育及培养条件研究[J].生物加工过程,2010,8(1):40-44
[9] XU Hong,JIANG Min,LI Hui,et al.Efficient production of poly(γglutamic acid)by newly isolated Bacillus subtilis NX-2[J].Process Biochemistry,2005,40(2):519-523
[10]GOTO A,KUNIOKA M.Biosynthesis and hydrolysis of poly(gamma-glutamic acid)from Bacillus subtilis IF03335[J].Bioscience,Biotechnology,and Biochemistry,1992,56(7):1031-1035
[11]刘洁,王建磊,刘燕妮,等.聚谷氨酸液态发酵条件优化[J].安徽农业科学,2014,42(32):11231-11235
[12]ITO Y,TANAKA T,OHMACHI T,et al.Glutamic acid independent production of poly(γ-glutamic acid)by Bacillus subtilis TAM-4[J].Bioscience,Biotechnology,and Biochemistry,1996,60(8):1239-1242
[13]JUNG D Y,JUNG S,YUN J S,et al.Influences of cultural medium componentontheproductionof poly(gamma-glutamic acid)by Bacillus sp RKY3[J].Biotechnology and Bioprocess Engineering,2005,10(4):289-295
[14]冯志彬,李昆,石秀峰,等.混菌发酵生产γ-聚谷氨酸的工艺条件优化[J].生物加工过程,2012,10(5):23-27
[15]SILVA S B,CANTARELLI V V,AYUB M A.Production and optimization of poly-gamma-glutamic acid by Bacillus subtilis BL53 isolated from the Amazonian environment[J].Bioprocess and Biosystems Engineering,2014,37(3):469-479
[16]WEI Xue-tuan,TIAN Guang-ming,JI Zhi-xia,et al.A new strategy for enhancement of poly-γ-glutamic acid production by multiple physicochemical stresses in Bacillus licheniformis[J].Journal of Chemical Technology&Biotechnology,2015,90(4):709-713
[17]李宏杰,方军,蒋彩霞,等.γ-聚谷氨酸发酵工艺研究[J].食品研究与开发,2015,36(14):79-82
[18]张智维,刘婷,张海群.响应面法优化γ-聚谷氨酸发酵条件[J].中国调味品,2015,40(7):56-60
[19]刘常金,郑焕兰,姜川,等.纳豆芽孢杆菌液体发酵生产γ-聚谷氨酸[J].现代食品科技,2009,25(8):935-939
[20]JU W T,SONG Y S,JUNG W J,et al.Enhanced production of polygamma-glutamic acid by a newly-isolated Bacillus subtilis[J].Biotechnology Letters,2014,36(11):2319-2324
Optimization of Fermentation Conditions of Poly-γ-glutamic Acid Production by Bacillus subtilis
WU Guo-hui1,2,ZHANG Lei1,2,GAO De-cai1,2,LI Peng-cheng3,ZHANG Ying3,SHI Yuan-liang1,3,*
(1.Institute of Applied Ecology,Chinese Academy of Sciences,Shenyang 110016,Liaoning,China;2.University of Chinese Academy of Sciences,Beijing 100049,China;3.Liaoning Zhongke Biological Engineering CO.,LTD.,Benxi 117004,Liaoning,China)
To improve the production and reduce the cost of γ-PGA,a fermentation study with Bacillus subtilis was conducted to explore the effects of medium compositions and culture conditions on γ-PGA production based on single-factor experiment and orthogonal design.The results showed that the optimized cultivation conditions and medium composition were as follows:sucrose 5%;sodium glutamate 6%;NH4Cl 0.3%;K2HPO42%;KH2PO40.1%;MnSO40.003%;initial pH 7.0;inoculum amount 3%;temperature 33℃;fermentation time 48 h.In this study,high γ-PGA productivity(20.8 g/L)was obtained under the optimal conditions,31.65%higher than the previous conditions(15.8 g/L).
poly-γ-glutamic acid;liquid fermentation;biosynthesis;medium;orthogonal design
2016-08-26
10.3969/j.issn.1005-6521.2017.11.037
“十二五”国家科技支撑项目“滨海盐碱地作物稳定性肥料研制与施用技术研究”(2013BAD05B04)
武国慧(1990—),女(汉),硕士研究生,研究方向:微生物工程。
*通信作者:石元亮,研究员,博士,研究方向:土壤微域生态系统及其调控研究。
