低温沼气发酵细菌定向筛选及产气效能研究
2017-07-18冀丽爽邓建民
赵 光,郭 星,冀丽爽,邓建民,马 放
(1.辽宁工业大学 化学与环境工程学院,辽宁 锦州121001;2.黑龙江省海林农场,黑龙江 海林157126;3.哈尔滨工业大学 市政环境工程学院,黑龙江 哈尔滨15009)
低温沼气发酵细菌定向筛选及产气效能研究
赵 光1,3,郭 星1,冀丽爽1,邓建民2,马 放3
(1.辽宁工业大学 化学与环境工程学院,辽宁 锦州121001;2.黑龙江省海林农场,黑龙江 海林157126;3.哈尔滨工业大学 市政环境工程学院,黑龙江 哈尔滨15009)
为实现低温生物甲烷高效转化与发酵系统稳定运行,应探索提高低温沼气发酵细菌代谢能力途径与冷适机制。研究以发酵温度(10、15、18、22、25°C和30°C)为驱动因子,人工培养基定向富集自然低温生境混合菌群,考察沼气发酵细菌低温生物甲烷转化效能,并耦合454高通量测序和PCR-DGGE解析低温混合菌群落结构。结果表明,低温生境混合细菌最优势细菌类群为ClostridiumXI sp.,占细菌总数的40.9%,确定分类地位的产甲烷菌有Methanosaetasp.和Methanobacteriumsp.。低温沼气发酵细菌在18°C富集培养的沼气产量最高,可达220 ml L-1reactord-1,甲烷含量为56.8%。
低温;沼气发酵;嗜冷产甲烷菌;454焦磷酸测序技术
有机废弃物厌氧发酵产沼气技术的开发与应用早已得到世界各国的高度重视,并取得了良好的收益[1-2]。但是,在高纬度地区,由于冬季低温的制约,目前尚未作为清洁能源的载体得到广泛应用。探寻低温沼气发酵抑制机理,促进微生物代谢活性,开发新工艺及沼气发酵菌群生态调控技术,将是实现寒区沼气能源产业化的关键。
低温对沼气发酵抑制的本质是沼气发酵微代谢活性的降低[3-4]。目前,有关低温沼气发酵的理论研究主要集中四个方面,低温产甲烷菌的筛选、沼气发酵微生物的分子生物学筛选、厌氧发酵工艺生态因子的优化以及沼气发酵促进剂的开发等[5-8]。由于沼气发酵是一个十分复杂的厌氧菌代谢过程,且研究表明低温产甲烷是厌氧菌的遗传生理代谢功能,并不是某种功能逃避机制[9-10]。仅依靠调控产甲烷菌的代谢活性并不能高效驱动低温条件下有机物的甲烷转化效率。因此,从根本上解决低温生物甲烷高效制备,提高沼气发酵细菌的群体协同代谢能力是关键,找到低温协同高效产甲烷的厌氧菌群落结构,或一些对低温抗性较强的微生物类群,通过分离、生物强化等技术手段定向培养,进而有效提高低温甲烷转化效率。
本研究采集自然生境低温厌氧混合细菌,以温度为驱动因子,定向富集培养,考察低温条件下的生物甲烷转化效能,分析低温沼气发酵微生物特性。以期为实现低温高效产甲烷的微生物代谢调控与厌氧发酵系统稳定运行提供科学参考。
1 实验
1.1 自然生境低温混合细菌采集
低温活性污泥采自位于黑龙江齐齐哈尔的克钦湖沼泽湿地(47°10′N,124°12′E),采集2 m深处活污泥,环境温度为8℃。污泥转移至冰盒厌氧袋内,表面覆盖90%湿地原生态湖水,迅速带回实验室4℃低温保存。
1.2 培养基定向富集培养
本试验以250 mL厌氧瓶为发酵反应器,活性污泥接种量为30%,配置150 mL甲烷菌富集培养基[11],在15±0.1℃的低温培养箱进行定向富集,经多次传代富集培养,直至筛选出沼气产量稳定的产甲烷混合菌群。进一步考察不同发酵温度对定向筛选的复合产甲烷混合菌群产沼气效能与甲烷含量。
1.3 试验方法
总固体含量(TS%)、可挥发性物质(VS%)等按标准方法进行测试[12]。pH采用上海雷磁pH-3C测定,沼气产量采用排水法,甲烷含量测定应用Agilent 6890气象色谱完成。
低温活性污泥细菌基因组总DNA先经液氮研磨法前处理,再应用细菌提取试剂盒(上海生工)进行提取。采用美国ABI9700PCR仪扩增细菌16S rRNA基因V3高变区,测序采用454 GX-FLX(罗氏公司)高通量测序技术对细菌生物多样性评价及微生物群落组成分析[13-14]。产甲烷古菌V2-V3区扩增使用通用引物对A109(T)-F和515GC-R进行PCR扩增,应用DGGE 30-50%的梯度胶进行分离,所得序列结果通过Genbank数据库的BLASTX功能进行分析比对[15-16]。
2 结果与讨论
2.1 低温活性污泥细菌生物多样性评价
提取活性污泥细菌基因组总DNA,PCR扩增产物采用454 GX-FLX高通量测序技术进行生物多样性评价和微生物群落组成分析,产甲烷古菌分析采用PCR-DGGE技术,凝胶切割回收后测序。
低温混合细菌通过序列质量筛选,共获得高质量细菌序列1015条,稀释曲线如图1所示,随样本测序量增加,序列不同相似水平上逐渐出现平缓趋势,但仍未达饱和状态。如表1所示,当序列相似度为95%和97%时,样品产生406个和452个OTU,覆盖率分别为64.1%和68.7%,说明低温细菌至少存在406个细菌属,细菌群落多样性比较丰富。丰富度指数Chao1和ACE是反映物种群落丰欠状况的指标,计算结果表明,在序列相似度为95%的属分类水平,Chao1和ACE分别为1 698和4 116。因此,测序数量未达到饱和,低温活性污泥微生物多样性较高,继续扩大测序通量仍可发现新的微生物类群。

图1 低温混合细菌稀释曲线

表1 低温混合细菌在不同分类水平多样性及丰富度指数统计
2.2 低温沼气发酵混合菌群落结构分析
如图2所示,低温产甲烷混合细菌多样性丰富,在门分类水平上属于11个类群,主要包括:酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)、放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、Synergistetes门、螺旋体门(Spirochaetes)、疣微菌门(Verrucomicrobia)、拟杆菌门(Bacteroidetes)、TM7门和厚壁菌门(Firmicutes)。优势类群为主要优势地位的微生物种群为Firmicutes、Bacteroidetes和Actinobacteria,相对丰度分别占细菌群落总数的68.47%、8.28%和7.88%。

图2 低温混合菌群在门分类水平的微生物组成
在属分类水平,优势类群如表2所示(相对丰度>1.0%),梭菌属(ClostridiumXI sp.)为最优势类群占序列总数的40.99%,低温混合细菌还包括一些相对丰度大于1%的微生物类群,如Turicibactersp.(4.14%)、Anaerobactersp.(3.55%)、Nakamurellasp.(3.05%)和Meniscussp.(1.48%)等。此外,还发现其他一些低丰度细菌类群存在,主要有Lutaonellasp.、Proteiniphilumsp.和Cellulosilyticumsp.等。产甲烷微生物的低温产甲烷能力是其自身长期进化具备的遗传生理代谢功能。由于低温活性污泥取自克钦生态浅层湖底,常年处于低温厌氧环境,周期性生长芦苇等植物,已形成相对稳定的微生物群落结构,因此具有一定的低温厌氧代谢能力。本研究结果与深海活性污泥的细菌多样性具有显著差异,如Feng等对东海的长江口活性污泥微生物群落组成研究发现,变形菌门(Proteobacteria)为最优势菌群占微生物序列总数的72.9%,其次为厚壁菌门(Firmicutes,6.4%)和拟杆菌门(Bacteroidetes,4.6%),这种差异主要是低温微生物常年的高压环境与极度厌氧造成,形成其特殊的物质能量代谢方式[17]。
为考察低温活性污泥存在的优势产甲烷古菌类型,对产甲烷古菌16S rRNAV2-V3区PCR扩增,产物进行变性梯度凝胶电泳(DGGE)。DGGE图谱如图3所示,图谱显示14个优势条带,对优势条带切割并进行DNA胶回收,基因克隆测序。由凝胶条带亮度代表的相对丰度可知,Band 1、Band 4、Band 8、Band 10和Band 11为优势微生物类群,系统进化分析表明,低温产甲烷古菌可确定分类地位的只有Band1和Band8为Methanobacteriumsp.MB4(DQ677518)和Uncultured Methanomicrobiaceae archaeon(GU257173),未发现乙酸营养型产甲烷古菌,其他均为不能确定营养代谢类型的产甲烷古菌(表2)。

表2 低温混合细菌在属分类水平的微生物组成

图3 低温产甲烷古菌PCR-DGGE图谱
2.3 不同发酵温度对低温沼气发酵混合菌群产气能力影响
应用人工产甲烷菌富集培养基,15℃定向富集低温混合产甲烷活性污泥,以获得稳定沼气产量为传代起始标准,多次转代直至得到最佳沼气产量的混合微生物类群。进一步考察选育的复合低温产甲烷菌在不同温度条件下的沼气发酵能力。如图4所示,经8个周期富集培养,低温产甲烷菌群的沼气产量逐步稳定,周期累计最高沼气产量为180 mL,相比启动初期提高133.8%,甲烷含量为57.2%。如图5所示,不同发酵温度对筛选的稳定低温产甲烷混合菌群产沼气能力影响,中温30℃发酵对低温混合菌群产甲烷具有抑制作用,低温混合产甲烷菌的最大沼气产量出现在18℃发酵,当反应器启动15 d时,沼气产量达到峰值39 mL/d,最大有效容积沼气产率约为0.22 m3m3reactord-1,测定甲烷含量为56.8%。
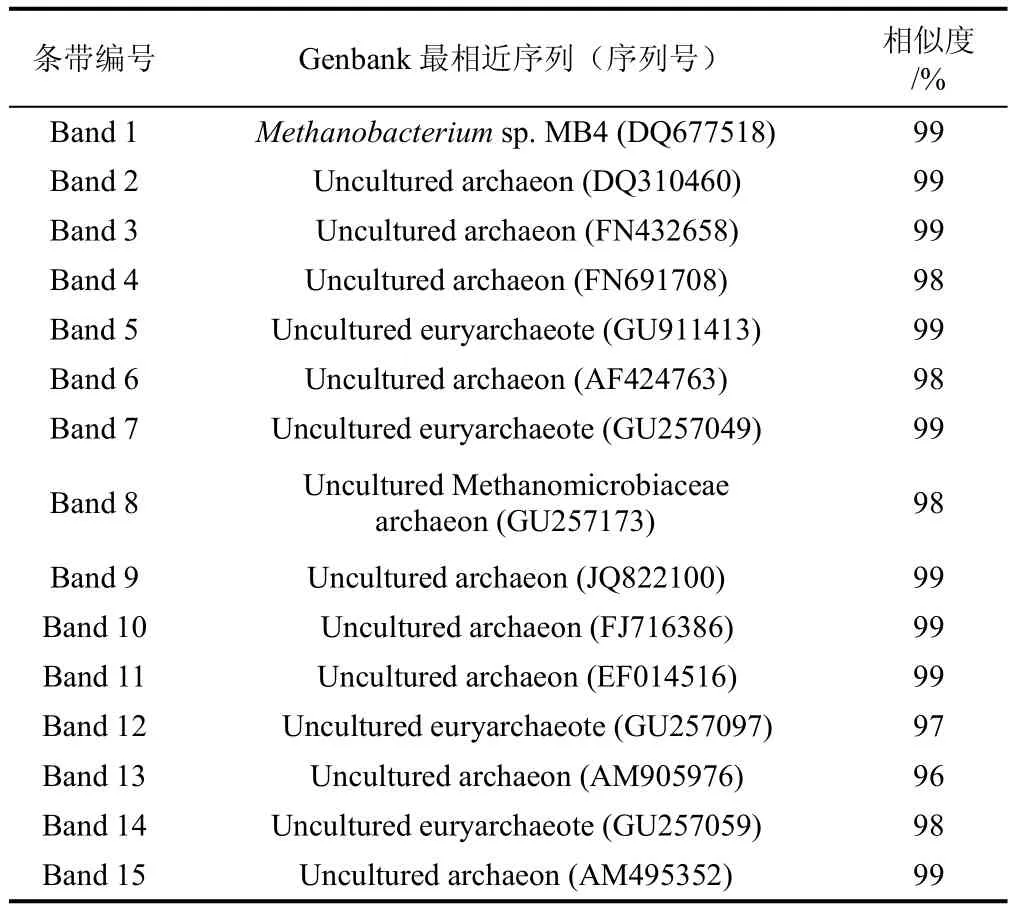
表3 甲烷菌16S rRNAV2-V3区优势微生物最相似序列

图4 低温混合菌群定向富集培养沼气产量与甲烷浓度

图5 低温混合菌群不同发酵温度下的沼气产量
3 结论
(1)本研究在自然低温生境筛选低温产甲烷混合菌群,利用454焦磷酸高通量测序技术分析低温产甲烷混合菌群多样性,在细菌属分类水平共得到406个OTU,覆盖率为64.1%。
(2)聚类分析表明,Firmicutes属最优势微生物类群,占细菌群落总数的68.47%,在属分类水平,ClostridiumXI sp.为最优势微生物类群(40.99%),可确定分类地位的产甲烷菌为Methanobacteriumsp.和Uncultured Methanomicrobiaceae archaeon。
(3)利用人工培养基定向富集驯化,筛选的稳定低温混合产甲烷菌系在18°C时沼气产量最大为0.22 m3m3reactord-1,甲烷含量为56.8%。
[1]Karthikeyan O P,Visvanathan C.Bio-energy recovery from high-solidorganicsubstratesbydryanaerobic bio-conversion processes:a review[J].Rev Environ Sci Bio, 2013,12(3):257-284.
[2]赵光,马放,魏利.北方低温沼气发酵技术研究及展望[J].哈尔滨工业大学学报,2011,43(6):29-33.
[3]Schlüter A,Bekel T,Diaz N N,et al.The metagenome of a biogas-producingmicrobialcommunityofa production-scale biogas plant fermenter analysed by the 454-pyrosequencing technology[J].J Biotechnol,2008, 136(1):77-90.
[4]成晓杰,仇天雷,王敏,等.低温沼气发酵微生物区系的筛选及其宏基因组文库构建[J].中国生物工程杂志, 2010,30(11):55-55.
[5]Saady N M C,Massé D I.Psychrophilic anaerobic digestion of lignocellulosic biomass:a characterization study[J].Bioresour Technol,2013,142:663-671.
[6]董春娟,刘晓,赵庆良,等.低温EGSB反应器运行机理[J].哈尔滨工业大学学报,2008,40(10):1558-1562.
[7]朱文秀,黄振兴,任洪艳,等.IC反应器处理啤酒废水的效能及其微生物群落动态分析[J].环境科学,2012, 33(8):2715-2722.
[8]程辉彩,习彦花,郭建斌,等.产乙酸复合菌系Th3培养及其在沼气厌氧发酵中的应用[J].农业工程学报,2012,28(17):210-216.
[9]Ndegwa P M,Hamilton D W,Lalman J A,et al.Effects of cycle frequency and temperature on the performance of anaerobic sequencing batch reactors(ASBRs)treating swinewaste[J].BioresourTechnol,2008,99(6): 1972-1980.
[10]Lee S H,Kang H J,Lee Y H,et al.Monitoring bacterial community structure and variability in time scale in full-scale anaerobic digesters[J].J Environ Monito,2012,14(7):1893-1905.
[11]Jones W J,Paynter M J B,Gupta R.Characterization of Methanococcus maripaludis sp.nov.,a new methanogen isolated from salt marsh sediment[J].Arch.Microbiol.1983,135:91-97.
[12]Clesceri L S,Greeberg A E,Eaton A D.Standard Methods for The Examination of Water and Waste Water,20th ed[M].American Public Health Association(APHA).Washington,DC,USA,2000.
[15]Cole J R,WAang Q,Cardenas E,et al.The ribosomal database project:improved alignments and new tools for rRNA analysis[J].Nucleic Acids Research,2009,37(1): D141-D145.
[16]Schloss P D,Westcott S L,Ryabin T,et al.Introducing mothur:open-source,platform-independent, community-supportedsoftwarefordescribingand comparingmicrobialcommunities[J].Appliedand Environment Microbiology,2009,75(23):7537-7541.
[17]Larkin M A,Blackshields G,Brown N P,et al.Clustal W and Clustal X version 2.0[J].Bioinformatics,2007,23(21): 2947-2948.
[18]Koichiro T,Joel D,Masatoshi N,et al.MEGA4: MolecularEvolutionaryGeneticsAnalysis(MEGA) Software Version 4.0[J].Molecular Biology Evolution, 2007,24(8):1596-1599.
[19]Feng B W,Li X R,Wang J H,et al.Bacterial diversityofwaterand sediment in the Changjiang estuary and coastal area of the EastChina Sea[J].FEMS Microbiology Ecology,2009,70(2):236-248.
责任编校:刘亚兵
Research on Oriented Enrichment of Psychrophilic Biogas-producing Bacteria and Methane Production
ZHAO Guang1,GUO Xing1,JI Li-shuang1,DENG Jian-min2,MAFang3
(1.Chemical and Environmental Engineering college,Liaoning University of Technology,Jinzhou121001,China;2.Hailin Farm,Hailin 150000,China; 3.School of Municipal Environmental Engineering,Harbin Institute of Technology,Harbin 150090,China)
Improving the metabolic activity of psychrophilic biogas-producing bacteria is crucial to realize efficient biomethane conversion and stable operation of anaerobic digester under low temperature.The study adopts fermentation temperature(10、15、18、22、25°C and 30°C)as limited factor to investigate biogas conversion of psychrophilic bacteria cultivated from natural habitat using oriented enrichment of artificial medium.Furthermore,454 pyrosequencing technology and PCR-DGGE were employed to analyze microbial community diversity.The results show that the dominant psychrophilic bacteria isClostridiumXI sp.and accounts for 40.9%.TheMethanosaetasp.andMethanobacteriumsp.were detected from psychrophilic bacteria.The optimum biogas production was 220 ml L-3reactord-1and 56.8%of methane content operated under 18°C.
lowtemperature;biogas;psychrophilicmethanogen;454pyrosequencing technology
X705
A
1674-3261(2017)01-0048-04
2015-11-05
国家科技支撑计划专题项目(2012BAD14B06-04);辽宁省教育厅项目(L2014236);辽宁工业大学教师科研启动基金(X201310)
赵光(1980-),男,辽宁开原人,副教授,博士。
10.15916/j.issn1674-3261.2017.01.013
