臭氧氧化降解水中磺胺嘧啶的机理研究
2017-07-18王培良钱锋宋永会苟玺莹
王培良,钱锋,宋永会*,苟玺莹
1.中国环境科学研究院城市水环境科技创新基地,北京 100012 2.中国地质大学(北京)水资源与环境学院,北京 100083
臭氧氧化降解水中磺胺嘧啶的机理研究
王培良1,2,钱锋1,宋永会1*,苟玺莹1
1.中国环境科学研究院城市水环境科技创新基地,北京 100012 2.中国地质大学(北京)水资源与环境学院,北京 100083
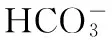
磺胺嘧啶;臭氧氧化;动力学;降解产物
磺胺嘧啶(sulfadiazine,SD)为白色或类白色的结晶或粉末,无臭、无味,遇光色渐变暗,分子式为C10H10N4O2S,分子量为250.28,结构如图1所示。SD几乎不溶于水,在氢氧化钠和氨溶液中易溶,在稀盐酸中溶解[1]。SD是一种应用广泛的抗生素类药物,因其抗菌谱广,性质稳定,价格便宜,其可用于脑膜炎双球菌、肺炎球菌、淋球菌、溶加链球菌感染的治疗。目前我国已成为全球磺胺类抗生素主要生产国和出口国[2]。SD进入土壤、水和沉积物等环境介质,经吸附解吸、迁移和降解等过程重新分配,其主要降解方式有水解、光解和生物降解,但自然环境对其降解作用不明显[3],SD长期残留于环境中,对人类健康及生态环境造成危害[4-5]。因此,研究此类化合物的去除方法与机理具有较大的实际意义和应用价值。
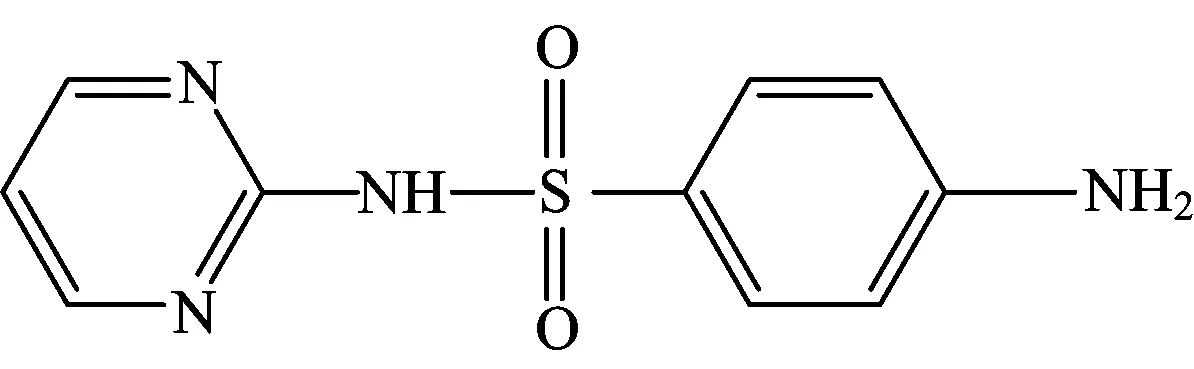
图1 磺胺嘧啶分子结构Fig.1 Chemical structure of sulfadiazine
SD因其性质稳定,在环境中降解十分缓慢,传统的生物处理工艺对其去除能力也十分有限[6-7]。因此,近几年,以羟基自由基(·OH)的形成和参与氧化为特征的高级氧化技术(AOPs),对多种难降解污染物具有高效的去除能力,备受国内外学者的关注[8]。主要的高级氧化技术包括Fenton[9]、O3H2O2、O3UV[10-11]、H2O2UV、TiO2UV[12]等体系[13]。臭氧氧化有机物的机理有2种[14-16]:1)直接反应,即臭氧以分子的形式直接与水中有机物反应;2)间接反应,即在水中的自由基激发剂或促进剂的作用下,臭氧分解形成氧化性更强的·OH[17],与抗生素分子中活泼结构单元发生反应,最终抗生素分子结构被氧化破裂,分解转化为小分子物质[18],再经过生化等方法被彻底去除。而臭氧去除污染物机理主要取决于pH,酸性条件下臭氧氧化以直接氧化为主,碱性条件下以·OH氧化为主[19]。
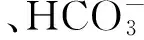
1 材料与方法
1.1 试剂与设备
试验材料:磺胺嘧啶(上海梯希爱化成工业发展有限公司),色谱级乙腈(韩国DUKSAN),色谱级甲酸(美国MREDA),针式滤器(尼龙)(上海安谱试验科技股份有限公司),磷酸缓冲液,试验用水均为超纯水,其他试剂均为分析纯。
试验仪器:高效液相色谱仪(HPLC,Agilent Technologies),液相色谱-质谱仪(LC-MS,戴安UltiMate3000UHPLC串联AB SCIEX API3200),臭氧发生器(北京山美水美环保高科技有限公司),在线式紫外臭氧检测仪(深圳市鑫海瑞科技开发有限公司),TOC检测仪(中国岛津企业有限公司),HANNA HI8424便携式pH计(意大利哈纳HANNA仪器)。
1.2 试验方法
臭氧氧化试验在1 L密封圆柱形玻璃仪器中进行。臭氧由臭氧发生器产生,通过调节玻璃转子流量计控制进入反应器中的臭氧流量,水溶液中臭氧浓度通过在线式紫外臭氧检测仪检测。试验中产生的臭氧尾气由臭氧毁灭器收集毁灭。
臭氧降解SD试验:以超纯水配制浓度分别为7,15,23和30 mg/L的SD溶液,调节臭氧浓度分别为5.0,7.5,10.0和15.0 mg/L,调节pH分别为5.23,6.95,9.14,11.02,添加NaHCO3溶液(0~200 mg/L),在反应时间120 min内取样,过0.22 μm滤膜后用HPLC分析SD浓度,同时利用TOC检测仪测定样品中TOC浓度。
臭氧氧化降解SD产物分析试验:以超纯水配制浓度为30 mg/L的SD溶液,调节臭氧浓度为10 mg/L,pH为9.10,在30 min内,不同时间点取样,样品通过针式0.22 μm滤膜过滤后,仪器直接进样,采用LC-MS分析SD降解中间产物。
1.3 分析方法
采用HPLC测定溶液中SD浓度。HPLC条件:流动相为超纯水与乙腈,比例为75%∶25%;流量1 L/min;抽取/排出速度200 μL/min;进样量10.00 μL/min;温度30 ℃;检测波长269 nm。色谱柱为Waters XBridge C18(3.0 mm×150 mm,3.5 μm)。采用LC-MS分析降解中间产物,质谱条件:流动相为水(含0.1%甲酸)和乙腈;进样量10 μL;正离子模式;喷雾电压4 000 V;扫描范围100~500 nm;气帘气0.138 MPa(20 psi);雾化气0.276 MPa(40 psi);雾化温度500 ℃;辅助气0.414 MPa(60 psi);色谱柱温度30 ℃。
用稀HCl和NaOH调节溶液pH,采用便携式pH计测定溶液pH,添加NaHCO3溶液时,利用磷酸盐缓冲液调节溶液pH为7.0,TOC浓度采用TOC检测仪测定。
2 结果与讨论
2.1 臭氧降解SD的影响因素
2.1.1 溶液初始pH
利用NaOH和HCl调节初始pH为5.23、6.95、9.14和11.02,SD降解效果如图2所示。由图2可以看出,当反应进行到30 min时,对应pH下的SD降解率分别为99.41%、99.47%、99.13%和99.60%,溶液中SD均几乎降解完全,臭氧对SD有很好的处理效果。当初始pH由6.95提高到9.14时,去除效果明显提高,在5 min时,降解率由30.59%提升到54.44%,15 min后,SD降解率已经达到95.35%。由于pH升高,受溶液中OH-的诱导作用,臭氧自身分解产生·OH的速率大大加快,促进臭氧在水中的吸收,导致溶液中·OH的浓度明显提高,自由基主导的反应过程有效提高了SD的降解速率。但当初始pH由9.14提高到11.02时,降解率和降解速率虽有增加,但不明显,溶液中pH过高时,·OH之间会发生速度极快的猝灭反应,这类反应的速率常数级数达109〔mol/(L·s)〕-1,使得有机污染物的降解速率下降[21]。而且考虑到提高pH会增加NaOH的用量,因此,选择初始pH为9.14。
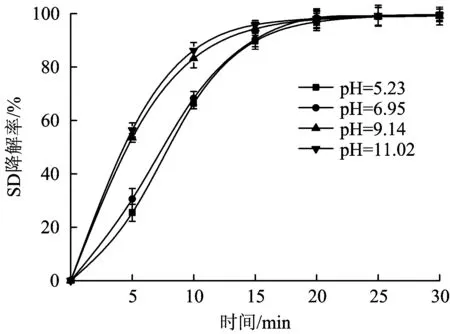
图2 初始pH对臭氧降解SD的影响Fig.2 Effect of pH on degradation of SD by ozone
2.1.2 臭氧浓度
调节溶液初始pH为9.10左右,当臭氧浓度分别为5.0、7.5、10.0和15.0 mg/L时,SD降解效果如图3所示。由图3可见,臭氧浓度从5.0 mg/L提高到7.5 mg/L时,体系中SD浓度增加,当反应进行10 min时,SD降解率从26.24%提高至57.70%,降解率提高了1倍,同时大大缩短了的SD降解时间。原因是随着体系中臭氧浓度的提高,增加了臭氧接触SD的概率,同时氧化性更强的·OH浓度增加[22-23]。当臭氧浓度由10.0 mg/L提高至15.0 mg/L时,反应进行15 min,SD的降解率分别为94.77%和97.30%,仅提升2.53个百分点。从经济性考虑,继续提高臭氧浓度,臭氧发生器中臭氧转化率会降低,且电力消耗过多[24],因此,从处理效率和能耗的角度综合考虑,选择臭氧浓度为10.0 mg/L。
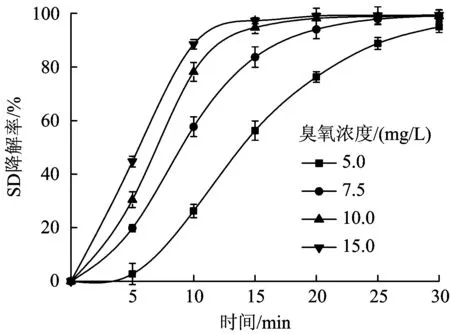
图3 臭氧浓度对降解SD的影响Fig.3 Effects of ozone concentration on degradation of SD
2.1.3 SD初始浓度
前期在一些制药厂出水检测出一定浓度的SD。为了更好地探讨臭氧对该物质的去除机理,设定SD初始浓度分别为7、15、23及30 mg/L,反应时间30 min,臭氧浓度为10.0 mg/L时,SD的降解效果如图4所示。由图4可见,SD降解率分别为100%、100%、99.49%和99.48%,在30 min内,不同初始浓度的SD基本都可以被降解完全。但当初始浓度为23 mg/L时,前15 min内,降解速率明显高于其他浓度。原因可能是随着SD浓度增加,加速臭氧发生间接氧化反应,产生更多的·OH,加速了反应速度。继续提高SD浓度,反应速度降低,可能是SD的量大幅度超过了单位·OH能氧化的量[25],导致降解率有了较大降低。
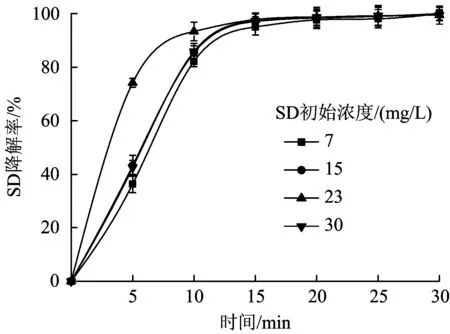
图4 SD初始浓度对臭氧降解SD的影响Fig.4 Effect of SD initial concentration on degradation of SD by ozone
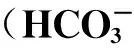
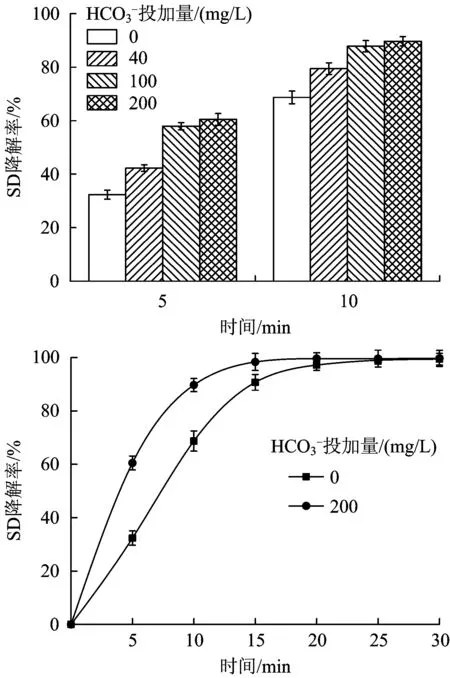
图投加量对臭氧降解SD的影响Fig.5 Effects of HC on degradation of SD by ozone
2.2 臭氧氧化SD过程中TOC浓度的变化
SD的矿化程度可通过TOC浓度来表征。图6为臭氧氧化降解SD过程中TOC浓度的变化。由图6可以看出,在120 min内,TOC浓度从20.31 mg/L降至12.30 mg/L,矿化率为39.44%。随着反应时间的增长,SD浓度明显降低,但TOC浓度降低并不明显,说明臭氧将磺胺嘧啶降解成大分子物质,反应不彻底,矿化程度一般。原因可能是,磺胺嘧啶中某部分结构稳定,不易被矿化[29]。
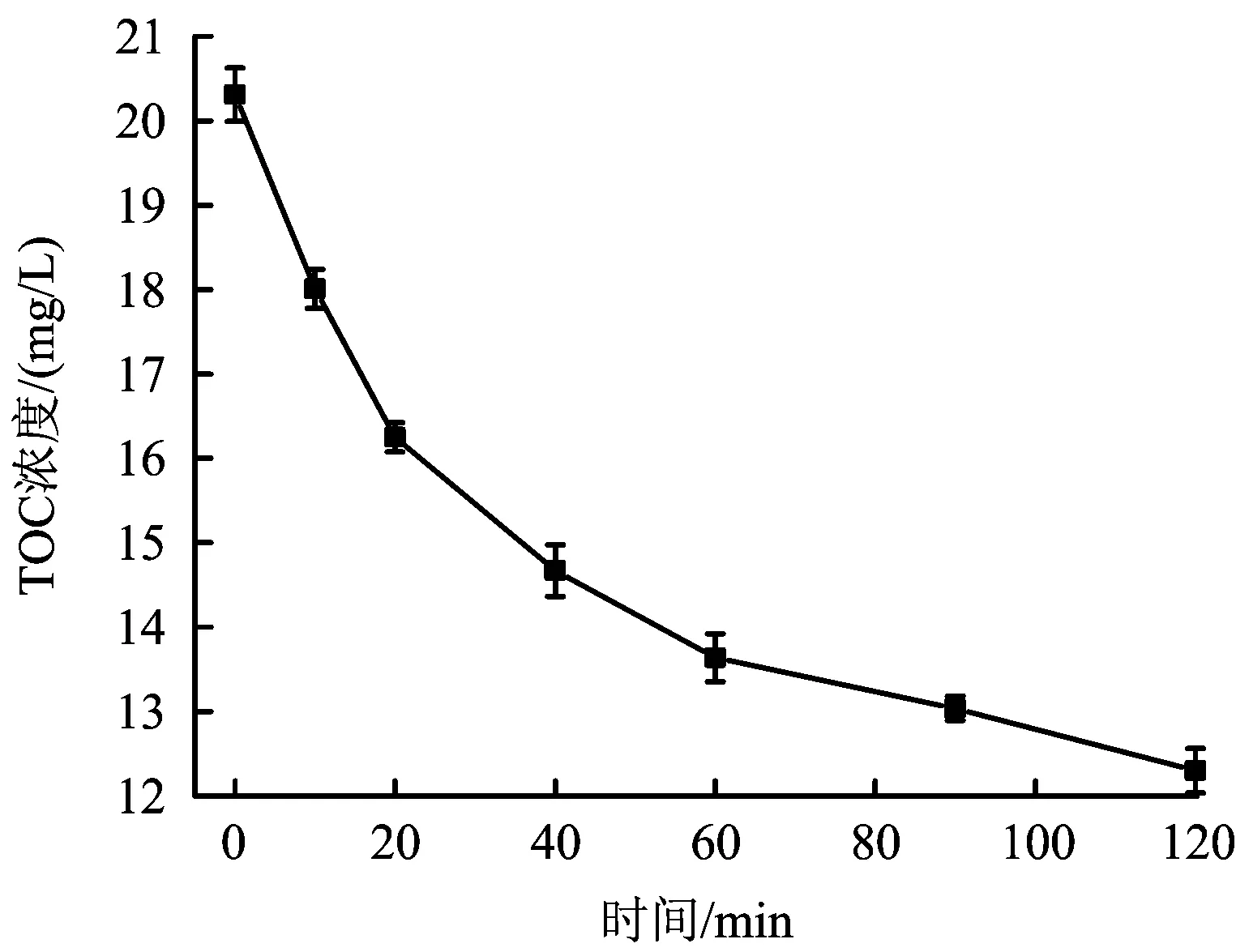
图6 臭氧降解SD过程中TOC浓度的变化Fig.6 The change of TOC in SD degradation process by ozone
2.3 臭氧氧化降解SD的动力学研究
设定臭氧浓度为10 mg/L,反应时间为30 min,对臭氧降解SD动力学进行分析,采用伪一级动力学方程拟合,结果如表1所示。
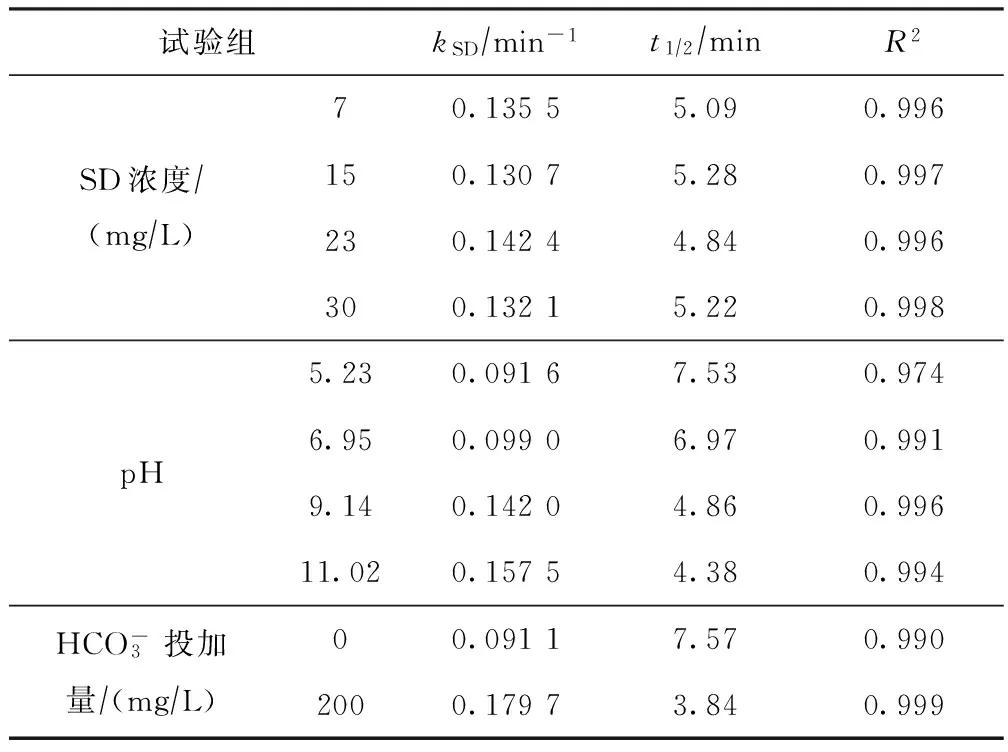
表1 臭氧降解SD的伪一级动力学模型参数
注:t12为半衰期,即SD浓度降为初始浓度12时的时间。
由表1可以看出,伪一级反应动力学可以较好地模拟臭氧氧化SD的过程。提高SD初始浓度,kSD基本保持不变,t12也无太大变化。由此可见,当臭氧浓度过量且基本维持不变的情况下,臭氧对SD的降解速率基本不受SD初始浓度的影响。提高反应pH,kSD随之升高,反应速率加快,t12随之降低,从pH为5.23时的7.53 min降至pH为11.02时的4.38 min,说明提高溶液pH加快了臭氧对SD的降解进程;添加后,kSD随之升高,加快了反应进程,t12也随之降低,与未添加相比,t12减少了近1倍,说明添加阴离子后对臭氧降解SD也有很大促进作用。这与2.1节的试验结论相吻合。
2.4 臭氧氧化SD途径探讨
SD是一种含氮六元环,随着臭氧氧化反应的进行,生成物质的种类和浓度都会有所变化。采用LC-MS对SD降解产物进行分析,并初步分析可能的降解途径和中间产物。降解过程中生成一种较为明显的质荷比为173.1的物质,根据文献[30]关于SD降解中间产物分析,可能为对氨基苯磺酸(C6H7NO3S)。C6H7NO3S在臭氧及水溶液中进一步发生氧化及取代反应,最终矿化,生成CO2[31]。降解途径如图7所示。
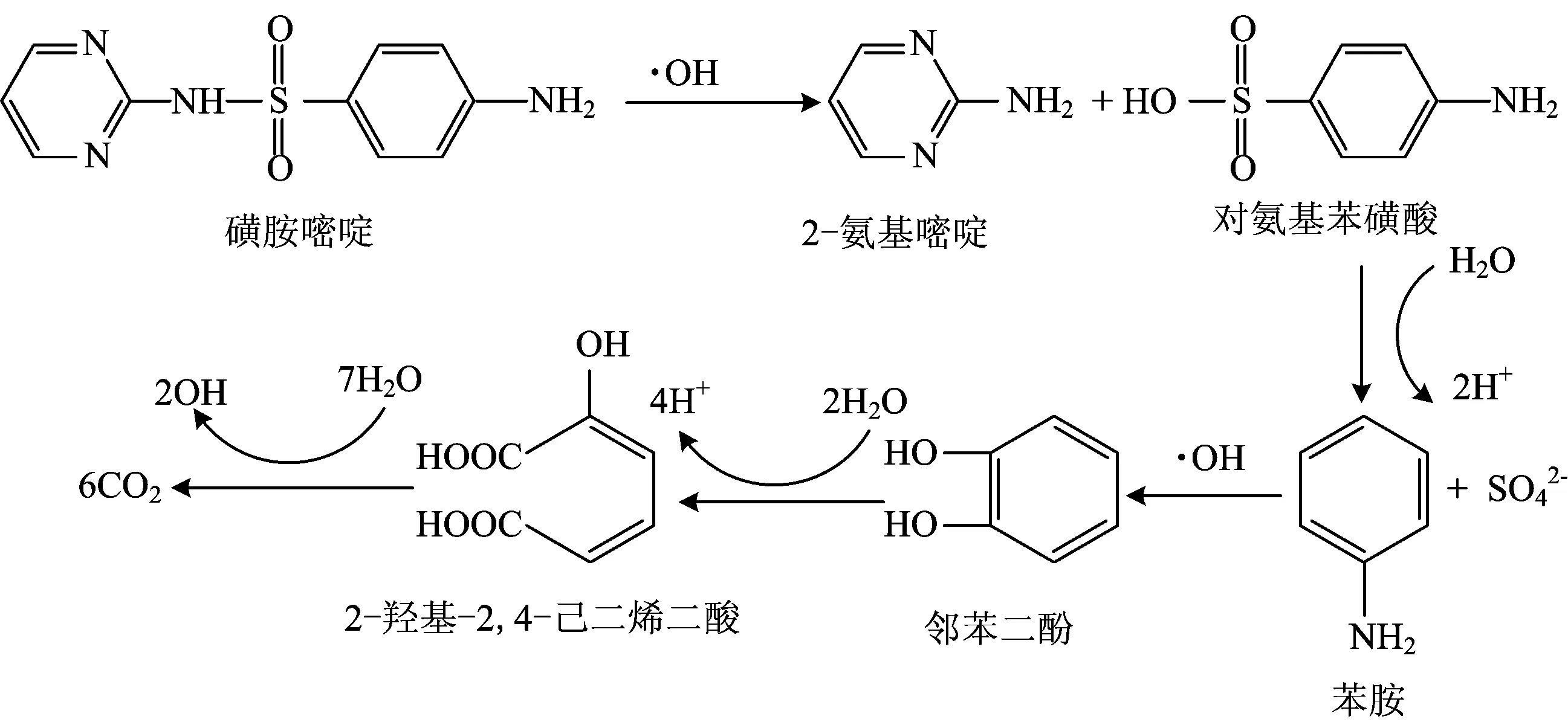
图7 SD降解途径分析Fig.7 SD degradation pathway
3 结论
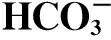
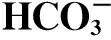

[1] 孙丰霞.污水处理系统中磺胺嘧啶和磺胺甲唑的优化处理研究[D].泰安:山东农业大学,2014.
[2] 周宁娟,薛罡,卜聃,等.羟基化锌催化臭氧氧化去除水中痕量磺胺嘧啶[J].中国环境科学,2011,31(2):233-238. ZHOU N J,XUE G,BU D,et al.Catalytic ozonation of trace sulfadiazine in water by ZnOOH[J].China Environmental Science,2011,31(2):233-238.
[3] 张佳.电催化氧化降解磺胺嘧啶模拟废水的研究[D].南京:南京师范大学,2014.
[4] MATAMOROS V,BAYONA J M.Elimination of pharmaceuticals and personal care products in subsurface flow constructed wetlands[J].Environmental Science and Technology,2006,40(18):5811-5816.
[5] 崔晓宇,何绪文,曾萍,等.UASB-MBR组合工艺处理黄连素废水的中试[J].环境科学研究,2015,28(8):1295-1301. CUI X Y,HE X W,ZENG P,et al.A pilot-scale hybrid upflow anaerobic sludge blanket reactor (UASB)-membrane bioreactor (MBR) system for berberine wastewater treatment[J].Research of Environmental Sciences,2015,28(8):1295-1301.
[6] BUSER H R,BALMER M E,SCHMID P,et al.Occurrence of UV filters 4-methylbenzylidene camphor and octocrylene in fish from various Swiss rivers with inputs from wastewater treatment plants[J].Environmental Science and Technology,2006,40(5):1427-1431.
[7] ADAMS C,ASCE M,WANG Y,et al.Removal of antibiotics from surface and distilled water in conventional water treatment processes[J].Journal of Environmental Engineering,2002,128(3):253-260.
[8] NAKADA N,SHINOHARA H,MURATA A,et al.Removal of selected pharmaceuticals and personal care products (PPCPs) and endocrine-disrupting chemicals (EDCs) during sand filtration and ozonation at a municipal sewage treatment plant[J].Water Research,2007,41(19):4373-4382.
[9] 曾萍,宋永会,DRESELY J,等.金刚烷胺模拟废水Fenton氧化及其中间产物分析[J].环境工程技术学报,2011,1(6):455-459. ZENG P,SONG Y H,DRESELY J,et al.Oxidative degradation of simulated amantadine by the Fenton processes and the intermediates analysis[J].Journal of Environmental Engineering Technology,2011,1(6):455-459.
[10] JAVIER B F,ACERO J L,REAL F J,et al.Ozonation of pharmaceutical compounds: rate constants and elimination in various water matrices[J].Chemosphere,2009,77(1):53-59.
[11] ANDREOZZI R,CAPRIO V,MAROTTA R,et al.Paracetamol oxidation from aqueous solutions by means of ozonation and H2O2UV system[J].Water Research,2003,37(5):993-1004.
[12] 李魁,林齐,宋永会,等.制药园区难降解尾水强化预处理试验研究[J].环境工程技术学报,2014,4(5):373-377. LI K,LIN Q,SONG Y H,et al.Study on intensive pretreatment of refractory pharmaceutical park tail water[J].Journal of Environmental Engineering Technology,2014,4(5):373-377.
[13] YANG L,YU L,RAY M B.Degradation of paracetamol in aqueous solutions by TiO2photocatalysis[J].Water Research,2008,42(13):3480-3488.
[14] 秦伟伟,肖书虎,宋永会,等.O3UV协同氧化处理黄连素制药废水[J].环境科学研究,2010,23(7):877-881. QIN W W,XIAO S H,SONG Y H,et al.Treatment of berberine pharmaceutical wastewater by O3UV synergetic oxidation[J].Research of Environmental Sciences,2010,23(7):877-881.
[15] 杨岸明,常江,甘一萍,等.臭氧氧化二级出水有机物可生化性研究[J].环境科学,2010,31(2):363-367. YANG A M,CHANG J,GAN Y P,et al.Research on the organic biodegradability of secondary effluent treated by ozonation[J].Environmental Science,2010,31(2):363-367.
[16] 徐新华,赵伟荣.水和废水的臭氧处理[M],北京:化学工业出版社,2003.
[17] 张彭义,祝万鹏.臭氧水处理技术的进展[J].环境科学进展,1995(6):18-24.
[18] HONG P K,ZENG Y.Degradation of pentachlorophenol by ozonation and biodegradability of intermediates[J].Water Research,2002,36(17):4243-4254.
[19] 徐武军,张国臣,郑明霞,等.臭氧氧化技术处理含抗生素废水[J].化学进展,2010(5):1002-1009. XU W J,ZHANG G C,ZHENG M X,et al.Treatment of antibiotic wastewater by ozonation[J].Progress in Chemistry,2010(5):1002-1009.
[20] 邱光磊,宋永会,曾萍,等.UASB-MBR组合工艺处理模拟黄连素废水[J].环境科学研究,2010,23(7):942-947. QIU G L,SONG Y H,ZENG P,et al.Treatment of synthetic berberine wastewater in a hybrid upflow anaerobic sludge blanket reactor (UASB)-membrane bioreactor (MBR) system[J].Research of Environmental Sciences,2010,23(7):942-947.
[21] ANDREOZZI R,CANTERINO M,MAROTTA R,et al.Antibiotic removal from wastewaters: the ozonation of amoxicillin[J].Journal of Hazardous Materials,2005,122(3):243-250.
[22] KU Y,SU A W,SHEN Y S.Decomposition kinetics of ozone in aqueous solution[J].Industrial and Engineering Chemistry Research,1996,35(10):3369-3374.
[23] 张可佳,殷娣娣,高乃云,等.水中两种微囊藻毒素的臭氧氧化及其影响因素[J].中国环境科学,2008,28(10):877-882. ZHANG K J,YIN D D,GAO N Y,et al.Effect and influence of two representative microcystins degradation by ozonation in water[J].China Environmental Science,2008,28(10):877-882.
[24] CATORCENO L L C,NOGUEIRA K R B,TEIXEIRA A C S C.Treatment of aqueous effluents containing phenol by the O3,O3-UV,and O3-H2O2processes: experimental study and neural network modeling[J].Separation Science and Technology,2010,45(11):1521-1528.
[25] 吴南村,尹平河,赵玲,等.水体中微污染磺胺嘧啶药物的氧化降解[J].生态环境,2008(6):2183-2186.
[26] 李明亮.环境中磺胺类药物的降解行为及影响因素的研究[D].新乡:河南师范大学,2012.
[27] GARCIA-ARAYA J F,BELTRAN F J,AGUINACO A.Diclofenac removal from water by ozone and photolytic TiO2catalysed processes[J].Journal of Chemical Technology and Biotechnology,2010,85(6):798-804.
[28] LARSON R A,ZEPP R G.Reactivity of the carbonate radical with aniline derivatives[J].Environmental Toxicology and Chemistry,1988,7(7):265-274.
[29] WESTERHOFF P,YOON Y,SNYDER S,et al.Fate of endocrine-disruptor,pharmaceutical,and personal care product chemicals during simulated drinking water treatment processes[J].Environmental Science and Technology,2005,39(17):6649-6663.
[30] BARAN W,ADAMEK E,SOBCZAK A,et al.The comparison of photocatalytic activity of Fe-salts,TiO2,and TiO2FeCl3during the sulfanilamide degradation process[J].Catalysis Communications,2009,10(6):811-814.
[31] 潘诗卉.磺胺嘧啶在紫外辐射下的降解机理探讨[D].上海:上海师范大学,2014. ▷
Degradation mechanisms of sulfadiazine in aqueous solution by ozonation
WANG Peiliang1,2, QIAN Feng1, SONG Yonghui1, GOU Xiying1
1.Department of Urban Water Environmental Research, Chinese Research Academy of Environmental Sciences, Beijing 100012, China2.School of Water Resources and Environment, Chinese University of Geosciences, Beijing 100083, China
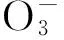
sulfadiazine; ozone oxidation; kinetics; degradation products
2016-12-15
国家水体污染控制与治理科技重大专项(2012ZX07202-005)
王培良(1991—),男,硕士研究生,研究方向为工业废水处理,wplsunboy320@126.com
*责任作者:宋永会(1967—),男,研究员,博士,主要从事水污染控制技术研究,songyh@craes.org.cn
X703
1674-991X(2017)04-0451-06
10.3969/j.issn.1674-991X.2017.04.061
王培良,钱锋,宋永会,等.臭氧氧化降解水中磺胺嘧啶的机理研究[J].环境工程技术学报,2017,7(4):451-456.
WANG P L, QIAN F, SONG Y H, et al.Degradation mechanisms of sulfadiazine in aqueous solution by ozonation[J].Journal of Environmental Engineering Technology,2017,7(4):451-456.
