硫辛酸联合前列地尔降低早期糖尿病肾病患者尿微量蛋白及胱抑素C含量的效果
2017-07-18李晗,周倩,董萍
李 晗,周 倩,董 萍
·临床医学· ·论著·
硫辛酸联合前列地尔降低早期糖尿病肾病患者尿微量蛋白及胱抑素C含量的效果
李 晗,周 倩,董 萍
目的 通过检测尿微量蛋白及胱抑素C含量探讨硫辛酸联合前列地尔对早期糖尿病肾病患者的临床疗效。方法 选取2015年6月至2016年3月在上海市第一康复医院代谢及肾病康复科接受治疗、符合本研究纳入和排除标准的早期糖尿病肾病患者90例,根据接受治疗情况将患者分为3组:对照组、硫辛酸组、硫辛酸联合前列地尔组,每组30例。对照组患者仅服用常规药物,未使用静脉药物;在服用常规药物的同时,硫辛酸组患者给予硫辛酸注射液静脉滴注2周(300 mg/d),硫辛酸联合前列地尔组患者联合使用2种药物2周(硫辛酸300 mg/d,前列地尔20 g/d)。检测并记录3组患者尿微量蛋白及胱抑素C含量。结果 与治疗前相比,治疗2周后对照组患者尿微量蛋白及胱抑素C含量无明显改变,硫辛酸组和硫辛酸联合前列地尔组患者尿微量蛋白及胱抑素C含量降低,硫辛酸联合前列地尔组降幅大于硫辛酸组,差异有统计学意义(P<0.05)。结论 α-硫辛酸治疗能降低早期糖尿病肾病患者尿微量蛋白及胱抑素C含量,联合使用前列地尔疗效更为显著。
糖尿病肾病;硫辛酸;前列地尔;尿微量蛋白;胱抑素C
近年来,随着经济发展及人均寿命的延长,我国糖尿病的发病率正在剧增,2010年美国糖尿病协会(ADA)对18岁以上的近十万人群进行了糖尿病普查,发现糖尿病的发病率达到11.6%[1-3],据文献报道,1型糖尿病患者糖尿病肾病(diabetic nephropathy,DN)的发病率为33%~40%,2型糖尿病患者为20%~25%,糖耐量异常患者的发病率甚至高达50%[3-4]。糖尿病患者随病程延长常可发生大血管、小血管及微血管并发症,动脉粥样硬化、心、脑、肾等病变的发生也与糖尿病关系密切,这些病变发生对患者的健康和生命造成严重的威胁。DN是糖尿病常见的微血管并发症之一,亦是糖尿病致死的主要原因之一,若不及时治疗,最终将导致肾功能衰竭[1]。本研究旨在探讨硫辛酸、前列地尔或两药联合使用对早期糖尿病肾病患者的临床疗效,为延缓糖尿病肾病提供理论依据。
表1 3组患者的基本资料(x±s)
注:BMI:体质量指数;GFR:肾小球滤过率;HbA1c:糖化血红蛋白
1 资料与方法
1.1 研究对象
收集2015年6月至2016年3月在上海市第一康复医院代谢及肾病康复科接受治疗的100例2型糖尿病2~3期肾病合并胱抑素C增高患者的临床资料。纳入标准:血压控制良好,均低于180/100 mmHg;糖化血红蛋白小于8.5%;肝功能正常,不合并基础肾脏疾病;精神良好,对答切题、无精神病史;具有独立思维能力、无行走及视力障碍、无急性心力衰竭及呼吸衰竭、无急性感染、无中度以上贫血(血红蛋白<80 g/L)、无未控制的高血压(血压>180/100 mmHg)及高血糖(糖化血红蛋白>8.5%)病史。排除标准:急慢性肾炎、尿路感染、酮症酸中毒、心力衰竭及使用肾毒性药物的患者。最终纳入本研究患者90例。男性38例,女性52例,平均年龄(70.20±10.35)岁,HbA1c(6.70±3.35)%。合并原发性高血压35例,腔隙性脑梗死28例,脂代谢异常48例。见表1。研究方案得到医院伦理委员会批准,所有患者签署知情同意书。
1.2 患者分组与治疗
将患者分为3组:对照组、硫辛酸组和硫辛酸联合前列地尔组,每组各30例。所有患者给予优质蛋白低盐低脂饮食,正常服用降糖、降压药物,同时避免使用肾损害药物等。对照组正常服用常规药物,不使用静脉药物。硫辛酸组患者在常规口服药物基础上,给予硫辛酸(0.9%氯化钠注射液250 ml+硫辛酸注射液300 mg)静脉滴注2周,硫辛酸联合前列地尔组患者给予0.9%氯化钠注射液250 ml+硫辛酸注射液300 mg静脉滴注的同时,联合应用0.9%氯化钠注射液100 ml+前列地尔20 mg静脉滴注2周。
1.3 检测指标和方法
一般资料包括患者年龄、性别、原发病及基本测量指标[身高、体质量、体质量指数(BMI)]。血液生化指标包括血红蛋白、糖化血红蛋白(HbA1c)、血糖、胱抑素C、肝肾功能和尿微量蛋白。
1.4 统计学处理
应用SPSS 21.0软件进行数据分析。计量资料以均数±标准差(x±s)表示,组间比较采用配对t检验,检验水准(α)为0.05。P<0.05为差异有统计学意义。
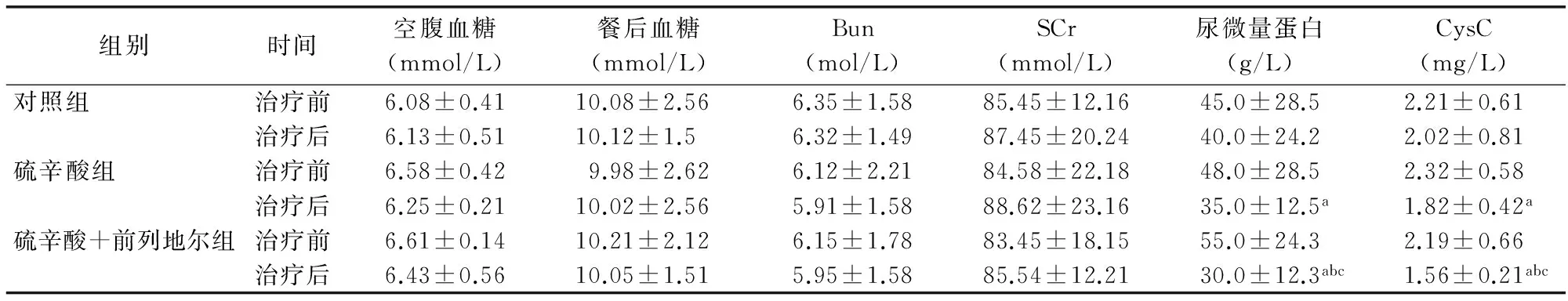
表2 3组患者治疗前后血液生化指标比较(x±s,每组n=30)
注:Bun:尿素氮;Scr:肌酐;CysC:胱抑素C。与同组治疗前比较aP<0.05;与对照组比较bP<0.05;与硫辛酸组比较cP<0.05
2 结果
经治疗后,3组患者空腹血糖、餐后血糖、尿素氮、肌酐均无明显变化,而硫辛酸组和硫辛酸联合前列地尔组患者的尿微量蛋白、胱抑素C均较治疗前下降,差异有统计学意义(P<0.05),且硫辛酸联合前列地尔组较对照组和硫辛酸组下降更加明显,差异有统计学意义(P<0.05)。见表2。
3 讨论
目前临床对于尿微量蛋白的关注较多,微量蛋白尿反映了肾脏异常渗漏蛋白质,是早期肾脏受损的表征,也是糖尿病损害肾脏的早期征象,反映了血管系统已发生异常改变[5-7]。定期检测尿微量白蛋白对于肾脏的预防及早期治疗尤为重要[5]。血清肌酐和尿素氮是肾功能的评价指标之一,但少有研究提出可以作为临床评估肾小球滤过功能受损的指标,因为血清尿素氮、肌酐只有在肾小球滤过率(GFR)下降至1/3~1/2时才有明显变化,然而此时肾功能损害已经发展到慢性肾脏病的3期[8]。
循环中的胱抑素C只能通过肾小球滤过被清除,其可被近曲小管重吸收,且重吸收后被完全分解代谢,不会再次进入血液,因此其在循环中的浓度取决定于肾小球滤过功能,不依赖其他因素,如性别、年龄、饮食、药物和炎症的影响,是一种反映GFR变化的理想同源性标记物[9]。研究表明胱抑素C的诊断准确性明显优于血清肌酐[4,10-11],且健康成人血清胱抑素C的平均含量随年龄增长呈增加趋势,因此对老年人肾小球滤过功能和评估更有价值。
DN是糖尿病的一种严重的、慢性微血管并发症,是糖尿病患者病死率增加的主要因素之一[1,4,11]。本研究显示,入组患者血肌酐指标均在正常范围,但胱抑素C指标已高于正常,且肾小球滤过率亦下降,患者肾功能已经受损。研究表明超过30%的糖尿病肾损害患者发展为肾功能衰竭而需要血液透析治疗[5],亦有研究表明,胱抑素C诊断糖尿病肾损害的灵敏度和特异度分别为40%和100%[12],因此胱抑素C含量改变对诊断糖尿病伴无证据肾损害患者非常重要。
本研究显示,患者静脉硫辛酸治疗后尿微量蛋白及胱抑素C含量降低,联合使用前列地尔患者的尿微量蛋白及胱抑素C含量降低更多。α-硫辛酸通过降低血糖、改善氧自由基发挥抗氧化作用,从而达到改善肾脏循环、肾功能并降低尿微量蛋白的作用[13]。Nakayama等[11]曾采用血管紧张素转换酶抑制剂联合前列地尔治疗慢性肾脏病患者发现前列地尔对其有肾脏保护作用,可有效地延缓肾功能的衰退。前列地尔可通过抑制肾素-血管紧张素-醛固酮(RAS)系统降低出球小动脉血管阻力,降低肾小球内压以达到改善肾小球滤过功能的作用[14];此外,前列地尔还可通过抑制血小板聚集、免疫复合物形成和炎症介质反应以及抗氧化作用,发挥保护血管内皮细胞、保护肾实质等作用[15-16]。但本研究并未给予单独静滴前列地尔治疗疗效对比,这需要进一步研究来明确。
[1] 王芳,左力.老年人慢性肾脏病的流行病学特点[J]. 中华老年医学杂志, 2009,28(8): 620. DOI:10.3760/cma.j.issn.0254-9026.2009.08.002.
[2] 中华医学会糖尿病学分会.中国2型糖尿病防治指南(2013版)[M].北京,北京大学医学出版社,2014:2-12.
[3] 高苹,吴小燕.糖尿病肾病的诊断[J].临床肾脏病杂志, 2012,12(5):202-204. DOI: 10.3969/j.issn.1671-2390.2012.05.005.
[4] 刘志红,黎磊石.深入开展糖尿病肾病的研究[J]. 肾脏病与透析肾抑制杂志, 2000, 9(4): 301-302. DOI: 10.3969/j.issn.1006-298X.2000.04.001.
[5] 许讯辉,丁小强,任豫申.血清胱抑素C:一种简便测定肾小球滤过率的标志物[J].中国临床医学,2001(3):65-68. DOI: 10.3969/j.issn.1008-6358.2001.03.022.
[6] Cortese S,Konofal E, Bemardina B, et al.Does excessive daytime sleepiness contribute to explaining the association between obesity and ADHD symptoms?[J]. Med Hypotheses, 2008, 70(1): 12-16. DOI: 10.1016/j.mehy.2007.04.036.
[7] Schwertner A, Costa GD.Efficacy of melatonin in the treatment of endometriosis: a phase II, randomized, doubleblind, placebo-controlled trial[J]. Pain,2013,154(6): 874-881.DOI: 10.1016/j.pain.2013.02.025.
[8] Yi X, Nickeleit V, James LR, et al.A-lipoic acid protects diabetic apolipoprotein E-deficient mice from nephropathy[J]. J Diabetes Complications, 2011, 25(3):193-201. DOI: 10.1016/j.jdiacomp.2010.07.004.
[9] 张秀丽.Cystatin C 在肾功能损害诊断中的临床应用[J].中国实用医药,2009, 4(3):110-113. DOI:10.3969/j.issn.1673-7555.2009.03.062.
[10] Diehm C,Schuster A, Lange S, et al. Highprevalence of peripheral arterial disease and co-morbidity in 6880 primary carepatients: cross-sectional study[J]. Atherosclerosis, 2004, 172(1):95-105.
[11] Nakayama Y, Kohda Y, Nonoguchi H, et al. Long-term observation of renal function on combination therapy with prostaglandin and angiotensin-converting enzyme inhibitor for chronic kidney disease[J]. Clinical Nephrology, 2008, 69(6): 402-407.
[12] Levey AS, Coresh J, Steffes MW, et al.National kidney foundation practice guidelines for chronic kidney disease: evaluation, classification, and stratification[J]. Annals Int Med, 2003, 139(2):137-147.
[13] 张晶晶,邓后亮,赵家军.A-硫辛酸预处理对人脐静脉内皮细胞缺氧复氧损伤的保护作用[J]. 实用医学杂志, 2014(7):1053-1056. DOI:10.3969/j.issn.1006-5725.2014.07.014.
[14] Ling Y, Hu SX. Effects of alprostadil on apoptosis induced by renal ischemia-reperfusion injury in rabbits[J]. 中华实验外科杂志, 2011, 28(8):1356-1358. DOI:10.3760/cma.j.issn.1001-9030.2011.08.056.
[15] Reisy K, Kang HM, Hostetter T, et al. Molecular mechanisms of diabetes kidney disease[J].J Clinical Invest,2014,124(6): 2333-2340. DOI: 10.1172/JCI72271.
[16] 彭永德,宁光,赵家军.中国糖尿病患者血压管理的专家共识[J]. 中华内分泌代谢杂志, 2012,28(8): 614-618.DOI:10.3760/cma.j.issn.1000-6699.2012.08.003.
(本文编辑:张阵阵)
Effects of lipoic acid combined with alprostadil on the reduction of the levels of cystatin C and urine trace protein in patients with early diabetic nephropathy
LiHan,ZhouQian,DongPing
(DepartmentofNephrology,FirstRehabilitationHospitalofShanghai,Shanghai200090,China)
Objective To explore the clinical efficacy of lipoic acid combined with alprostadil on patients with early diabetic nephropathy (EDN) through the detection of cystatin C (CysC) and urine trace protein levels.Methods Ninety EDN patients admitted into the Department of Nephrology of the First Rehabilitation Hospital of Shanghai for treatment from June 2015 to March 2016 and who were confirmed to the inclusion and exclusion standards were enrolled for the study. In accordance with different treatment methods, the patients were divided into the control group, the α-lipoic acid group and the α-lipoic acid combined with alprostadil group (or the combination group). The patients in the control group just received routine therapy without any intravenous drugs, the patients in the α-lipoic acid group were given intravenous α-lipoic acid injection at a dosage of 300 mg/d for 2 weeks, in addition to conventional drugs, and the patients in the combination group were treated with α-lipoic acid and alprostadil at dosages of 300mg and 20 g daily. Then, the levels of urine trace protein and cystatin C were detected and recorded.Results As compared with those before treatment, the urine trace protein and CysC levels of the patients in the α-lipoic acid and the combination groups were significantly decreased after treatment for 2 weeks (P<0.05). The levels of urine trace protein and CysC in the α-lipoic acid and the combination groups were all decreased, with the aptitude of the combination group being greater than that of the α-lipoic acid group (P<0.05).Conclusion α-lipoic acid could decrease the levels of urine trace protein and CysC in the patients with early diabetic nephropathy, and the combined use of alprostadil could achieve better therapeutic results.
Diabetic nephropathy; Lipoic acid; Alprostadil; Urine trace protein; Cystatin C
国家重大科学仪器设备开发专项(2012YQ150092);杨浦区“百医登高”人才培养计划
200090 上海,上海市第一康复医院代谢及肾病康复科
董萍,电子信箱:dongping809@163.com
R587.1
A
10.3969/j.issn.1009-0754.2017.03.017
2017-03-03)
