一株香茅草内生细菌Pantoeaananatis CcSh-1的分离、鉴定及产香条件优化研究*
2017-07-18刘选明张鑫徐婷李燕廖红东柳倩马江山施小伟袁珊珊朱咏华
刘选明,张鑫,徐婷,李燕,廖红东,柳倩,马江山,施小伟,袁珊珊,朱咏华
(湖南大学 生物学院,湖南 长沙 410082)
一株香茅草内生细菌PantoeaananatisCcSh-1的分离、鉴定及产香条件优化研究*
刘选明,张鑫,徐婷,李燕,廖红东,柳倩,马江山,施小伟,袁珊珊,朱咏华†
(湖南大学 生物学院,湖南 长沙 410082)
从成熟香茅草的鞘部,分离筛选出一株具有明显清新愉悦香味的内生细菌CcSh-1.通过形态学、生理生化和16S rRNA序列分析,鉴定该菌株为菠萝泛菌(Pantoeaananatis).采用顶空气相色谱质谱联用仪技术,检测出CcSh-1的挥发性组分包含以柠檬醛为主要成分的萜类化合物,与香茅草的产香成分相似.综合考察CcSh-1在液体培养条件下的产香效果和生长状况,初步确定CcSh-1的最适宜培养条件:以牛肉膏为碳源,蛋白胨为氮源,温度30 ℃,pH 7.0.同时,培养基中加入1%(w/v)香茅草粉末,能够促进CcSh-1产香,体现了内生菌与其宿主间存在相互作用.
内生细菌;产香;菠萝泛菌;香茅草
香茅草[Cymbopogoncitrates(DC.) Stapf],又名柠檬草,为禾本科香茅属多年生草本植物,是一种重要的热带香料作物和药用植物[1].香茅草具有清新柠檬味,其挥发性产物以萜烯类为主,其中柠檬醛含量较为丰富.柠檬醛在自然状态下以橙花醛及香叶醛混合物的形式存在,因其浓郁的果香味,被广泛运用于食品加工以及香料加工行业.但是,作为香料生产的主要原料之一,目前农业种植香茅草远不能满足快速发展的香料行业需求.
植物内生菌是指其生活史的全部阶段或者部分阶段处于健康植物组织细胞间隙或者细胞内的微生物[2].植物内生菌与宿主植株有着复杂的互作关系,主要表现在促进植物生长、增强植物抗病以及促进植物代谢产物合成等方面[3].植物次生代谢产物对宿主与内生菌的互作具有积极作用,内生菌能够引起宿主植物的生理反应,同时宿主植物能够影响内生菌的次生代谢[4].香料植物具有丰富的天然代谢产物,对其内生菌的研究正逐渐成为热点.但目前的报道多专注于真菌[5-7],对香茅草而言,仅发现1株产香内生真菌[8],而针对其内生细菌的研究仍处于空白.
本文从香茅草中分离筛选出一株具有明显清新愉悦香味的细菌,命名为CcSh-1,并鉴定为菠萝泛菌(Pantoeaananatis).为了确定菌株适宜的产香条件,本文初步探讨了碳源、氮源、温度、pH值等因素对CcSh-1菌株产香及生长的影响.同时,也检测了加入香茅草作为CcSh-1培养基成分对其产香效果的影响,旨在为今后香料植物及其内生细菌的相互作用研究提供基础.
1 材料与方法
1.1 材料
1.1.1 试验菌株与宿主植株
由本实验室从成熟香茅草鞘部,分离筛选所得菌株PantoeaananatisCcSh-1,已于2014年1月26日由中国微生物菌种保藏管理委员会普通微生物中心(CGMCC)生物保藏,保藏号为CGMCC No.8715,登记命名为泛菌Pantoeasp.CcSh-1.香茅草[Cymbopogoncitrates(DC.) Stapf],由福建农林大学提供,种植于湖南省长沙市岳麓区湖南大学(东经112.95°,北纬28.18 °).
1.1.2 培养基
分离培养基:水琼脂培养基(WA):琼脂粉18 g/L,pH7.2 ± 0.2,1×105Pa灭菌25 min;酵母提取物琼脂培养基(TWYE):酵母提取物0.25 g/L,K2HPO40.5 g/L,琼脂粉18 g/L,pH7.2 ± 0.2,1×105Pa灭菌25 min; 甘露醇大豆琼脂培养基(MS):甘露醇20 g/L,大豆粉20 g/L,琼脂粉20 g/L,pH7.2 ± 0.2,1×105Pa灭菌25 min;大豆酪蛋白琼脂培养基(TSA):胰蛋白胨 15 g/L,植物蛋白胨5 g/L,NaCl 5 g/L,琼脂粉15 g/L,pH7.3 ± 0.2,1×105Pa灭菌25 min.
营养培养基(NA):牛肉膏3 g/L,蛋白胨10 g/L,NaCl 5 g/L,pH 7.3 ± 0.2,1×105Pa灭菌25 min.
香茅草培养基:以NA培养基为基础,加入1%(w/v)过40目筛香茅草粉末.
1.2 方法
1.2.1 细菌的分离与纯化
将成熟香茅草样品超声洗涤,按根、茎、叶尖、叶鞘分开,于室温干燥后表面消毒:124 mM Na2HP04,超声洗涤1 min; 90%乙醇,浸泡1 min;4% NaCl,浸泡6 min;90%乙醇冲洗30 s,无菌水冲洗2次;5% Na2S2O3,浸泡5 min;无菌水冲洗2次,并晾干[9].将组织样品,剪成1 cm小段,接至分离培养基,分别于27 ℃和37 ℃培养箱培养.为验证表面消毒实验是否成功,收集香茅草表面消毒过程中最后一步所剩的无菌水,取200 μL均匀涂抹于NA培养基,27 ℃培养24 h,检测NA培养基是否有微生物生长.分离获得的菌株转接至营养琼脂培养基培养,以期获得菌株纯培养物.采用感官评价,对产香内生细菌进行闻香筛选.
1.2.2 菌种鉴定
生理生化鉴定:取筛选所得菌株纯培养物,进行菌落形态学观察;革兰氏反应试验:制作涂片,结晶紫初染1 min,无菌水冲洗,吸干,碘液媒染1 min,无菌水冲洗,吸干,95%乙醇脱色30 s,无菌水冲洗;番红复染2 min,无菌水冲洗,吸干,显微镜下观察;甲基红试验:取培养48 h菌体发酵液2 mL,加入甲基红指示剂1~2滴,观察颜色变化;淀粉水解试验:将菌株接置于淀粉水解培养基(添加2 g/L淀粉的营养琼脂培养基),30 ℃培养48 h,碘液染色后,观察培养基颜色变化;吲哚试验:取培养48 h菌体发酵液2 mL加入Kovacs氏试剂2~3滴,轻摇,观察颜色变化;柠檬酸盐试验:将菌株接种至柠檬醛盐利用培养基,30 ℃培养48 h,观察颜色变化;V-P试验:将菌株接种到V-P试验培养基,30 ℃培养48 h,取2.5 mL发酵液,先加入α-萘酚的99%乙醇溶液0.6 mL,随后加入40% KOH 0.2 mL,观察颜色变化.
16S rRNA序列分析:采用细菌基因组DNA提取试剂盒(上海捷瑞生物工程有限公司),抽提菌株基因组DNA,以该DNA为模板,采用细菌16S rRNA通用引物(27F,1492R)扩增菌株16S rRNA核酸片段.经上海生物工程有限公司测序完成后,与NCBI核酸数据库进行同源性比对(www.ncbi.nlm.nih.gov/Blast),利用软件MEGA6.0,使用邻近结合法(neighbor-joining method)进行1 000次步长计算,制作CcSh-1的系统发育树.
1.2.3 挥发性产物分析鉴定
采用气相色谱-质谱联用仪(Thermo-Finnigan Trace GC,Polaris Q,Tri plus RSH三合一自动进样器及NIST08谱库)对内生菌和香茅草挥发性成分进行分析.
样品制备:将接种于营养琼脂培养基的菌株纯培养分散于无菌水中,置于螺纹色谱瓶中,待自动顶空进样器收集.参照Barbosa等的研究方法[1],对香茅草新鲜样品进行阴干处理,最大程度减小叶片挥发性成分的损失,同时降低叶片的含水量,加入SiO2研磨,将汁液转入色谱瓶,待自动顶空进样器收集.
顶空进样条件:顶空加热温度40 ℃,平衡时间5 min,顶空进样针温度60 ℃,进样量1 mL,用高纯氦气推动和清洗顶空进样针,清洗时间为5 min,顶空用氦气压力为0.8 bar.
色谱条件:DB-5石英毛细管柱,30 m×0.25 mm×0.25 μm,采用程序性升温,初始温度为60 ℃,保持2 min,然后以5 ℃/min升至130 ℃,保持2 min,再以5 ℃/min升至180℃后,以20 ℃/min的升温速率升至220 ℃,并保持5 min;进样口温度220 ℃.载气为高纯氦(纯度大于99.999%),流速:1.0 mL/min,分流进样,分流比为10∶1.
质谱条件:电子轰击电离源,电子束能量70 eV;连接线温度:230 ℃;溶剂延迟3 min,3~25 min采用全扫描工作方式,扫描范围25~250 amu,25~30 min,Fil/Delay.
1.2.4 CcSh-1的产香条件优化
碳源优化:选择常见的6种碳源,分别是蔗糖、葡萄糖、乳糖、麦芽糖、果糖、牛肉膏(3 g/L),其余成分为蛋白胨 10 g/L,NaCl 5 g/L,pH:7.3±0.2,温度为30 ℃,CcSh-1初始菌体浓度OD600为0.02,经过10 h培养,绘制其生长曲线,感官评价产香情况以比较选择最优碳源(以下检测方法相同).
氮源优化:选择常见的6种氮源,分别是酵母浸膏、尿素、胰蛋白胨、硝酸钠、硫酸铵、蛋白胨(10 g/L),其余成分为最优碳源(3 g/L),NaCl 5 g/L,pH:7.3±0.2,温度为30 ℃.
初始pH值选择:选择最佳碳源、氮源,温度为30 ℃,pH分别设置为6,7,8.
温度选择:选择最佳碳源、氮源以及最适pH值,温度分别设置为25 ℃,30 ℃,35 ℃.
1.2.5 香茅草诱导CcSh-1产香
采集香茅草的叶与鞘,洗净阴干,利用秸秆破碎机破碎,过40目筛收集粉末.以1%(w/v)比例称取,混入NA培养基,于30 ℃条件下培养CcSh-1,24 h后,刮取香茅草诱导培养基上生长的菌体,混于螺口色谱瓶的无菌水中,利用顶空气相色谱质谱联用仪检测挥发性成分.
2 结果与分析
2.1 产香内生细菌的筛选与分离
对成熟香茅草组织片段在4种分离培养基中24 h培养观察,共分离出36株产香内生细菌,其中通过WA培养基分离出10株细菌,培养温度均为27 ℃;通过TWYE培养基分离出14株细菌,从27 ℃和37 ℃分别获得9株和5株菌;通过MS培养基分离出9株细菌,从27 ℃和37 ℃分别获得8株和1株菌;通过TSA培养基分离出3株细菌,培养温度均为27 ℃.通过感官评定,从36株产香细菌中筛选出一株具有明显清新、愉悦香味的内生细菌CcSh-1,该菌来源于成熟香茅草的鞘部,分离自27 ℃,WA培养基.
2.2 菌种鉴定
CcSh-1菌株呈杆状,属于革兰氏阴性菌,甲基红阴性,V-P阳性,吲哚阳性,可以利用蔗糖、乳糖,无法利用淀粉,能水解明胶,能利用柠檬酸盐等(表1),根据《伯杰氏细菌鉴定手册》对泛菌属生理特征的描述,说明其与Pantoeaananatis菌株相似.CcSh-1的16S rRNA基因序列与NCBI核酸数据库进行同源性比对,见图1.系统发育树通过ClustalX (Version
1.83) 和MEGA 6构建,矩阵树由临接法计算而得.进化树分枝代表了CcSh-1与其它菌种之间的进化差异. 图1表明其与数据库中已知细菌PantoeaananatisLMG20103的16S rRNA基因序列的相似性达到99.9%,综合上述,将其鉴定为PantoeaananatisCcSh-1.菠萝泛菌作为内生菌能够侵染单子叶植物和双子叶植物,对西红柿、辣椒以及咖啡的生长具有明显促进作用,同时,菠萝泛菌作为病原菌对宿主植株产生病害也被广泛关注[10].但迄今为止,尚未发现关于菠萝泛菌产香的相关报道.

表1 CcSh-1与泛菌属细菌的生理生化特征比较Tab. 1 The comparison of physiological and biochemical characterization of CcSh-1 with bacteria from genus Pantoea
+:阳性; -:阴性.+:positive; -:negative

图1 CcSh-1的16S rRNA的系统发育树.Fig.1 Phylogenetic tree of Pantoea sp.CcSh-1.
2.3 内生菌CcSh-1及宿主香茅草挥发性成分分析
利用顶空气相色谱质谱联用仪分别对香茅草及其内生菌CcSh-1进行挥发性成分分析.香茅草共检测出7种成分:α-蒎烯,1s-α-蒎烯,3-蒈烯,艾蒿醚,2,2-二甲基-3,4-辛二烯,橙花醛和香叶醛(图2A,表2).可见香茅草的挥发性成分以萜烯类为主,其中蒎烯与柠檬醛为主要成分,这与Barbosa[1],Carbajal[11]等关于香茅草主要成分的研究结果一致.已有文献报道关于香茅草精油的挥发性成分达20至30种[1,11-12],但本研究只检测出7种成分,可能的原因是我们的样品采集来自于自动顶空进样器,香茅草所包含的高沸点化合物难以通过自然发散进入自动顶空进样器中,含量很少的挥发性成分也因为顶空进样器的提取效率所限,导致挥发性产物没有完全被收集到,无法与通过各种提取工艺获得的香茅草精油相比,只能获得其较主要的挥发性成分.
通过顶空气相色谱质谱联用技术,检测出CcSh-1共有6种挥发性成分(图2B),主要成分是萜烯类,与杨黎华[8]、刘丽芬[13]等关于香茅草内生真菌挥发性成分的研究结果相似.CcSh-1与宿主植株香茅草共有的挥发性香味物成分为:α-蒎烯、橙花醛和香叶醛(表2),其中,橙花醛和香叶醛作为柠檬醛的两种同分异构体,含量较高.这两种组分通过采用标准品为对照进一步得到了验证(图2C).
香茅草植株以及CcSh-1的挥发性成分中,柠檬醛的含量都相对较高.在植物中,萜烯类化合物主要以类异戊二烯为前体,在萜烯合酶以及萜烯异构酶的作用下进行合成,其合成过程主要由甲羟戊酸途径(MVA)、甲基赤藓醇途径(MEP)和脱氧木酮糖-5-磷酸途径(DXP)组成[14].其中,MVA途径最早发现于细菌体内,而且细菌同样含有合成萜类的前体化合物焦磷酸异戊烯酯(IPP)以及二甲烯丙基焦磷酸(DMAPP),因此内生细菌与宿主植物有可能产生相似的代谢产物.利用微生物快速生长、易操作的优势,优化产香微生物的产香条件,提高其主要成分的产量,有利于弥补香料植物在香料生产上的短缺.
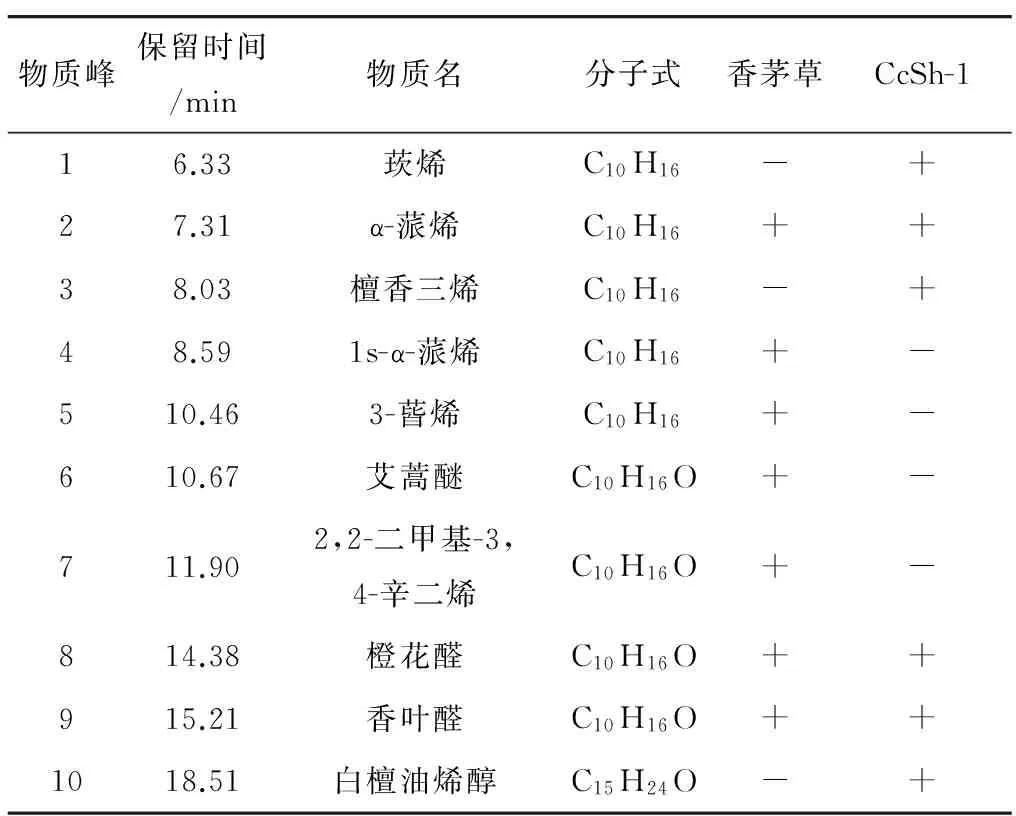
表2 香茅草和CcSh-1挥发性成分表Tab.2 Volatile organic chemicals obtained fromCymbopogon citrates (DC.) Stapf and CcSh-1
+:已检测出;-:未检测出. +:detected; -:undetected.
2.4 CcSh-1产香条件优化
Phelan[15]等的研究指出,工程菌萜烯化合物的产量与工程菌的生长有着密切关系.因此优化微生物的生长条件可有利于微生物的产香效果.微生物在6种不同碳源的培养条件下的生长曲线结果显示见图3. CcSh-1初始菌体浓度OD600为0.02,培养时间为10 h. 图3A的条件为:碳源分别为蔗糖,葡萄糖,乳糖,麦芽糖,果糖以及牛肉膏,氮源为蛋白胨,



图2 香茅草(A),CcSh-1(B)挥发性成分及柠檬醛标样(C)经自动顶空进样器收集,通过气相色谱质谱联用仪检测所得总离子流图.1.莰烯; 2.α-蒎烯; 3.檀香三烯; 4.1s-α-蒎烯; 5.3-蒈烯; 6.艾蒿醚; 7.2,2-二甲基-3,4-辛二烯; 8.橙花醛; 9.香叶醛; 10.白檀油烯醇.Fig.2 Total ion chromatogram for volatile organic chemicals of Cymbopogon citrates (DC.) Stapf (A) and CcSh-1(B) and citral (C) by automatic headspace sampler and gas chromatograph mass spectrometer.1. camphene; 2. α-pinene; 3. santolina triene; 4. 1s-α-pinene; 5. 3-carene; 6. artemiseole; 7. 2,2-dimethylocta-3,4-dienal; 8. neral; 9. geranial; 10. α-santalol.
pH7,温度30 ℃.图3B的条件为:氮源分别为酵母浸膏,尿素,胰蛋白胨,硝酸钠,硫酸铵,碳源为牛肉膏,pH7,温度30 ℃. 图3C的条件为:pH分别为6,7,8,碳源为牛肉膏,氮源为蛋白胨,温度30 ℃. 图3D的条件为:温度为25 ℃,30 ℃,35 ℃,碳源为牛肉膏,氮源为蛋白胨,pH7,温度30 ℃.对于CcSh-1的生长状况而言,牛肉膏>蔗糖>乳糖>麦芽糖>果糖>葡萄糖.感官评价表明,对于CcSh-1的产香而言,牛肉膏=乳糖>蔗糖=麦芽糖>果糖=葡萄糖,并且牛肉膏和乳糖作为碳源,CcSh-1的产香效果明显优于其它碳源.综合考虑,选择牛肉膏作为最优碳源.同样根据CcSh-1的生长状况(图3B)以及产香效果,选择蛋白胨作为最优氮源.在30 ℃,pH7.0的条件下,CcSh-1的生长状况最好(图3C,3D).同时发现,不同的pH会影响CcSh-1的产香效果,其中pH7.0和pH8.0时的产香效果相似,优于pH6.0,但是温度对其产香效果影响不大.综上所述,初步筛选出以牛肉膏为碳源,蛋白胨为氮源,pH7.0,温度为30 ℃的培养条件培养CcSh-1,其挥发性香味最优,生长状况最好.
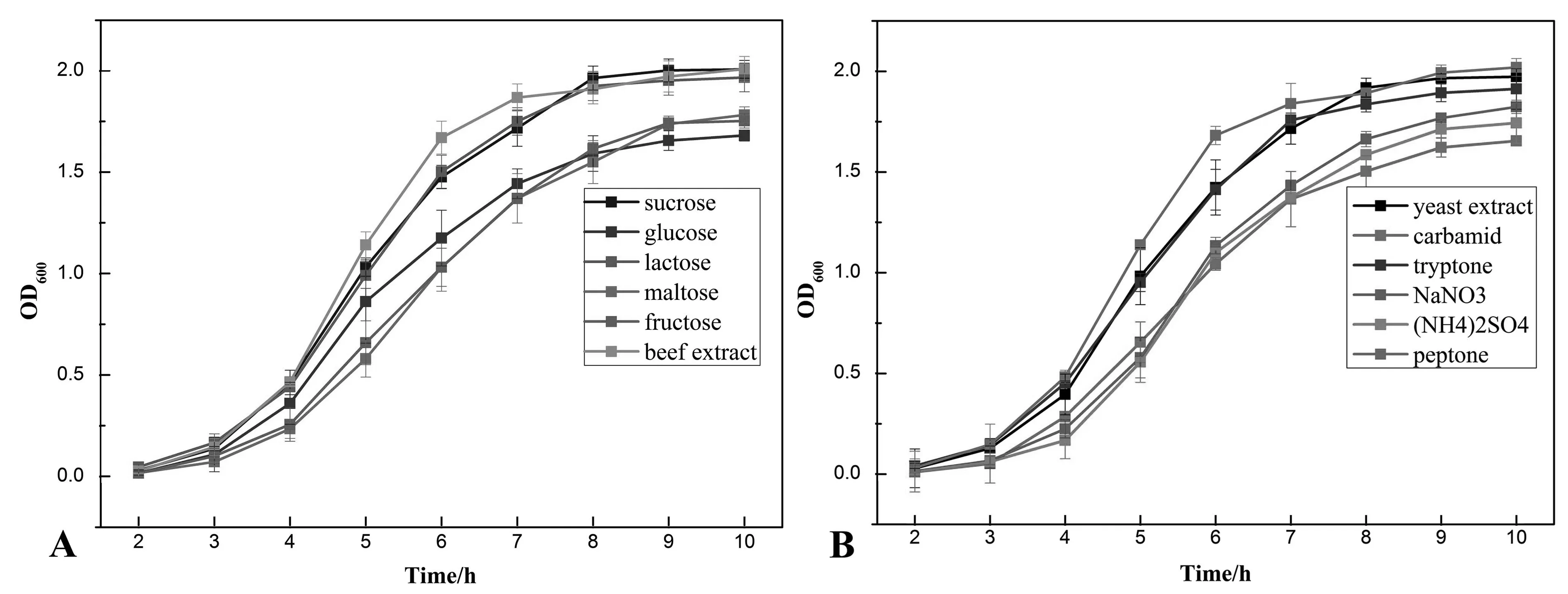

图3 不同碳源(A),氮源(B),pH(C),温度(D)条件下CcSh-1生长曲线.Fig.3 Growth curves of CcSh-1 under different growth conditions
2.5 香茅草对CcSh-1产香的影响
CcSh-1在其生活史的主要阶段都处于香茅草组织内,由于内生菌与宿主植株特殊的互作关系,香茅草生长过程中的部分代谢产物有可能诱导细菌产香.为了验证上述猜想,将香茅草粉末以1%(w/v)比例混入CcSh-1的培养基中,以不加香茅草粉末的培养基为对照,培养48 h,刮取培养基表面细菌纯培养物(避免培养基的干扰),检测其产香能力.图4A和4B显示,不管加香茅草与否,在相同条件下检测,都产生了橙花醛和香叶醛,但同一保留时间所对应的总离子流数有差异(图4C),加了香茅草成分培养的CcSh-1的总离子流数明显大于未加的.该结果表明,以香茅草粉末为底物可以提升CcSh-1挥发性成分中的柠檬醛含量,并且暗示产香内生菌与其宿主间存在一定的相互作用,其机理有待进一步阐明.
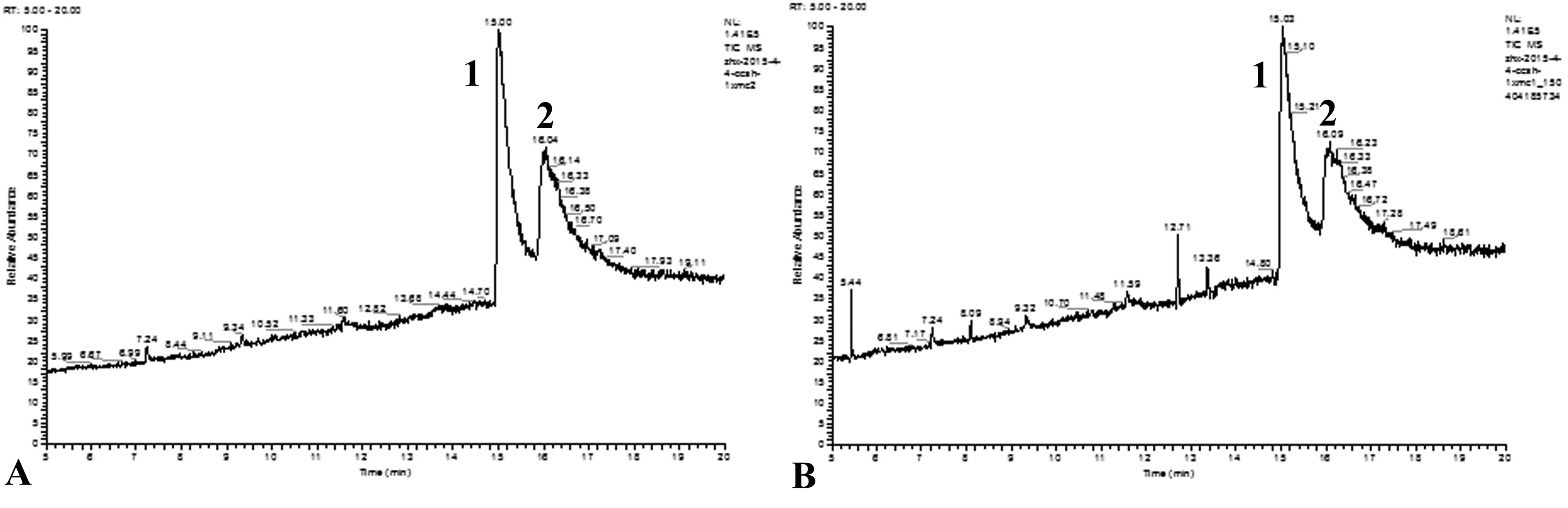
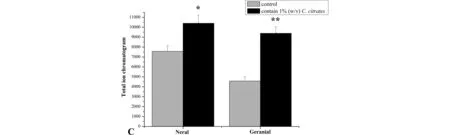
图4 含(A)与未含(B)1%(w/v)香茅草培养基培养的CcSh-1挥发性成分,经自动顶空进样器收集, 通过气相色谱质谱联用仪检测的总离子流图以及柠檬醛含量比较(C)Fig.4 Total ion chromatogram of CcSh-1 volatile organic chemicals with(A) and without adding 1% (w/v) C. citrates in culture medium by automatic headspace sampler and gas chromatograph mass spectrometer, and their citral concentration comparison (C) 1:橙花醛. 2:香叶醛.1:neral. 2:geranial.
3 结 论
分离自成熟香茅草的内生细菌PantoeaananatisCcSh-1,能够产生稳定、清新、愉悦的香味,且其挥发性成分以柠檬醛(橙花醛与香叶醛)的含量较高,与宿主植株香茅草的挥发性产物相似.以牛肉膏为碳源,蛋白胨为氮源,pH 7.0,温度为30 ℃的培养条件培养CcSh-1,其挥发性香味最优,生长状况最好.同时,香茅草粉末作为底物加入培养基培养CcSh-1,能够提升CcSh-1所产柠檬醛含量.植物内生菌资源的开发与利用正在成为当今研究的热点之一.利用能够产生挥发性香味的植物内生菌,为香料生产提供了新资源,不仅能够弥补香料植物生产方面的不足,同时也为内生菌与宿主植物的互作机理提供了研究基础.
[1] BARBOSA L C A,PEREIRA U A,MARTINAZZO A P,etal. Evaluation of the chemical composition of Brazilian commercial Cymbopogon citratus (DC) stapf samples[J]. Molecules,2008,13(8):1864-1874.
[2] STONE J K,BACON C W,WHITE J F. An overview of endophytic microbes:endophytism defined[J]. Microbial Endophytes,2000(3):29-33.
[3] KIRBY J,KEASLING J D. Biosynthesis of plant isoprenoids:perspectives for microbial engineering[J]. Annual Review of Plant Biology,2009,60(1):335-355.
[4] LI J,ZHAO G Z,VARMA A,etal. An endophyticPseudonocardiaspecies induces the production of artemisinin in Artemisia annual[J]. PloS One,2012,7(12):e51410.
[5] PIRES E J,TEIXERIRA J A,BRáNYIK T,etal. Yeast:the soul of beer’s aroma——a review of flavour-active esters and higher alcohols produced by the brewing yeast[J]. Applied Microbiology and Biotechnology,2014,98(5):1937-1949.
[6] GETHINS L,GUNSER O,DEMIRKOL A,etal. Influence of carbon and nitrogen source on production of volatile fragrance and flavour metabolites by the yeastKluyveromycesmarxianus[J]. Yeast,2015,32(1):67
[7] MASUO S,OSADA L,ZHOU S,etal.Aspergillusoryzaepathways that convert phenylalanine into the flavor volatile 2-phenylethanol[J]. Fungal Genetics and Biology,2015,77(19):22-30.
[8] 杨黎华,李祖红,陈东,等.香茅草产香内生真菌的筛选及香气成分分析[J].生物技术,2006,16(5):53-56.
YANG Lihua,LI Zuhong,CHEN Dong,etal. Screening endophyte from Cumbopogon citrates (DC.) Stapf and analysis of the flavoring compounds[J]. Biotechnology,2006,16(5):53-56. (In Chinese)
[9]XIONG X Q,LIAO H D,MA J S,etal. Isolation of a rice endophytic bacterium,Pantoea sp. Sd‐1,with ligninolytic activity and characterization of its rice straw degradation ability[J]. Letters in Applied Microbiology,2014,58(2):123-129.
[10]COUTINHO T A,VENTER S N.Pantoeaananatis:an unconventional plant pathogen[J]. Molecular Plant Pathology,2009,10(3):325-335.
[11]CARBAJAL D,CASACO A,ARRUZAZABALA L,etal. Pharmacological study of Cymbopogon citrates leaves[J]. Journal of Ethnopharmacology,1989,25(1):103-107.
[12]OLIVEIRA V C S,MOURA D M S,LOPES J A D,etal. Effects of essential oils from Cymbopogon citratus (DC) Stapf.,Lippia sidoides Cham.,and Ocimum gratissimum L. on growth and ultrastructure of Leishmania chagasi promastigotes[J]. Parasitology Research,2009,104(5):1053-1059.
[13]刘丽芬,李祖红,李雪梅,等.香茅草产香菌发酵液的挥发性成分分析及在卷烟中的应用[J]. 烟草科技,2007(11):35-39.
LIU Lifang ,LI Zuhong,LI Xuemei,etal. Analysis of volatile components in and application of fermentation liquid of flavor producing fungus in Cumbopogon citrates (DC.) Stapf [J]. Tobacco Chemistry,2007(11):35-39. (In Chinese)
[14]CHEN F,THOLL D,BOHLMANN J,etal. The family of terpene synthases in plants:a mid-size family of genes for specialized metabolism that is highly diversified throughout the kingdom[J]. The Plant Journal,2011,66(1):212-229.
[15]PHELAN R M,SEKUROVA O N,KEASLING J D,etal. Engineering terpene biosynthesis in Streptomyces for production of the advanced biofuel precursor bisabolene[J]. ACS synthetic biology,2014,4(4):393
Isolation and Identification of an Endophytic Bacterium fromCymbopogonCitrates(DC.) Stapf and Its Optimal Flavor-producing Conditions
LIU Xuanming,ZHANG Xin,XU Ting,LI Yan,LIAO Hongdong,LIU Qian, MA Jiangshan,SHI Xiaowei,YUAN Shanshan,ZHU Yonghua†
(College of Biology,Hunan University,Changsha 410082,China)
An endophytic bacteria strain CcSh-1 that produced obvious fragrance was successfully isolated from the sheath ofCymbopogoncitrates(DC.)Stapf. CcSh-1 strain was identified asPantoeaananatisby the morphological observation,physiological and biochemical characterization and 16S rRNA sequence analysis. Headspace gas chromatography-mass spectrometry detection showed that the volatile organic components of CcSh-1 were terpenoid and mainly contained citral,which were similar to those ofC.citratesand their essential oil. The factors involved in the flavor productivity and the growth status of CcSh-1 were also investigated,and the optimal liquid culture conditions for CsSh-1 were confirmed by taking beef extract as carbon source,and the peptone as nitrogen source,under the temperature of 30℃ and pH 7.0. In addition,it was discovered that the addition of 1% (w/v) abrasive of host plant as substrate can promote the flavor production of CcSh-1,which indicated the interaction between endophyte and its host.
endophytic bacterium;flavors;pantoeaananatis;cymbopogoncitrates(DC.) Stapf
1674-2974(2017)06-0112-07
10.16339/j.cnki.hdxbzkb.2017.06.019
2015-04-20
国家自然科学基金资助项目(31672093),National Natural Science Foundation of China(31672093)
刘选明(1963—),男,湖南新宁人,湖南大学教授,博士生导师†通讯联系人,E-mail: zyh20@hotmail.com
Q935
A
