巨大芽孢杆菌和枯草芽孢杆菌混合对马铃薯生长及土壤微生物含量的影响
2017-07-18邢嘉韵兰时乐李姣王惠群
邢嘉韵,兰时乐,李姣,王惠群
(湖南农业大学生物科学技术学院,湖南 长沙 410128)
巨大芽孢杆菌和枯草芽孢杆菌混合对马铃薯生长及土壤微生物含量的影响
邢嘉韵,兰时乐,李姣,王惠群*
(湖南农业大学生物科学技术学院,湖南 长沙 410128)
采用随机区组盆栽试验,以蒸馏水处理为对照,研究 33.33%(T1)、16.67%(T2)、8.33%(T3)的巨大芽孢杆菌和枯草芽孢杆菌混合菌剂对‘费乌瑞它’马铃薯生长生理及其根际土壤微生物含量的影响。结果表明,T1、T2和T3都能提高‘费乌瑞它’马铃薯块茎形成期和块茎膨大期叶片的净光合速率和超氧化物歧化酶、过氧化物酶、过氧化氢酶活性,也能提高收获期的块茎产量和水分利用率,根际土壤的细菌、真菌和放线菌含量增加,其中,T2处理的效果最明显,块茎形成期和块茎膨大期的净光合速率分别为7.17、6.40 μmol/(m2· s),与CK相比,T2处理的每盆块茎干重提高18.6 g,水分利用率提高1.64 g/kg,土壤菌落总数提高6 877.17 CFU/g。
巨大芽孢杆菌;枯草芽孢杆菌; ‘费乌瑞它’马铃薯;生长生理;土壤微生物
混合菌剂是应用于现代农业生产的一种新型微生物材料,经过特殊工艺制成,含有丰富的活菌[1],能培肥土壤,提高肥料利用率[2-4]。混合菌剂不仅能改善土壤的理化性质,提高土壤酶的活性,而且能有效降低农产品的硝酸盐含量[5-8]。混合菌剂的施用有利于生态农业的发展[9]。当土壤微生物菌剂作用于作物根部时,能够在作物根际或根内定殖,并起到化感效应[10]。目前,微生物菌剂在培肥地力、提高肥料利用率和抑制农作物对硝态氮的吸收等方面应用较多。
细胞分裂素生产菌菌剂是微生物混合菌剂的一种,含有较为活跃的微生物菌群、活性酶和有机物质等,能提高土壤根际微生物生物量。细胞分裂素生产菌的菌剂效应主要是其生命活动产生细胞分裂素。所产生的细胞分裂素促进植株的生长和光合作用,从而提高作物产量。微生物菌剂对实现肥料科学技术现代化具有积极的推进作用[11-12]。笔者研究细胞分裂素生产菌群中的巨大芽孢杆菌和枯草芽孢杆菌混合菌剂对马铃薯光合参数、抗氧化酶活性和土壤微生物数量的影响,旨在为进一步开发生物肥料提供参考依据。
1 材料与方法
1.1 材料
马铃薯品种为‘费乌瑞它’(Favorita)。种薯由云南农业大学植保系东南亚薯类作物研究与控制中心提供。混合菌剂由巨大芽孢杆菌(Bacillus megaterium,BM)和枯草芽孢杆菌(Bacillus subtilis,BS)组成,菌种由中国微生物菌种保藏管理委员会普通微生物中心提供。
1.2 盆栽试验设计与水分控制
土壤盆栽试验用圆柱形塑料花盆(直径、高度分别为40、35 cm,花盆质量0.65 kg)完成。每盆装13 kg风干的稻田土,施入3 kg底肥(2.95 kg有机肥和0.05 kg三元复合肥混匀)。供试土壤pH为 6.52,有机质、全氮、全磷含量分别为48.2、1.95、1.34 g/kg,碱解氮、速效磷、速效钾含量分别为189.5、68.2、485.4 mg/kg,含水量9.59%,饱和含水量64.59%(饱和含水量=土壤持水量/土壤干重)。2015年1月20日在湖南农业大学网室遮雨棚中进行盆栽试验。每盆植入3颗已萌芽且仅留1个顶芽的马铃薯种薯。每盆均匀缓慢地喷入6.15 kg蒸馏水,使土壤含水量达到土壤饱和含水量的80%。马铃薯出苗后仅留1个顶芽。3月2日每盆定量喷入2 kg蒸馏水。3月 20日,选取生长一致的马铃薯,采用随机区组设计。巨大芽孢杆菌菌剂原液浓度为 1.92×108CFU/mL,枯草芽孢杆菌菌剂原液浓度为 1.51×109CFU/mL,按照表1设置处理,每处理6盆,共24盆。平均每盆的植株和土壤质量共为19.62 kg。先每盆定量喷入2 kg蒸馏水。每盆的混合菌液用量为200 mL。菌液均匀地施在3株马铃薯植株的根基部。从3月20日至4月17日每天16:00观察每盆马铃薯的生长情况、称重和测定其土壤含水量。在3月31日和4月17日取样测定生理指标。4月20日发现对照植株有轻微的暂时萎蔫现象,每盆再喷蒸馏水3 kg。在生育期内每盆总施入用水量为13.15 kg。5月22日收获块茎和根际土壤,测定块茎的鲜物质质量和干物质质量。
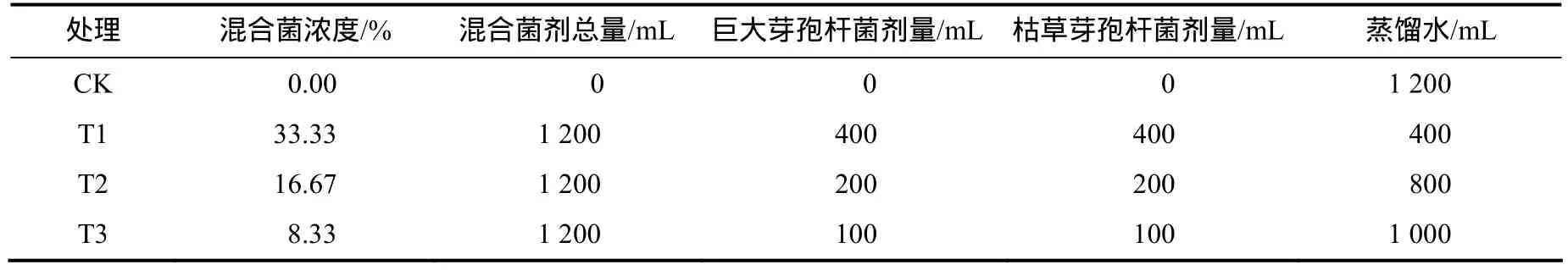
表1 各处理混合菌剂的浓度Table 1 Concentration of mixed bacteria agent at different treatments
1.3 考查项目与方法
1.3.1 微生物的培养和测定
将混合菌剂中的巨大芽孢杆菌和枯草芽孢杆菌用牛肉膏蛋白胨培养基分别培养为菌剂,培养基pH为7.4~7.6,培养温度为37 ℃,培养时间为1 d。用牛肉膏蛋白胨培养基(pH 为 7.4~7.6)培养土壤中细菌,培养温度为37 ℃,培养时间为1 d。用高氏一号培养基(pH为7.2~7.4)培养土壤中的放线菌,培养温度为25~30 ℃,培养时间为7 d。用查氏培养基(自然pH)培养土壤中的真菌,培养温度为25~30℃,培养时间为 3 d。细菌、放线菌和真菌的数量采用平板计数法测定。
1.3.2 净光合速率的测定
[13]中的方法测定净光合速率。选用美国LI-COR公司生产的LI-6400便携式光合作用系统测定马铃薯块茎形成期及膨大期的净光合速率。测定条件:开放式气路;内置红蓝 LED光源的光合有效辐射(PAR)为 1 000 μmol/(m2·s)。3 月 31日和 4月 17日10:00—12:00,选取每个处理长势一致的植株的主茎顶端第一完全展开叶进行测定。
1.3.3 抗氧化物酶活性的测定
采用试剂盒测定法测定块茎形成期及块茎膨大期主茎顶端第一完全展开叶的超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、过氧化氢酶(CAT)活性。
1.3.4 水分利用率的测定
依照文献[14]的方法测定产量水平上的水分利用率。
1.4 数据处理方法
用 Microsoft Excel 2007和SPSS 22.0进行数据统计分析。
2 结果与分析
2.1 马铃薯主要生长期土壤的含水量
由图1可知,在马铃薯主要生长期内(块茎形成期和块茎膨大期),各处理土壤含水量均随处理时间的延长而降低,4种土壤含水量变化均呈现相似规律;T1、T2和T3处理的土壤含水量均高于CK的,其中T3处理的土壤含水量最高。
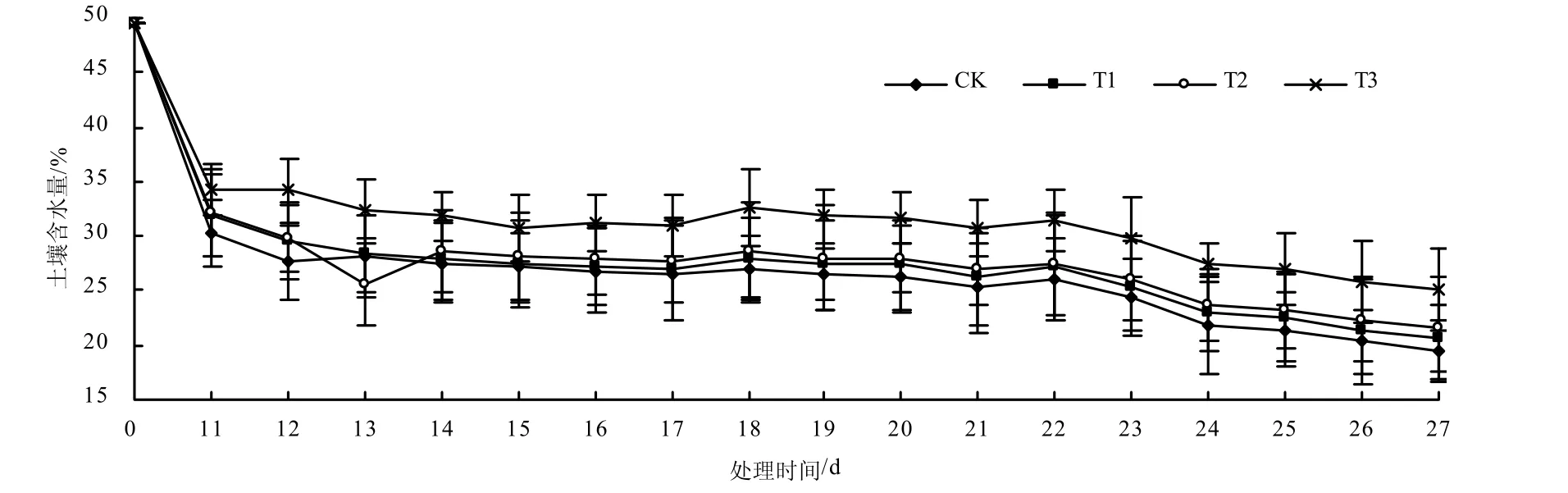
图1 各处理不同处理时间的土壤含水量Fig.1 Change of soil water content with time at different treatments
2.2 叶片净光合速率
由表2可知,块茎形成期T2处理的叶片净光合速率最大,为 25.77 μmol/(m2·s),CK 处理的为18.60 μmol/(m2·s)。T1、T2、T3 的净光合速率均显著高于CK的(P<0.05)。在块茎膨大期,T2处理的叶片净光合速率最大,为 24.77 μmol/(m2·s),CK 处理为 18.37 μmol/(m2·s),T1、T2、T3 处理的叶片净光合速率均显著高于CK的。
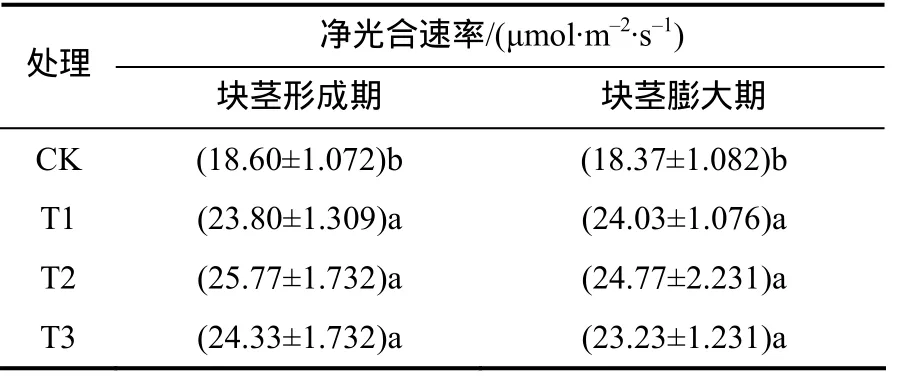
表2 各处理马铃薯叶片的净光合速率Table 2 Leaf net photosynthetic rate at different treatments
2.3 叶片抗氧化酶活性
由表3可见,3个处理块茎形成期和块茎膨大期的超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性和过氧化氢酶(CAT)活性变化具有相似规律,均高于CK。SOD、POD和CAT活性的最大值均出现在T2。T1、T2和T3 的SOD、POD和CAT活性都与CK具有显著性差异,各处理的SOD、POD和CAT活性从大到小依次均为T2、T3和T1。
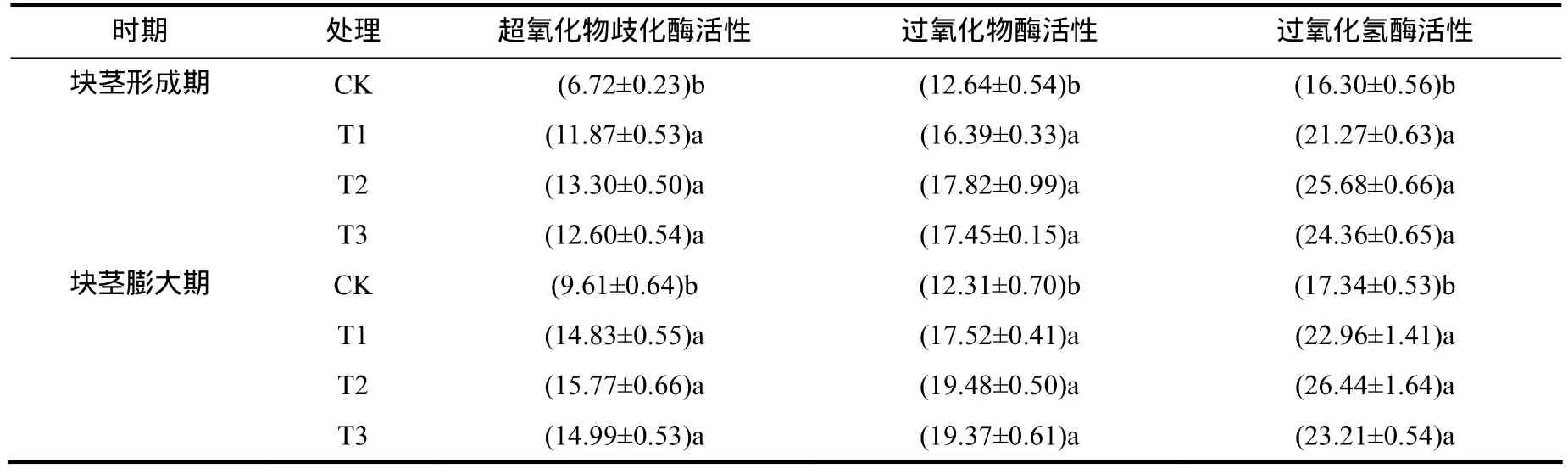
表3 各处理叶片的抗氧化酶活性Table 3 Activities of leaf antioxidase at different treatments μmol/g
2.4 块茎产量和水分利用率
由表 4可见,T2处理的块茎干质量最大,为95.00 g,比CK高21.60 g;T1、T2和T3的块茎质量均高于 CK的,其中,T1、T2、T3的块茎干质量和水分利用率均显著高于CK的;T2和T3的均显著高于T1的,水分利用率由大到小依次为T2、T3和T1。这是因为混合菌剂通过促进马铃薯根系的生长发育和增强其根系合成细胞分裂素的能力,从而增强其根系吸收水分和矿质营养等的活力。
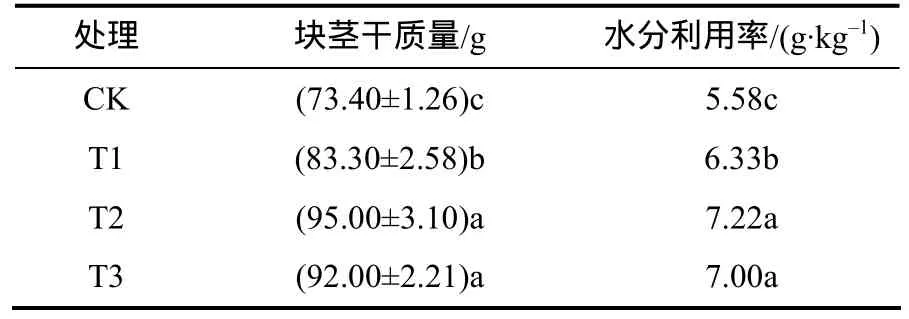
表4 各处理每1盆的块茎产量和水分利用率Table 4 Tuber yie ld an d water use e fficiency of per pot a t different treatments
2.5 土壤微生物含量
由表5可见,T2处理的土壤细菌菌落数最大,为6 370.00 CFU/g,比CK高5743.02 CFU/g;T1、T2、T3的细菌菌落数均显著高于CK的。T2土壤细菌菌落数显著小于T1的,T3显著大于CK的。
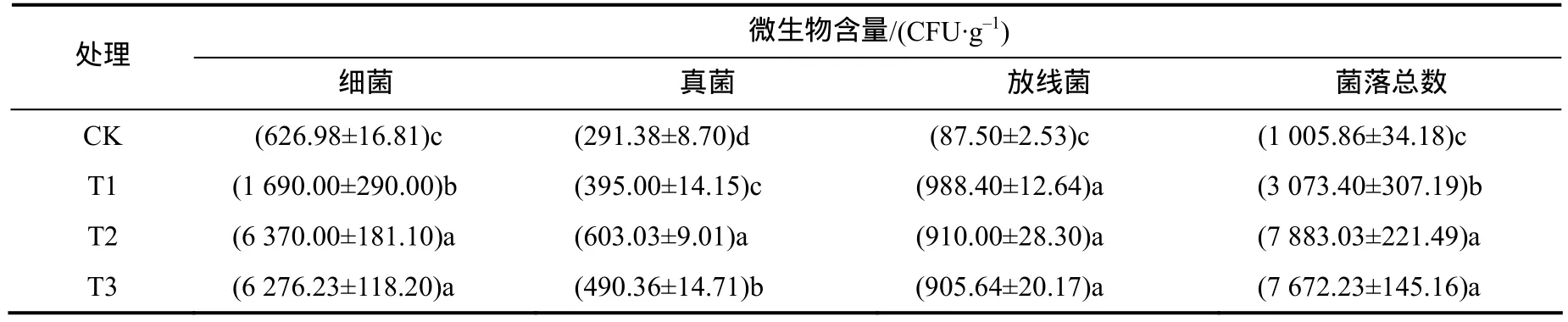
表5 每1 g干土的微生物含量Table 5 Microbial content in one gram of dry soil
T2的真菌菌落数最大,为 603.03 CFU/g,比CK多311.65 CFU/g。真菌菌落数由多到少依次为T2、T3 和 T1。
T1的放线菌菌落数最大,为988.40 CFU/g,比CK多900.90 CFU/g。放线菌菌落数由多到少依次为T1、T2和T3。
3 结论与讨论
土壤矿物与微生物及生物分子间的相互作用,是当今土壤学领域的研究热点。土壤微生物通过分泌各种蛋白质,与黏土矿物形成黏土-蛋白质复合体。混合菌剂的主要成分为巨大芽孢杆菌和枯草芽孢杆菌。巨大芽孢杆菌具有很好的降解土壤中有机磷的功效,是生产生物菌剂的常用菌种[15]。枯草芽孢杆菌的胞外披膜或细胞壁使土壤金属阳离子吸附于枯草芽孢杆菌表面基团的可能性增加,吸附量随细菌浓度的增大而增加[16]。土壤微生物是土壤中最具活力的组分, 主要由土壤细菌、放线菌、真菌、藻类和各种微小的原生动物组成, 其中以细菌的数量最多。本研究结果显示,施用混合菌剂可显著改变土壤细菌、放线菌和真菌的数量,并且对不同微生物种群的影响不同,与对照相比较,施用混合菌剂后细菌数目增加的幅度较大,放线菌和真菌的数目也有增加。这说明施用混合菌剂增加了土壤微生物的数量,从而改善了土壤的微环境。
细胞分裂素类物质是一类广泛应用于果树和蔬菜的植物生长物质,其主要作用是促进细胞扩大,提高坐果率,延缓叶片衰老[17]。本试验中在马铃薯根际土壤施入混合菌剂后,巨大芽孢杆菌和枯草芽孢杆菌在马铃薯根际产生的细胞分裂素促进根系细胞生长,增强根系的呼吸作用,进而增强根系吸收水分、矿质元素和生物合成细胞分裂素的能力,同时通过提高马铃薯叶片生殖生长关键时期的净光合速率来提高马铃薯的块茎产量。在马铃薯块茎形成期和膨大期,块茎的净光合速率随混合菌剂施用量的增加而增加。
在自然衰老和水分胁迫等逆境条件下,植物体内抗氧化酶活性下降,从而导致其抗氧化能力降低[18]。马铃薯属于浅根系旱生作物,因而水分胁迫对块茎产量的影响较大。在适度水分亏缺条件下,混合菌剂可以提高马铃薯叶片抗氧化酶的活性。在块茎形成期和膨大期,马铃薯叶片超氧化物歧化酶、过氧化物酶和过氧化氢酶的活性均随着混合菌剂的施用而提高。
本研究结果表明:混合菌剂增加土壤微生物含量,各处理微生物含量从大到小依次为T2、T3和T1。T2的土壤微生物总量最大,是CK的7倍。土壤微生物含量的增加能有效改善土壤的团粒结构,有利于干旱条件下土壤水分保持。混合菌剂能提高马铃薯净光合速率和块茎产量。各处理净光合速率和块茎产量的最大值均出现在T2,块茎形成期和块茎膨大期T2的净光合速率分别比CK的高38.5%和34.8%,每盆块茎的干质量比CK的高29.4%。混合菌剂能提高马铃薯叶片的抗氧化酶活性和水分利用率。各处理的3种抗氧化酶活性均显著高于对照的。T2的水分利用率最大,比CK的高29.4%。
参考文献:
[1] 席北斗,刘鸿亮,黄国和,等.复合微生物菌剂强化堆肥技术研究[J].环境污染与防治,2003,25(5):262-264.
[2] 张淼,叶长城,喻理,等.矿物硅肥与微生物菌剂对水稻吸收积累镉的影响[J].农业环境科学学报,2016,35(4):627-633.
[3] 吕军,文庭池,郭坤亮,等.酒糟生物有机肥和微生物菌剂对土壤微生物数量及高粱产量的影响[J].农业现代化研究,2013(4):26.
[4] 千淋兆,龚明波,顾金刚,等.溶磷微生物菌剂对土壤营养元素及玉米生长的影响[J].农业资源与环境学报,2014,31(5):425-431.
[5] 张丽荣,陈杭,康萍芝,等.不同微生物菌剂对番茄产量及土壤微生物数量的影响[J].湖北农业科学,2013,52(22):5452-5454.
[6] 陈丽华,周立辉,雒晓芳,等.微生物菌剂与冰草联合修复含油污染土壤[J].中南大学学报(自然科学版),2015,46(11):4377-4383.
[7] 钱海燕,杨滨娟,黄国勤,等.秸秆还田配施化肥及微生物菌剂对水田土壤酶活性和微生物数量的影响[J].生态环境学报,2012,21(3):440-445.
[8] 雷先德,李金文,徐秀玲,等.微生物菌剂对菠菜生长特性及土壤微生物多样性的影响[J].中国生态农业学报,2012,20(4):488-494.
[9] 杜雷,葛米红,张利红,等.微生物菌剂对快生菜品质和产量的影响[J].安徽农业科学,2013,41(12):5259-5259.
[10] 余贤美,侯长明,王海荣,等.枯草芽孢杆菌 Bs-15 在枣树体内和土壤中的定殖及其对土壤微生物多样性的影响[J].中国生物防治学报,2014,30(4):497-502.
[11] 潘澈,刘柯驿,兰时乐,等.细胞分裂素生产菌提高马铃薯抗旱性的生理生化特性研究[J].湖南农业大学学报(自然科学版),2012(5):501-505.
[12] 刘柯驿,潘澈,彭静,等.细胞分裂素生产菌对马铃薯早期生长生理的影响[J].湖南农业科学,2012 (1):12-14.
[13] WANG H Q,XIAO L T.Effects of chlorocholine chloride on phytohormones and photosynthetic characteristics in potato [J].Journal of Plant Growth Regulation,2009,28(1):21-27.
[14] WANG H Q,LIU F L,ANDERSEN M N,et a1.Comparative effects of partial root-zone drying anddeficit irrigation on nitrogen uptake in potatoes(Solanum tuberosum L.)[J]. Irrigation Science,2009,27:443-448.
[15] 郑传进,黄林,龚明.巨大芽孢杆菌解磷能力的研究[J].江西农业大学学报,2002,24(2):190-192.
[16] 荣兴民,黄巧云,陈雯莉,等.土壤矿物与微生物相互作用的机理及其环境效应[J].生态学报,2008,28(1):376-387.
[17] 王冬梅,黄学林.细胞分裂素类物质在植物组织培养中的作用机制[J].植物生理学通讯,1996,32(5):373-377.
[18] 宿飞飞,陈伊里,徐会连,等.分根交替干旱对马铃薯光合作用及抗氧化保护酶活性的影响[J].作物杂志,2014(4):115-119.
责任编辑:王赛群
英文编辑:王 库
Effects of Bacillus megaterium and Bacillus subtilis on growth physiology of Solanum tuberosum L. and microbial biomass in rhizosphere soil
XING Jiayun, LAN Shile, LI Jiao, WANG Huiqun*
(College of Bioscience and Biotechnology, Hunan Agricultural University, Changsha 410128, China)
In order to research the effects of different concentration of Bacillus megaterium and Bacillus subtilis on physiological characteristics and microbial biomass in rhizosphere soil of potato, random blocks designed pot experiments were conducted by adopted favorita, a kind of potato, as testing material. Experiments respectively treated with 33.33% (T1), 16.67% (T2) and 8.33% (T3) of bacteria agent, and control group (CK, distilled water) were designed.The results showed that treatment of T1, T2 and T3 could improve leaf net photosynthetic rate, activity of superoxide dismutase, peroxidase and catalase in tuber formation stage and tuber expansion stage, as well as in improving tuber yield,water use efficiency, bacteria biomass, fungi and actinomycetes in rhizosphere at harvest stage. The net photosynthesis rate in treatment of T2 were 7.17 μmol/(m2·s) and 6.40 μmol/(m2·s) in tuber formation stage and tuber expansion stage,respectively, higher than that of CK. The tuber dry weight, the water use efficiency and the microbial biomass in rhizosphere soil of T2 was 18.6 g/pot, 1.64 g/kg and 6 877.17 CFU/g, respectively, all higher than that of CK.
Bacillus megaterium; Bacillus subtilis; ‘favorita’ Solanum tuberosum L.; growth physiology; soil microbe
Q946.84+1
A
1007-1032(2017)04-0377-05
2016-05-17
2017-06-06
湖南省教育厅项目(14K044)
邢嘉韵(1991—),女,湖南长沙人,硕士研究生,主要从事植物生理生化研究,serfui@126.com;*通信作者,王惠群,博士,教授,主要从事植物生理生化研究,wanghuiqun751@163.com
