西洛他唑联合前列地尔治疗下肢动脉硬化闭塞症的临床观察
2017-07-18周志向周家春海南省第二人民医院内科海南五指山5799海南省第二人民医院外科海南五指山5799
周志向,陈 圆,周家春,黄 田(.海南省第二人民医院内科,海南五指山 5799;.海南省第二人民医院外科,海南五指山 5799)
西洛他唑联合前列地尔治疗下肢动脉硬化闭塞症的临床观察
周志向1*,陈 圆1,周家春1,黄 田2(1.海南省第二人民医院内科,海南五指山 572299;2.海南省第二人民医院外科,海南五指山 572299)
目的:探讨西洛他唑联合前列地尔治疗下肢动脉硬化闭塞症(PAD)的临床疗效及安全性。方法:选择我院2015年1月-2016年1月收治的PAD患者68例,按照随机数字表法分为对照组和观察组,各34例。对照组患者给予基础治疗,并予前列地尔注射液2 mL+0.9%氯化钠注射液100 mL,ivgtt,qd;观察组患者在对照组基础上给予西洛他唑片100 mg,po,bid。两组患者均治疗30 d。观察两组患者临床疗效,检测治疗前后血液流变学指标(血细胞比容、全血高切黏度、红细胞聚集指数、红细胞变形指数和血浆黏度)、炎症因子[肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)、IL-8和超敏C反应蛋白(hs-CRP)]、氧化应激指标[谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)、总抗氧化能力(T-Aoc)和丙二醛(MDA)]、动脉硬化指标[踝肱指数(ABI)、趾臂指数(TBI)和足背动脉血流量],并记录不良反应发生情况。结果:观察组患者总有效率(91.18%)明显高于对照组(79.41%),差异有统计学意义(P<0.05)。治疗前,两组患者血液流变学指标、炎症因子、氧化应激指标和动脉硬化指标水平比较,差异均无统计学意义(P>0.05);治疗后,两组患者血细胞比容、全血高切黏度、红细胞聚集指数、红细胞变形指数、血浆黏度、TNF-α、IL-6、IL-8、hs-CRP和MDA水平均明显降低,GSH-Px、SOD、T-Aoc、ABI、TBI和足背动脉血流量水平均明显升高,且观察组上述指标改善程度均明显优于对照组,差异均有统计学意义(P<0.05)。观察组不良反应发生率(14.71%)与对照组(11.76%)比较,差异无统计学意义(P>0.05)。结论:西洛他唑联合前列地尔治疗PAD疗效确切,可有效改善患者血液流变学、炎症因子、氧化应激及动脉硬化指标,且安全性较高。
西洛他唑;前列地尔;下肢动脉硬化闭塞症;血液流变学;炎症因子;氧化应激;动脉硬化
下肢动脉硬化闭塞症(PAD)是由于下肢动脉粥样硬化斑块形成而引起下肢动脉狭窄、闭塞,进而导致肢体慢性缺血,出现间歇性跛行、麻木和疼痛等症状,严重的时候还可形成坏疽和溃疡,最终导致截肢[1]。相关临床统计显示,PAD的发病率约为4%,且随年龄增长呈现升高的趋势,65岁以上人群的发病率达10%,75岁以上人群则高达20%[2]。目前,PAD的临床治疗主要为延缓疾病进展和改善下肢缺血症状,主要的治疗药物为抗凝和溶栓药物[3]。西洛他唑具有抗血小板聚集和血管扩张等作用,临床主要用于治疗由动脉粥样硬化和糖尿病等导致的慢性动脉闭塞症[4]。前列地尔能够有效抑制血小板聚集,对闭塞性动脉硬化、心肌梗死和血栓性脉管炎等疾病均具有较好的治疗作用[5-6]。但是,西洛他唑联用前列地尔治疗PAD的研究并不多见,该方案对患者血流动力学、氧化应激、炎症指标的影响更鲜有报道。鉴于此,本研究探讨了西洛他唑联合前列地尔治疗PAD的临床疗效和安全性,现报道如下。
1 资料与方法
1.1 纳入与排除标准
纳入标准:(1)符合《下肢动脉硬化性闭塞症治疗指南》中PAD的诊断标准[7];(2)年龄为40~70岁。
排除标准:(1)合并严重的心脏病、精神病、肝肾损伤和晚期癌症患者;(2)合并急性动脉栓塞、血栓闭塞性脉管炎、严重感染和抗凝溶栓禁忌证的患者;(3)对本研究使用药物过敏者。
1.2 研究对象
选择我院2015年1月-2016年1月收治的PAD患者68例为研究对象,按照随机数字表法分为对照组和观察组,各34例。其中,对照组患者男性23例、女性11例;平均年龄(55.0±3.8)岁;平均体质量指数(BMI)(21.4± 1.9)kg/m2;下肢病变部位为单侧13例、双侧21例;Fortain分期为Ⅰ期9例、Ⅱ期16例、Ⅲ期9例。观察组患者男性22例、女性12例;平均年龄(55.5±4.1)岁;平均BMI(21.0±1.7)kg/m2;下肢病变部位为单侧14例、双侧20例;Fortain分期为Ⅰ期10例、Ⅱ期15例、Ⅲ期9例。两组患者的性别、年龄、BMI、下肢病变部位和Fortain分期等一般资料比较,差异均无统计学意义(P>0.05),具有可比性。本研究方案经医院医学伦理委员会审核通过,患者均知情同意并签署知情同意书。
1.3 治疗方法
两组患者均给予控制血糖、血压和降脂等基础治疗。对照组患者给予前列地尔注射液(北京泰德制药股份有限公司,批准文号:国药准字H10980023,规格:1 mL∶5 μg)2 mL+0.9%氯化钠注射液100 mL,ivgtt,qd;观察组患者在对照组基础上给予西洛他唑片(浙江大冢制药有限公司,批准文号:国药准字H10960014,规格:50 mg)100 mg,po,bid。两组患者均治疗30 d。
1.4 观察指标与疗效评价标准
(1)观察两组患者临床疗效。根据《心血管系统药物临床研究指导原则》[8]对临床疗效进行评价,按疼痛感、下肢冷感、下肢麻感和间歇性跛行4项对患者治疗前后的疗效进行评分。疗效评分降低≥80%为显效,降低50%~<80%为有效,降低<50%为无效。总有效=显效+有效。(2)检测两组患者治疗前后血细胞比容、全血高切黏度、红细胞聚集指数、红细胞变形指数和血浆黏度等血液流变学指标水平。采用MVIS-90型全自动血流变分析仪(深圳博士医疗设备公司)进行操作。(3)检测两组患者治疗前后炎症因子水平。采用酶联免疫吸附测定(ELISA)法检测肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)和IL-8水平,采用超敏乳胶增强免疫比浊法检测超敏C反应蛋白(hs-CRP)水平,试剂盒均购自美国Sigma公司,严格按照其说明书方法操作。(4)检测两组患者治疗前后氧化应激指标水平。采用ELISA法检测谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)、总抗氧化能力(T-Aoc)和丙二醛(MDA)水平,试剂盒均购自美国Sigma公司,严格按照其说明书方法操作。(5)检测两组患者治疗前后动脉硬化指标水平。采用血管超声和动脉硬化检测仪测量踝肱指数(ABI)、趾臂指数(TBI)和足背动脉血流量。(6)记录两组患者治疗过程中不良反应发生情况。
1.5 统计学方法
采用SPSS 19.0软件对数据进行统计分析。计量资料以s表示,采用t检验;计数资料以例数或率表示,采用χ2检验;等级资料采用秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者临床疗效比较
观察组患者总有效率(91.18%)明显高于对照组(79.41%),差异有统计学意义(P<0.05),详见表1。

表1 两组患者临床疗效比较[n=34,例(%%)]Tab 1 Comparison of clinical efficacies of patients between 2 groups[n=34,case(%%)]
2.2 两组患者治疗前后血液流变学指标水平比较
治疗前,两组患者血细胞比容、全血高切黏度、红细胞聚集指数、红细胞变形指数和血浆黏度等血液流变学指标水平比较,差异均无统计学意义(P>0.05)。治疗后,两组患者上述血液流变学指标水平均明显降低,且观察组指标明显低于对照组,差异均有统计学意义(P<0.05),详见表2。
表2 两组患者治疗前后血液流变学指标水平比较(s,n=34)Tab 2 Comparison of hemorheology indexes levels between 2 groups before and after treatment(s,n=34)
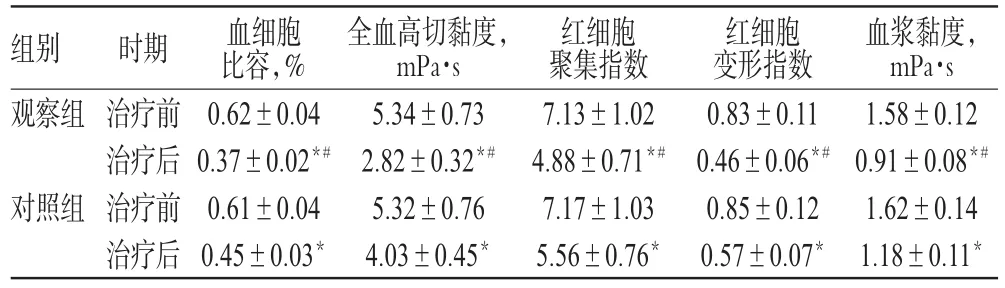
表2 两组患者治疗前后血液流变学指标水平比较(s,n=34)Tab 2 Comparison of hemorheology indexes levels between 2 groups before and after treatment(s,n=34)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05Note:vs.before treatment,*P<0.05;vs.control group,#P<0.05
血浆黏度,mPa·s 1.58±0.12 0.91±0.08*#1.62±0.14 1.18±0.11*组别观察组对照组时期治疗前治疗后治疗前治疗后血细胞比容,% 0.62±0.04 0.37±0.02*#0.61±0.04 0.45±0.03*全血高切黏度,mPa·s 5.34±0.73 2.82±0.32*#5.32±0.76 4.03±0.45*红细胞聚集指数7.13±1.02 4.88±0.71*#7.17±1.03 5.56±0.76*红细胞变形指数0.83±0.11 0.46±0.06*#0.85±0.12 0.57±0.07*
2.3 两组患者治疗前后炎症因子水平比较
治疗前,两组患者TNF-α、IL-6、IL-8和hs-CRP等炎症因子水平比较,差异均无统计学意义(P>0.05)。治疗后,两组患者上述炎症因子水平均明显降低,且观察组指标明显低于对照组,差异均有统计学意义(P<0.05),详见表3。
2.4 两组患者治疗前后氧化应激指标水平比较
治疗前,两组患者GSH-Px、SOD、T-Aoc和MDA等氧化应激指标水平比较,差异均无统计学意义(P>0.05)。治疗后,两组患者GSH-Px、SOD和T-Aoc水平均明显升高,MDA水平明显降低,且观察组患者上述指标改善程度明显优于对照组,差异均有统计学意义(P<0.05),详见表4。
2.5 两组患者治疗前后动脉硬化指标水平比较
表3 两组患者治疗前后炎症因子水平比较(s,n=34)Tab 3 Comparison of inflammatory factors levels between 2 groups before and after treatment(s,n=34)
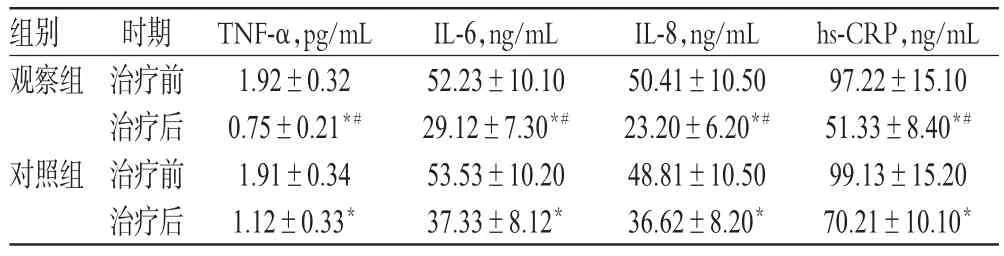
表3 两组患者治疗前后炎症因子水平比较(s,n=34)Tab 3 Comparison of inflammatory factors levels between 2 groups before and after treatment(s,n=34)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05Note:vs.before treatment,*P<0.05;vs.control group,#P<0.05
hs-CRP,ng/mL 97.22±15.10 51.33±8.40*#99.13±15.20 70.21±10.10*组别观察组对照组时期治疗前治疗后治疗前治疗后TNF-α,pg/mL 1.92±0.32 0.75±0.21*#1.91±0.34 1.12±0.33*IL-6,ng/mL 52.23±10.10 29.12±7.30*#53.53±10.20 37.33±8.12*IL-8,ng/mL 50.41±10.50 23.20±6.20*#48.81±10.50 36.62±8.20*
表4 两组患者治疗前后氧化应激指标水平比较(s,n=34)Tab 4 Comparison of oxidation stress indexes levels between 2 groups before and after treatment(s,n=34)
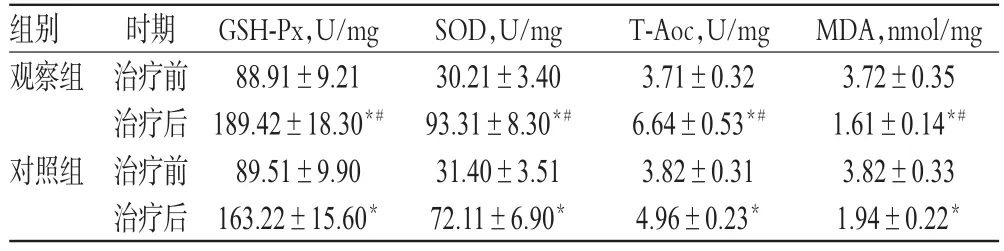
表4 两组患者治疗前后氧化应激指标水平比较(s,n=34)Tab 4 Comparison of oxidation stress indexes levels between 2 groups before and after treatment(s,n=34)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05Note:vs.before treatment,*P<0.05;vs.control group,#P<0.05
MDA,nmol/mg 3.72±0.35 1.61±0.14*#3.82±0.33 1.94±0.22*组别观察组对照组时期治疗前治疗后治疗前治疗后GSH-Px,U/mg 88.91±9.21 189.42±18.30*#89.51±9.90 163.22±15.60*SOD,U/mg 30.21±3.40 93.31±8.30*#31.40±3.51 72.11±6.90*T-Aoc,U/mg 3.71±0.32 6.64±0.53*#3.82±0.31 4.96±0.23*
治疗前,两组患者ABI、TBI和足背动脉血流量等动脉硬化指标水平比较,差异均无统计学意义(P>0.05)。治疗后,两组患者上述动脉硬化指标水平均明显升高,且观察组患者明显高于对照组,差异均有统计学意义(P<0.05),详见表5。
表5 两组患者治疗前后动脉硬化指标水平比较(s,n=34)Tab 5 Comparison of arteriosclerosis indexes levels between 2 groups before and after treatment(s,n=34)
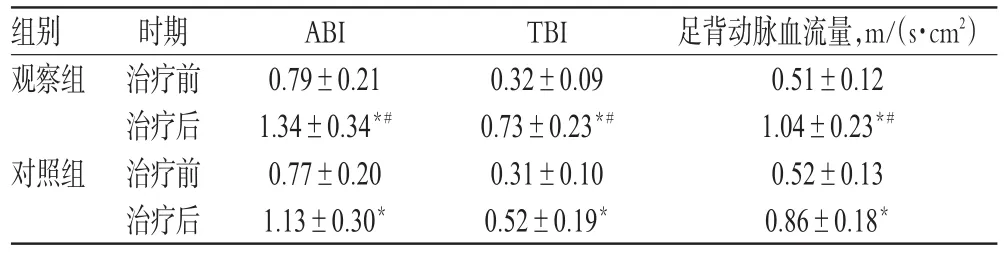
表5 两组患者治疗前后动脉硬化指标水平比较(s,n=34)Tab 5 Comparison of arteriosclerosis indexes levels between 2 groups before and after treatment(s,n=34)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05Note:vs.before treatment,*P<0.05;vs.control group,#P<0.05
足背动脉血流量,m/(s·cm2)0.51±0.12 1.04±0.23*#0.52±0.13 0.86±0.18*组别观察组对照组时期治疗前治疗后治疗前治疗后ABI 0.79±0.21 1.34±0.34*#0.77±0.20 1.13±0.30*TBI 0.32±0.09 0.73±0.23*#0.31±0.10 0.52±0.19*
2.6 不良反应
两组患者治疗过程中的不良反应均为恶心、腹泻、呕吐、转氨酶升高、头晕和头痛等,均未进行特殊处理,后自行缓解。观察组患者不良反应发生率(14.71%,5/34)与对照组(11.76%,4/34)比较,差异无统计学意义(P>0.05)。
3 讨论
PAD是一种较常见的四肢血管疾病,临床进展迅速,可造成肢体远端缺血性溃疡或坏死、重度缺血性静息痛和间歇性踱行等[9-10]。西洛他唑可抑制血管平滑肌内磷酸二酯酶和血小板活性,提高平滑肌和血小板内环磷酸腺苷浓度,发挥抗血小板及血管扩张等作用[11]。前列地尔具有抑制血栓素A2生成、抑制动脉粥样脂质斑块形成、抗血小板聚集和抑制免疫复合物形成等作用,并可有效扩张外周和冠脉血管[12]。本研究采用西洛他唑联合前列地尔治疗PAD,其治疗总有效率明显高于单用前列地尔的患者,提示加用西洛他唑可一定程度提高对PAD的疗效。
近年来,多项基因调控与信号传导水平的研究表明,氧化应激紊乱与炎症是PAD等动脉粥样硬化疾病发生的关键因素,同时也是动脉粥样硬化由脂肪条纹形成阶段发展至血栓形成和斑块破裂阶段的重要因素[13-14]。氧化应激紊乱可促进机体血管平滑肌细胞和血管内皮细胞凋亡,同时由其修饰的低密度脂蛋白可大量氧化为氧化型低密度脂蛋白,不仅促进血管内皮的损伤,还诱导内皮细胞表达大量炎症因子[15-16]。炎症因子含量的异常则可放大并加重动脉局部炎症过程,并在斑块水平上直接介导血管组织的损伤[17]。同时,机体大量自由基的产生和氧化应激信号的激活,在引起血管损伤的同时,还可造成低密度脂蛋白积聚于动脉内膜,最终导致血液流变学指标异常[18]。可见,检测PAD患者血液流变学指标、炎症因子、氧化应激指标对评价其疾病进展与疗效具有重要意义。本研究结果显示,两组患者上述指标以及ABI、TBI和足背动脉血流量等动脉硬化相关指标水平在治疗后均出现明显改善,且观察组患者改善程度均明显优于对照组,提示西洛他唑的联用不仅可有效促进患者血液循环,还可更有效缓解患者炎症和氧化应激紊乱。分析其主要机制可能为西洛他唑通过增加血管平滑肌细胞和血小板内环磷酸腺苷的含量来抑制血小板活性,从而在扩张外周血管的同时抑制血管平滑肌细胞的增殖[19];此外,西洛他唑还可降低TNF-α和基质金属蛋白酶等炎症因子表达,在抑制血栓形成的同时改善机体炎症情况[20]。
综上所述,西洛他唑联合前列地尔治疗PAD疗效确切,可有效改善患者血液流变学、炎症因子、氧化应激指标及动脉硬化指标,且安全性较高。然而本研究样本量较小,且未对患者进行长期的跟踪随访,故结果仍需大样本、高质量的随机对照研究加以证实。
[1] Gray C,Goodman P,Cullen P,et al.Screening for peripheral arterial disease and carotid artery disease in patients with abdominal aortic aneurysm[J].Angiology,2016,67(4):346-349.
[2] 陈蓉,张晶.2种用药方案治疗下肢动脉硬化性闭塞症的成本-效果分析[J].中国药房,2010,21(2):104-106.
[3] 张玉传,李宗清,王东.周围动脉疾病的诊治进展[J].滨州医学院学报,2010,33(1):41-44.
[4] Ishii H,Aoyama T,Takahashi H,et al.Treatment with cilostazol improves clinical outcome after endovascular therapy in hemodialysis patients with peripheral artery disease[J].J Cardiol,2016,67(2):199-204.
[5] Kara H,Ozer A,Arpaci H,et al.Effect of alprostadil on erythrocyte deformability in ischemia reperfusion injury [J].Bratisl Lek Listy,2015,116(8):509-511.
[6] 陈瑗,周玫.氧化应激-炎症在动脉粥样硬化发生发展中作用研究的新进展[J].中国动脉硬化杂志,2008,16(10):757-762.
[7] 中华医学会外科学分会血管外科学组.下肢动脉硬化性闭塞症治疗指南[J].中国实用外科杂志,2008,28(11):923-924.
[8] 卫生部心血管系统药物临床药理基地.心血管系统药物临床研究指导原则[J].中国临床药理学杂志,1988,4(4):245-254.
[9] O’Neill WC,Han KH,Schneider TM,et al.Prevalence of nonatheromatous lesions in peripheral arterial disease[J]. Arterioscler Thromb Vasc Biol,2015,35(2):439-447.
[10] Li Q,Zeng H,Liu F,et al.High ankle-Brachial index indicates cardiovascular and peripheral arterial disease in patients with type 2 diabetes[J].Angiology,2015,66(10):918-924.
[11] Kim YR,Kim HN,Hong KW,et al.Anti-depressant effects of phosphodiesterase 3 inhibitor cilostazol in chronic mild stress-treated mice after ischemic stroke[J].Psychopharmacology:Berl,2016,233(6):1055-1066.
[12] Meier-Davis SR,Debar S,Siddoway J,et al.Daily application of alprostadil topical cream(Vitaros)does not impact vaginal pH,flora,or histology in female cynomolgus monkeys[J].Int J Toxicol,2015,34(1):11-15.
[13] Shishehbor MH,HazenSL.Inflammatory and oxidative markers in atherosclerosis:relationship to outcome[J]. Curr Atheroscler Rep,2004,6(3):243-250.
[14] Stocker R,Keaney JF Jr.Role of oxidative modifications in atherosclerosis[J].Phsiol Rev,2004,84(4):1381-1478.
[15] Roberts R.Genetics of coronary artery disease[J].Circ Res,2014,114(12):1890-1903.
[16] Mullenix PS,Andersen CA,Starnes BW.Atheroclerosis as inflammation[J].Ann Vase Surg,2005,19(1):130-138.
[17] 张杨,张望德,李谈,等.下肢动脉硬化闭塞症血管壁炎性因子的表达[J].中华实验外科杂志,2012,29(11):2153-2155.
[18] Sanada F,Kanbara Y,Taniyama Y,et al.Induction of angiogenesis by a typeⅢphosphodiesterase inhibitor,cilostazol,through activation of peroxisome proliferator-activated receptor-γ and cAMP pathways in vascular cells[J]. Arterioscler Thromb Vasc Biol,2016,36(3):545-552.
[19] Takagi T,Hara H.Protective effects of cilostazol against hemorrhagic stroke:current and future perspectives[J].J Pharmacol Sci,2016,131(3):155-161.
[20] Nanto K,Iida O,Takahara M,et al.Effect of cilostazol following endovascular intervention for peripheral artery disease[J].Angiology,2015,66(8):774-778.
(编辑:陶婷婷)
Clinical Observation of Cilostazol Combined with Alprostadil in the Treatment of Peripheral Arterial Disease
ZHOU Zhixiang1,CHEN Yuan1,ZHOU Jiachun1,HUANG Tian2(1.Dept.of Internal Medicine,Hainan Second People’s Hospital,Hainan Wuzhishan 572299,China;2.Dept.of Surgery,Hainan Second People’s Hospital,Hainan Wuzhishan 572299,China)
OBJECTIVE:To investigate the clinical efficacy and safety of cilostazol combined with alprostadil in the treatment of peripheral arterial disease(PAD).METHODS:A total of 68 PAD patients in our hospital from Jan.2015 to Jan.2016 were divided into observation group(34 cases)and control group(34 cases)according to random number table.Control group was given basical treatment,and Alprostadil injection 2 mL+0.9%Sodium chloride injection 100 mL,ivgtt,qd.Observation group was additionally given Cilostazol tablets 100 mg,po,bid,on the basis of control group.Both groups were treated for 30 days.Clinical efficacies of 2 groups were observed.The hemorheology indexes(hematocrit,whole blood high-shearing viscosity,erythrocyte aggre-gation index,erythrocyte deformation index,plasma viscosity),inflammatory factor indexes(TNF-α,IL-6,IL-8,hs-CRP),oxidation stress indexes(GSH-Px,SOD,T-Aoc,MDA),arteriosclerosis indexes(ABI,TBI,dorsalis pedis artery blood flow)were determined before and after treatment.The occurrence of ADR was recorded.RESULTS:Total response rate of observation group(91.18%)was significantly higher than that of control group(79.41%),with statistical significance(P<0.05).Before treatment,there was no statistical significance in hemorheology indexes,inflammatory factors indexes,oxidant stress indexes or arteriosclerosis indexes between 2 groups(P>0.05).After treatment,hematocrit,whole blood high-shearing viscosity,erythrocyte aggregation index,erythrocyte deformation index,plasma viscosity,the levels of TNF-α,IL-6,IL-8,hs-CRP and MDA in 2 groups were decreased significantly;while the levels of GSH-Px,SOD,T-Aoc,ABI,TBI and dorsalis pedis artery blood flow were increased significantly;the improvement of above indexes in observation group was significantly better than control group,with statistical significance(P<0.05).There was no statistical significance in the incidence of ADR between observation group(14.71%)and control group(11.76%)(P>0.05).CONCLUSIONS:For PAD,cilostazol combined with alprostadil can effectively improve hemorheology indexes,inflammatory factor indexes,oxidation stress indexes and arteriosclerosis indexes with good safety.
Cilostazol;Alprostadil;Peripheral arterial disease;Hemorheologys;Inflammatory factor;Oxidation stress;Arteriosclerosis
R972+.6;R543.3
A
1001-0408(2017)17-2402-04
2016-08-22
2016-12-06)
*副主任医师。研究方向:内科疾病的诊治。电话:0898-31870036。E-mail:1511087481@qq.com
DOI10.6039/j.issn.1001-0408.2017.17.27
