血管紧张素转化酶基因多态性与妊娠糖尿病的关系
2017-07-18林玉玲
林玉玲
(河南省南阳市中心医院 内分泌科,河南 南阳 473000)
血管紧张素转化酶基因多态性与妊娠糖尿病的关系
林玉玲
(河南省南阳市中心医院 内分泌科,河南 南阳 473000)
目的 探讨血管紧张素转化酶基因多态性与妊娠糖尿病(GDM)及妊娠结局的关系。方法采用聚合酶链反应-限制性片段长度多态性(PCR-RFLP)技术对136例GDM孕妇(GDM组),118例糖耐量异常孕妇(GIGT组)及106例糖耐量正常孕妇(GNGT组)血管紧张素转化酶插入(I)/缺失(D)多态性位点进行分析,随访分析血管紧张素转化酶(ACE)(I/D)基因单核苷酸多态性与相应妊娠结局的关系。结果GDM组DD型频率及D等位基因频率高于GNGT组,而I I型低于GNGT组(P<0.05)。GDM组中ID、DD基因型FPG、Fins、ACE及HOMA-IR均高于I I型(P<0.05)。GDM组ID、DD型妊娠结局中胎膜早破、早产儿、新生儿呼吸窘迫综合征、新生儿低血糖及新生儿高胆红素血症例数均高于II型(P<0.05)。DD基因型,D等位基因频率为GDM的危险因素。DD基因型为妊娠不良结局的危险因素。结论ACE(I/D)基因单核苷酸DD型是GDM和妊娠不良结局的独立危险因素。
妊娠糖尿病;妊娠结局;血管紧张素转化酶;基因多态性
妊娠期糖尿病(gestational diabetes mellitus,GDM)是指妊娠期孕妇首次发生不同程度的糖代谢异常,严重危及母儿健康,与多种不良妊娠结局有关,如妊娠高血压巨大儿、早产儿及新生儿低血糖等密切相关[1]。血管紧张素转化酶(angiotensin converting enzyme,ACE)与妊娠期高血压,以及不良妊娠结局密切相关[2]。ACE基因的第16内含子中含有1个287 bp的DNA片段存在插入(Insertion,I)或缺失(Deletion,D)多态性[3]。已经有报道证实[4],ACE(I/D)多态性与2型糖尿病、糖尿病肾病密切相关,同时与GDM妊娠中晚期血脂水平有一定关系。本研究旨在探讨ACE(I/D)多态性与GDM,以及不良妊娠结局的关系,以期为早期预防GDM及不良妊娠结局的发生提供依据。
1 资料与方法
1.1 研究对象
选取2014年4月-2015年6月在河南省南阳市中心医院接受常规产前检查的孕24~28周妊娠妇女,行 50 g糖筛查(glucose screening,GCT),1 h血糖在≥7.8mmol/L行100g糖耐量试验(oral glucose tolerance test,OGTT),检测空腹血糖(fasting blood glucose,FPG)、1、2 及 3 h 血糖(blood glucose,PG)含量,参照乐杰主编的《妇产科学》(第7版)和2011年ADA有关于GDM的诊断标准:①FPG≥5.3 mmol/L;②1 h PG≥10.0 mmol/L;③2 h PG≥8.6 mmol/L;④3 h PG≥7.8 mmol/L,当满足≥2项者则诊断为GDM,不满足要求者则为非GDM孕妇。其中,诊断为GDM患者136例(GDM组)。年龄25~38岁,平均(27.69±4.02)岁;分娩孕周 39~42 周,平均(38.87±2.21)周。妊娠期糖耐量异常(gestational impaired glucose tolerance,GIGT)患者118例(GIGT组)。年龄26~37岁,平均(26.83±3.61)岁;分娩孕周 39~43周,平均(39.01±1.95)周。糖耐量正常孕妇组(gestational non glucose tolerance,GNGT)患者106例(GNGT组)。年龄25~38岁,平均(27.96±3.99)岁;分娩孕周 39~43周,平均(39.39±2.07)周。所有受试对象均已经排除其他妊娠合并症以及心、脑、肝、肾及肺等慢性病史患者,签订知情同意书。所有研究对象行常规产检至到分娩,由专人随访记录相应妊娠结局。
1.2 方法
1.2.1 一般临床资料及生化指标收集 由产科医师详细询问并记录受试对象的年龄、身高、体重、血压及体重指数(body mass index,BMI)等。产检时抽取外周静脉血,测定生化指标,主要有总胆固醇(total cholesterol,TC)及三酰甘油(triglyceride,TG)(氧化酶法)、FPG(日本日立株式会社日立76002全自动生化指标分析仪),空腹胰岛素(fasting insulin,Fins)、稳态胰岛素评价指数(homeostasis model assessment-insulin resistance index,HOMA-IR)及稳态 β细胞功能评价指数(homeostasis model assessment-β cell function,HOMA-IR),血管紧张素转化酶(比色法)。
1.2.2 脱氧核糖核酸(deoxyribonucleic acid,DNA)提取 取血样标本2 ml,采用基因组DNA快速提纯试剂盒(美国Promega生物试剂公司)提取DNA,紫外分光光度计检测DNA的浓度和纯度,纯度要求A260/A280≥1.8,置入-40℃冰箱冷冻保存备用。
1.2.3 引物合成 按照相关文献设计引物,由上海英骏生物科技工程有限公司合成。采用Light Scanner Primer Design软件设计ACE(I/D)基因相应位点引物,均采用小片段扩增引物。聚合酶链反应(polymerase chain reaction,PCR)正向引物:5'-CTGAGCA TGCGTAACTACGCTCGTGCATACGGTC-3';反向引物:5'-TCGTACTAAACGCAGCACCGATCA-3'。
1.2.4 目的基因扩增 PCR扩增体系为25 L,其中含有5μl PCR Mix,2u taq酶,正、反向引物各0.5μl,1μl LC Green和1μl DNA模板,剩余加入双蒸水。ACE(I/D)基因的扩增反应条件为:95℃预变性2 min,95℃变性 30 s,56℃退火 30 s,72℃延伸 45 s,94℃变性30 s,30℃退火30 s,共40个循环,完成后采用73℃延伸5 min,限制性内切酶为BshFI。取PCR产物10 μl,在含有2%琼脂糖凝胶上电泳,溴化乙锭染色,紫外线透射仪观察PCR扩增是否成功,鉴定其特异性。电泳中仅见490bp片段为II型(野生型),仅见190bp为DD型(纯合型)。杂合子ID型中I等位基因不易被探知,易导致DD型基因频率过高,因此以内含子特异性引物再做一次PCR,正向引物:5'-CTGAGCATGCGTAACTACGCTCGTGCATACGGTC-3';反向引物:5'-TCGTACTAAACGCAGCACCGATC A-3'。全部测序均由ABI 3100测序分析仪(美国ABI公司)完成。为进一步准确测定基因分型结果,随机选取10%样本采用直接测序法进行验证。
1.3 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,用方差分析,两两比较用SNK-q检验,计数资料以率(%)表示,比较用χ2检验。群体基因型用Hardy-Weinberg平衡检验。影响因素的分析采用非条件的Logistic回归分析,并经多重检验P值的Bonferroni进行校正,P<0.05为差异有统计学意义。
2 结果
2.1 基因型及扩增结果
ACE(I/D)位点酶切中呈现1条亮的且长度为490 bp的条带为II型;出现190和490 bp 2条亮带的为ID型,出现190 bp 1条亮带为DD型。随机选取ACE(I/D)的PCR扩增产物行基因测序,结果显示碱基的改变与酶切结果一致。见附图。
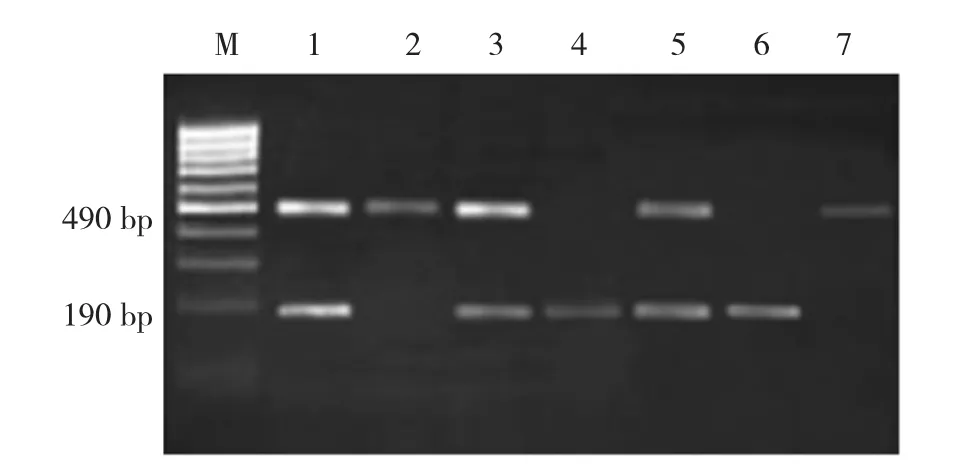
附图 ACE(I/D)不同基因型电泳图
2.2 3组临床资料及生化指标的比较
研究结果显示,各组 FPG、TC、TG、Fins、ACE、HOMA-IR及HOMA-β水平,经单因素方差分析,差异有统计学意义(F=4.983、4.724、5.013、4.694、8.893、8.174 和 6.591,P=0.037、0.038、0.029、0.038、0.013、0.013 和 0.020);GDM 组 FPG、TC、TG、Fins、ACE、HOMA-IR及HOMA-β水平水平与GNGT组比较,差异有统计学意义 (t=3.452、3.901、5.117、3.895、7.207、7.119 和 6.229,P=0.027、0.027、0.019、0.026、0.000、0.000 和 0.008);GDM 组 TG、ACE、HOMA-IR、HOMA-β与GIGT组比较,差异有统计学意义(t=2.993、2.978、6.112 和 5.993,P=0.038、0.039、0.007 和0.009)。见表 1。
2.3 不同组别患者ACE(I/D)基因频率与等位基因频率分布
3组患者基因型构成比较,差异有统计学意义(χ2=8.96,P=0.013),GDM 组 DD 型频率为 49.26%(67/136)及D等位基因频率为65.07%(177/242),GNGT组DD型频率为9.43%(10/106)及D等位基因频率为17.45%(37/212),经χ2检验,差异有统计学意义(χ2=11.57和 10.82,P=0.000和 0.004);GDM 组I I型频率为19.12%(26/136)及I等位基因频率为34.93%(95/242),GNGT组 II型频率为 74.53%(79/106)及I等位基因频率为 82.55%(175/212)(χ2=11.043 和 9.872,P=0.000 和 0.009)。见表 2。
2.4 GDM组ACE(I/D)不同基因型临床指标的比较
GDM 组中 ACE(I/D)3 种不同基因型 FPG、Fins、ACE、HOMA-IR水平的比较,经单因素方差分析,差异有统计学意义(F=5.243、5.986、6.044和 5.372,P=0.028、0.027、0.023 和 0.029);DD 基 因 型 组 FPG、Fins、ACE及HOMA-IR水平与II基因型组比较,差异有统计学意义(t=4.469、5.391、6.231和 4.632,P=0.021、0.019、0.008、0.021);ID 基因型 FPG、Fins、ACE及HOMA-IR水平与II基因型组比较,差异有统计学意义(t=3.542、4.021、4.762 和 3.113,P=0.027、0.022、0.021和0.021)。见表 3。
表1 3组临床资料及生化指标比较 (±s)
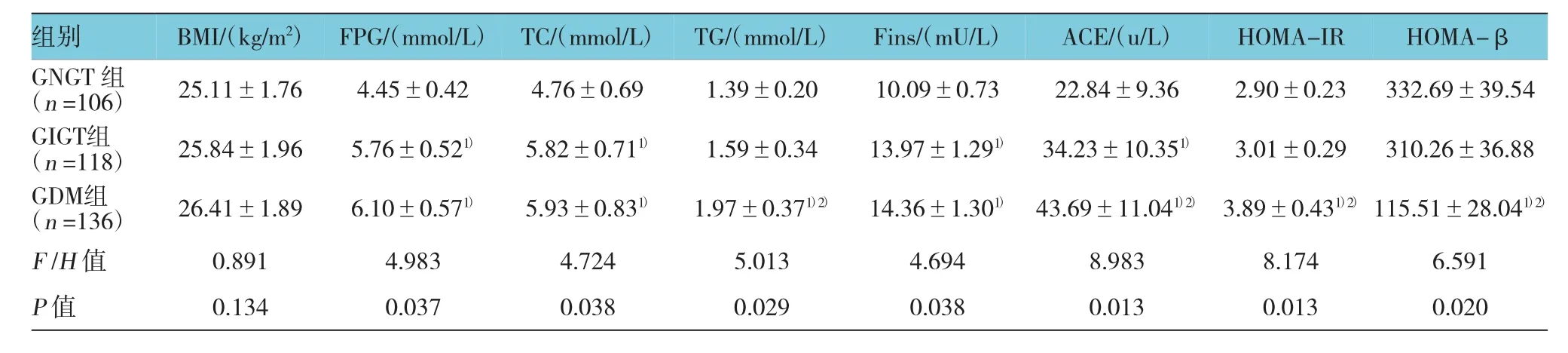
表1 3组临床资料及生化指标比较 (±s)
注:1)与 GNGT 组比较,P <0.05;2)与 GIGT 组比较,P <0.05
组别BMI/(kg/m2)FPG/(mmol/L)TC/(mmol/L)TG/(mmol/L)Fins/(mU/L)ACE/(u/L)HOMA-IR HOMA-β GNGT组(n=106) 25.11±1.76 4.45±0.42 4.76±0.69 1.39±0.20 10.09±0.73 22.84±9.36 2.90±0.23 332.69±39.54 GIGT组(n=118) 25.84±1.96 5.76±0.521) 5.82±0.711) 1.59±0.34 13.97±1.291) 34.23±10.351) 3.01±0.29 310.26±36.88 GDM组(n=136) 26.41±1.89 6.10±0.571) 5.93±0.831) 1.97±0.371)2) 14.36±1.301) 43.69±11.041)2) 3.89±0.431)2)115.51±28.041)2)F/H值 0.891 4.983 4.724 5.013 4.694 8.983 8.174 6.591P值 0.134 0.037 0.038 0.029 0.038 0.013 0.013 0.020
2.5 GDM组ACE(I/D)基因多态性与妊娠结局的关系
GDM组3种不同基因型胎膜早破、产后出血、早产儿、新生儿呼吸窘迫综合征、新生儿低血糖及新生儿高胆红素血症比较,经χ2检验分析,差异有统计学意义(χ2=6.887、7.032、8.112 和 9.397,P=0.022、0.019、0.013和0.009);GDM组ID型、DD型中胎膜早破、早产儿、新生儿呼吸窘迫综合征、新生儿低血糖及新生儿高胆红素血症发生率与I I型比较,差异有统 计学 意 义(χ2=4.762、5.993、5.152、6.779、6.331、7.491、7.636 和 8.779,P=0.039、0.021、0.019、0.014、0.015、0.013、0.0011 和 0.008)。见表 4。
2.6 GDM的危险因素分析
将3组比较有统计学意义的因素进行多变量的Logistic回归分析,以GDM为因变量,FPG(赋值:≥5.7 mmol/L 为 1,<5.7 mmol/L 为 1)、Fins(赋值:≥15.34 mmol/L 为 1,<15.34 mmol/L 为 1)、TC(赋值:≥5.7 mmol/L 为 1,<5.7 mmol/L 为 1)、TG(赋值:≥5.18 mmol/L为1,<5.18 mmol/L为0)、HOMA-IR(赋值:≥3.01 mmol/L 为 1,<3.01 mmol/L 为 1)、HOMA-β(赋值:≥259.44mmol/L为0,<259.44 mmol/L为1)、基因型(I I型为0,ID型为1,DD型为2)及等位基因频率(I等位基因频率为0,D等位基因频率为1)为自变量。结果显示,1.682,6.489),P=0.004]、DD 基因型1.839,7.267),P=0.001]、D 等位基因频率(95%CI:1.296,5.359),P=0.033)]为 GDM 的危险因素,TG
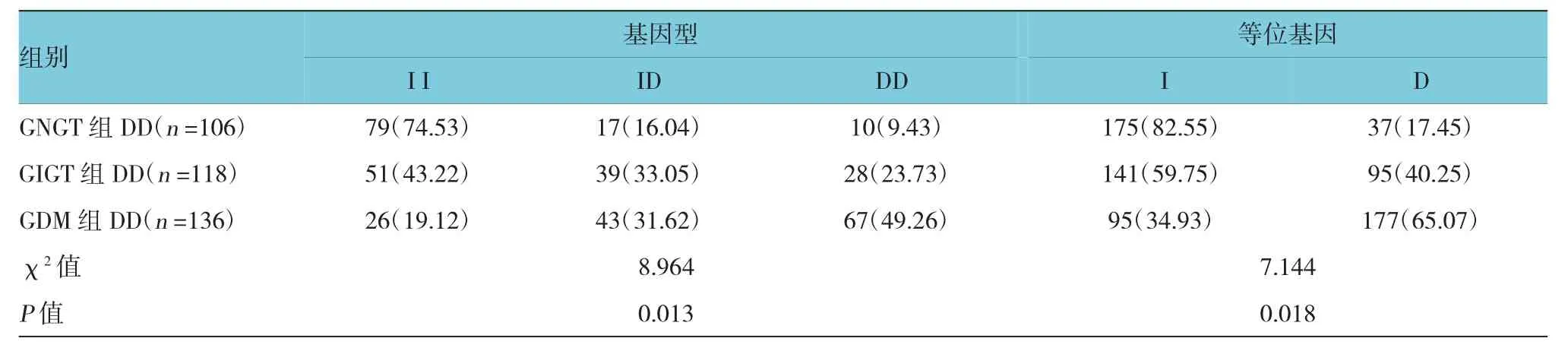
表2 3组患者ACE(I/D)基因频率与等位基因频率分布 例(%)
表3 GDM组ACE(I/D)不同基因型临床指标比较 (±s)
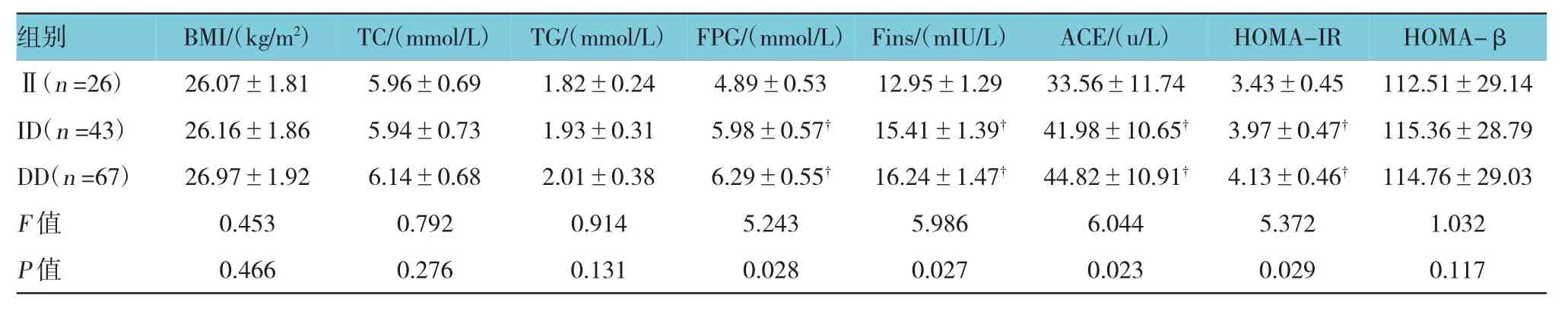
表3 GDM组ACE(I/D)不同基因型临床指标比较 (±s)
注:†与I I基因型组比较,P<0.05
?
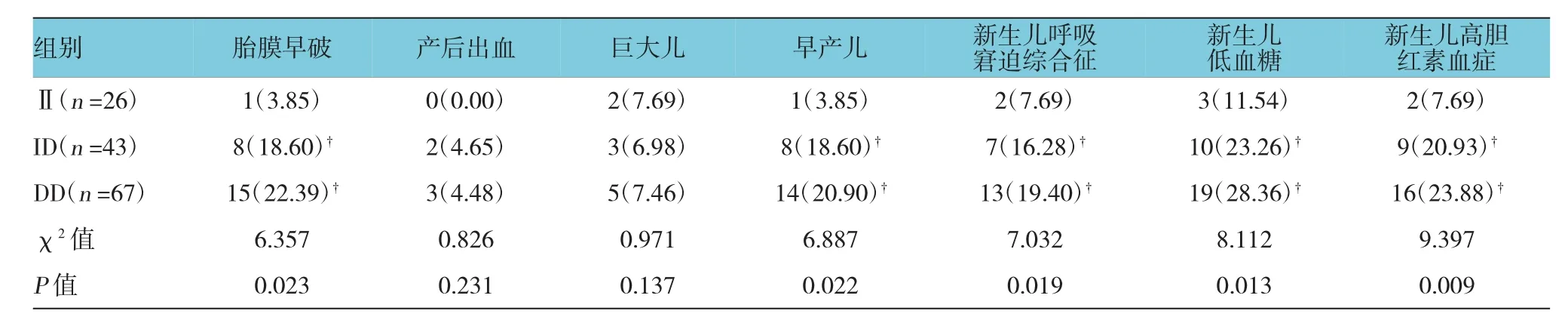
表4 GDM组ACE(I/D)基因多态性与妊娠结局的关系 例(%)
2.7 妊娠不良结局的危险因素分析
将3种基因型比较有统计学意义的因素进行多变量的Logistic回归分析,以妊娠不良结局为因变量,以FPG、Fins、HOMA-IR、DD基因型为自变量。结果为妊娠不良结局的危险因素。
3 讨论
ACE是肾素-血管紧张素系统(rennin angiotensin system,RAS)的关键酶,能够催化血管紧张素Ⅰ(AngiotensinⅠ,AngⅠ)转化为血管紧张素Ⅱ(AngiotensinⅡ,AngⅡ),其中编码ACE蛋白的基因位于染色体17q23,包含26个外显子和25个内含子,总长度为21 kb,基础实验中根据第16内含子中287 bp的Alu片段I/D存在与否表现出插入或缺失多态性,即缺失纯合子DD型,插入纯合子I I型和杂合子ID型。ACE的DD基因型个体的AngⅠ更容易转化成AngⅡ,健康人员DD基因型个体对外源性AngⅠ能产生显著的升压效应,且血清中AngⅡ也显著升高[5-6]。
多数学者认为2型糖尿病的发生发展与遗传、环境因素等密切相关。目前,临床已有报道ACE(I/D)基因多态性与2型糖尿病、糖尿病肾病密切相关,DD基因型患者ACE水平最高,而I I型患者最低[7]。本研究显示,GDM患者DD基因型ACE水平高于I I型、ID型。聂敏等[8]证实ACE(I/D)基因多态性对GDM妊娠中晚期血脂水平有影响,本研究发现,GDM患者TC、TG含量最高,而Ⅱ型最低,这也印证以往的研究报道。ACE最直接的作用是促进AngⅡ生成及表达,而AngⅡ是全身和肾血管壁最强烈的缩血管物质,引起妊娠高血压综合征,此外DD基因型患者血脂水平高于I I型、ID型,而血脂代谢与GDM及不良妊娠结局显著相关[9]。本研究发现,GDM患者DD基因型频率高于I I型,Logistic回归分析显示,FPG、Fins、TC、ACE、HOMA-IR、DD 基因型及 D 等位基因频率为GDM的独立危险因素,这与部分研究报道基本一致。
近年来研究表明,GDM对孕产妇和围产儿的不良影响与妊娠期血糖控制水平密切相关,有研究报道指出,血糖水平控制不佳可以导致羊水过多,巨大儿、新生儿低血糖、新生儿呼吸窘迫综合征甚至死亡等,根据IADPSG最新诊断标准显示,GDM的发病率在全球范围内达到17.8%[10]。目前,对于GDM的发病机制尚不明确,多数认为与胰岛素抵抗及胰岛素分泌不足有关。GDM易合并母儿并发症,常见有妊娠期高血压、早产儿、新生儿低血糖几新生儿高胆红素血症等,其中妊娠期高血压的风险是正常孕妇的2~3倍[11]。这也是本研究选择ACE基因多态性的原因之一。多项研究均证实,D等位基因患者,ACE水平较高,而ACE水平与早产儿、新生儿高胆红素血症及胎膜早破等相关。本研究证实,DD基因型患者不良妊娠结局高于Ⅱ型,进一步采用Logistic回归分析显示,DD基因型与不良妊娠结局相关,提示D等位基因与GDM不良妊娠结局有关。
综上所述,笔者推测ACE(I/D)基因多态性可能是GDM的1个易感位点,其中DD型是GDM和妊娠不良结局的独立危险因素,监测孕妇该基因位点,可以用于GDM风险的预测,从而进行早期干预,减少远期并发症以及不良妊娠结局。
[1]DERYABINA E G,YAKORNOVA G V,PESTRYAEVA L A,et al.Perinatal outcome in pregnancies complicated with gestational diabetes mellitus and very preterm birth:case-control study[J].Gynecol Endocrinol,2016,32(2):52-55.
[2]LI D K,YANG C,ANDRADE S,et al.Maternal exposure to angiotensin converting enzyme inhibitors in the first trimester and risk of malformations in offspring:a retrospective cohort study[J].BMJ,2011,343:DOI:10.1136/bmj.d5931.
[3]AGGARWAL P,AGARWAL N,DAS N,et al.Association of polymorphisms in angiotensin-converting enzyme gene with gestational diabetes mellitus in Indian women[J].International Journal of Applied&Basic Medical Research,2016,6(1):31-37.
[4]浦剑虹,钱惠英,陈钰.血管紧张素转化酶基因多态性与老年高血压及合并糖尿病的相关性研究[J].中国血液流变学杂志,2012,22(2):202-204.
[5]KHAN I A,JAHAN P,HASAN Q,et al.Angiotensin-converting enzyme gene insertion/deletion polymorphism studies in Asian Indian pregnant women biochemically identifies gestational diabetes mellitus[J].Journal of the Renin-angiotensin-aldosterone System,2014,15(4):566-571.
[6]DOSTÁLOVÁ Z,BIENERTOVÁ-VASKŬ A J,VASKŬ A,et al.Insertion-deletion polymorphism in the gene for angiotensin-converning enzyme (I/D ACE)in pregnant women with gestational diabetes[J].Ceska Gynekol,2006,71(5):369-373.
[7]张颖,张瑞生,何邦顺,等.血管紧张素转化酶基因多态性与2型糖尿病的相关性研究[J].医学研究生学报,2010,23(10):1062-1065.
[8]聂敏,洪静,李伟,等.血管紧张素转换酶和血管紧张素转换酶基因多态性与妊娠糖尿病孕妇及正常孕妇血脂水平的相关性研究[J].生殖医学杂志,2009,18(6):501-507.
[9]HINDMARSH P C,RODECK C H,HUMPHRIES S E.Polymorphisms in the angiotensin converting enzyme gene and growth in the first year of life[J].Ann Hum Genet,2007,71(2):176-184.
[10]SACKS D A,HADDEN D R,MARESH M,et al.Frequency of gestational diabetes mellitus at collaborating centers based on IADPSG consensus panel-recommended criteria:the Hyperglycemia and Adverse Pregnancy Outcome(HAPO)study[J].Diabetes Care,2012,35(3):526-528.
[11]梁艳,徐先明.妊娠期糖尿病与妊娠期高血压疾病相关性的研究进展[J].现代妇产科进展,2007,16(12):366-369.
(李科 编辑)
Correlations ofACEgene polymorphism with gestational diabetes mellitus and pregnancy outcome
Yu-ling Lin
(Department of Endocrinology,Central Hospital of Nanyang,Nanyang,Henan 473000,China)
ObjectiveTo investigate the relationships of angiotensin converting enzyme (ACE)gene polymorphisms with gestational diabetes mellitus(GDM)and pregnancy outcome.MethodsPolymerase chain reaction restriction fragment length polymorphism (PCR-RFLP)technique was used to analyzeACEinsertion (I I)and deletion(D)polymorphism loci in 136 cases of pregnant women with GDM(GDM group),118 cases of pregnant women with abnormal glucose tolerance(GIGT group)and 106 pregnant women with normal glucose tolerance(GNGT group).Then the women were followed up,and the correlations between the SNPs ofACEgene and the pregnant outcome were analyzed.ResultsThe frequency of DD genotype and D allele in the GDM group was higher than that in the GNGT group,while the frequency of II genotype was lower than that in the GNGT group (P<0.05).The FPG,Fins,ACE and HOMA-IR in the GDM patients with ID or DD genotype were significantly higher than those in the GDM patients with II genotype (P<0.05).The incidences of premature rupture of membranes,premature birth,neonatal respiratory distress syndrome,neonatal hypoglycemia and neonatal hyperbilirubinemia in the GDM women with ID or DD genotype were significantly higher than those in the GDM women with I I genotype (P<0.05).DD genotype and the D allele frequency were the risk factors for GDM (P<0.05).DD genotype was the risk factor for adverse pregnancy outcome (P<0.05).ConclusionsDD genotype of single nucleotide polymorphism ofACE (I/D)gene is the independent risk factor for GDMand adverse pregnancy outcome.
gestationaldiabetesmellitus;pregnancyoutcome;angiotensin converting enzyme;gene polymorphism
R587.1
A
10.3969/j.issn.1005-8982.2017.12.013
1005-8982(2017)12-0065-06
2016-11-15
