Roux-en-Y胃旁路术对2型糖尿病大鼠肝及外周胰岛素敏感性的影响
2017-07-18刘红媛马南希马瑞何冰
刘红媛,马南希,马瑞,何冰
(中国医科大学附属盛京医院内分泌科,沈阳 110004)
研究报告
Roux-en-Y胃旁路术对2型糖尿病大鼠肝及外周胰岛素敏感性的影响
刘红媛,马南希,马瑞,何冰*
(中国医科大学附属盛京医院内分泌科,沈阳 110004)
目的 观察RYGB术后不同时间2型糖尿病大鼠肝及外周组织胰岛素敏感性的变化并初步探讨可能机制。方法 RYGB组(n=21)及RYGB假手术组(n=7),采用清醒状态扩展高胰岛素-正血糖钳夹术,评估RYGB术后2、4、8周肝及外周组织胰岛素敏感性。检测肝及腓肠肌内TG水平。结果 RYGB术降低体重,减少体内脂肪,改善脂代谢。术后2周肝胰岛素敏感性指数显著提高,肝TG含量明显下降(P<0.05)。术后4周 M值显著提高,肌肉TG含量明显下降(P<0.05)。结论 RYGB术后肝胰岛素敏感性的提高早于外周组织,肝及外周组织胰岛素抵抗持续改善有助于2型糖尿病的长期缓解。RYGB术减少肝及骨骼肌脂肪沉积可能是术后胰岛素敏感性上调的重要机制之一。
2型糖尿病;肥胖;胰岛素抵抗;Roux;胰胃旁路术
1 材料与方法
1.1 实验动物
5~6周龄雄性SD大鼠,SPF级,体重180~200 g,由北京华阜生物科技股份有限公司提供【SCXK(京)2014-0004】。动物饲养于中国医科大学附属盛京医院实验动物中心SPF级环境【SYXK(辽)2010-0008】,温度范围20~24℃,相对湿度50%~60%,12 h/12 h明暗交替,自由饮食及饮水。实验过程按实验动物使用的3R原则给予人道关怀,并通过中国医科大学附属盛京医院动物实验伦理审查(编号2015PS137K)。
1.2 试剂及仪器
链脲佐菌素(streptozotocin,STZ,Sigma),优泌林R (humulin R,美国礼来),[6-3H]葡萄糖由上海涞昂生物科技有限公司提供,组织甘油三酯检测试剂盒(南京建成生物工程研究所),大鼠胰岛素及C-肽测定试剂盒(上海酶联生物科技有限公司)。拜安捷2血糖仪(德国拜耳),HAWK400微量泵(深圳好克有限公司),MacroMR小动物核磁共振成像仪(上海纽迈科技有限公司),日立7180型全自动生化分析仪检测血脂水平。
1.3 动物分组及手术
高脂喂养(40%脂肪,13%蛋白质,47%碳水化合物)大鼠6周后皮下注射STZ(按体重30 mg/kg),继续高脂肪喂养。每周记录血糖水平,空腹血糖大于16.7 mmol/L并持续4周的大鼠被认定为糖尿病[5,6]。
根据随机数字表法抽取21只设为RYGB手术组,7只设为RYGB假手术组。RYGB手术组大鼠用10%水合氯醛(按体重0.35 mL/kg)腹腔麻醉,2%安尔碘消毒,沿腹中线切开腹部。在贲门下方以弧形切断胃近端形成20%小胃囊,远端残胃用6-0缝合线缝合关闭。在距Treitz韧带远端约15 cm处进行空肠离断术,远端空肠和小胃囊吻合,在距吻合口10 cm处行近端及远端空肠端侧吻合。术后用无菌庆大霉素生理盐水冲洗进行腹腔消毒。RYGB假手术组大鼠在与RYGB手术组大鼠相同部位,分别进行胃及空肠离断并原位端端吻合[7]。术后每周记录大鼠体重和空腹血糖水平。实验结束,取肝及腓肠肌组织。
利用“一行”圆,涂出“几倍”,延伸至总量中“部分量”间的比较,丰富倍的内涵;且答案多元,让学生进一步感受“标准量”的重要性,不同的学生积累不同的活动经验。让学生体验到有序思考的思想及解题策略。
1.4 清醒状态扩展高胰岛素—正血糖钳夹实验
大鼠禁食12 h,用10%水合氯醛(按体重0.35 mL/kg)腹腔麻醉,将聚乙烯导管2根,每根一端接有一段3 cm长的硅胶管(内径0.05 cm)分别植入右颈内静脉用于输液和左颈动脉用于采血,静脉导管置于右心房水平,动脉导管置于主动脉弓水平,2根导管均经皮下颈背部引出。大鼠术后恢复3 d,进行清醒状态扩展高胰岛素正血糖钳夹实验[8]。
大鼠禁食12 h,输注优泌林R [11 mU/(kg.min)] 和20%葡萄糖,每5 min抽取动脉血测血糖1次,根据血糖调整葡萄糖输注速度,维持血糖(5.0±0.5) mmol/L。输注[6-3H]葡萄糖20 μCi后,继续输注(4 μCi/min),评估内生葡萄糖生成率及外源葡萄糖利用率。稳态在实验开始后60 min达到,维持30 min,记录稳态下3~4次葡萄糖输注率(GIR),取均值。所有实验组大鼠在实验最后30 min,每10 min采动脉血一次,备测葡萄糖、胰岛素、C-肽和[6-3H]葡萄糖活性。
1.5 肝及外周组织胰岛素敏感性计算
在基础胰岛素输注条件下,肝葡萄糖生成(HGP)以示踪剂输注速率/示踪剂特异活性来计算。肝胰岛素敏感性用肝胰岛素敏感性指数(HISI)评估,即HGP和空腹胰岛素乘积的倒数,外周组织胰岛素敏感性以钳夹最后30 min葡萄糖输注率的平均值计算[9]。
1.6 统计学分析

2 结果
2.1 RYGB手术对血糖的影响
如图1所示,RYGB假手术组大鼠术后空腹血糖维持在15~20 mmol/L,RYGB术后1周大鼠空腹血糖较假手术组大鼠降低45%(P<0.05),RYGB术后2周大鼠空腹血糖恢复至正常水平。RYGB手术可以有效降低2型糖尿病大鼠血糖。
2.2 RYGB手术对体重的影响
RYGB手术组大鼠与RYGB假手术组大鼠术前体重没有差异,RYGB术后2周大鼠体重较RYGB假手术组大鼠显著降低,差异有显著性(P<0.05)。RYGB手术组大鼠体重持续下降至术后4周,4周后大鼠体重达到相对稳定状态,见图2A。如图2B,C所示,RYGB手术对体重的影响主要是其降低了体内脂肪的含量,而对瘦体质量无影响。
2.3 RYGB手术对胰岛素、C-肽及血脂的影响
RYGB假手术组大鼠血浆胰岛素和C肽水平显著高于RYGB 2周, RYGB 4周及RYGB 8周组大鼠(表1,P<0.05)。与RYGB假手术组大鼠相比,RYGB术后2周,大鼠血浆游离脂肪酸浓度下降30%,甘油三酯浓度下降24%,总胆固醇浓度降低13%(表1,P<0.05)。RYGB手术改善高胰岛素血症,降低血脂水平。
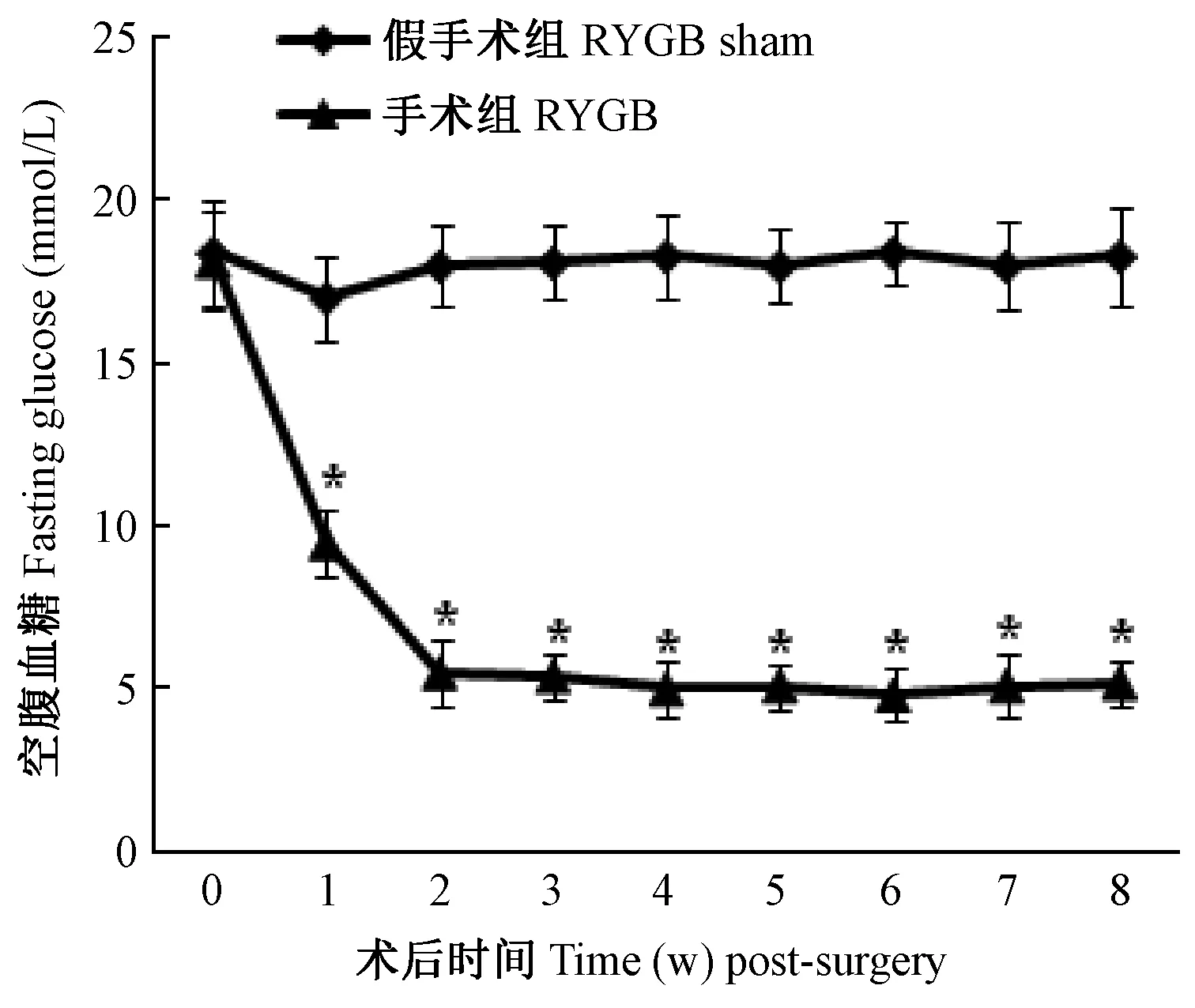
图1 两组大鼠术后每周空腹血糖水平(与RYGB假手术组比,*P<0.05)Fig.1 The fasting glucose level in each study group was assessed before and every week after surgery,sampled from the tail vein using a portable glucometer(*P<0.05, vs. the RYGB sham group)

图2 两组大鼠体重及体质构成(与RYGB假手术组比,*P<0.05)Fig.2 Comparison of the rat body weight and body composition in each study group. The rat weight (A), fat composition (B), and lean mass (C) were recorded before and every week after surgery (*P<0.05, vs. the RYGB sham group)

组别Groups胰岛素μU/mLInsulinC-肽nmol/LC-peptide游离脂肪酸mmol/LFreefattyacids甘油三酯mg/dLTriglyceride总胆固醇mg/dLTotalcholesterolRYGB假手术组RYGBsham27.11±3.550.49±0.070.62±0.2088.30±9.21100.84±9.25RYGB2周组RYGB2w20.55±2.79*0.35±0.05*0.44±0.16*69.77±8.37*88.18±9.43*RYGB4周组RYGB4w16.48±2.05*0.29±0.08*0.34±0.11*54.90±6.89*72.05±8.42*RYGB8周组RYGB8w14.93±2.40*0.26±0.09*0.30±0.15*46.78±5.30*64.71±6.43*
注:与RYGB假手术组相比,*P<0.05。
Note.*P<0.05, vs. the RYGB sham group.
2.4 RYGB手术对外周组织及肝胰岛素敏感性的影响
外周组织胰岛素敏感性用钳夹最后30 min葡萄糖输注率的平均值(M值)评估,主要为肌肉组织对葡萄糖的利用率[9]。与RYGB假手术组大鼠相比,RYGB术后2周大鼠M值有增加趋势。RYGB 2周组:M值(10.0±3.1) mg/(kg·min);RYGB假手术组:M值(8.5±2.0)mg/(kg·min),但是差异无显著性(P>0.05)。RYGB术后4周,大鼠M值较RYGB假手术组大鼠增加近1倍(图3A,P<0.05)。肝胰岛素敏感性用HISI评估,为HGP和空腹胰岛素乘积的倒数[9]。RYGB术后2周,大鼠HISI已经较RYGB假手术组大鼠显著增加(图3B,P<0.05)。RYGB手术减轻胰岛素抵抗,术后肝胰岛素敏感性的改善早于外周组织胰岛素敏感性的改善。
2.5 RYGB手术对肝及肌肉组织甘油三酯含量的影响
RYGB术后2周大鼠肝甘油三酯(triglyceride, TG)含量较RYGB假手术组大鼠降低27%(图4A,P<0.05)。RYGB术后2周,两组大鼠肌肉组织TG含量差异无显著性(图4B,P>0.05)。RYGB术后4周大鼠肌肉组织TG含量显著下降(图4B,P<0.05)。
Pearson correlation分析结果显示,肝胰岛素敏感指数HISI与肝组织甘油三酯含量呈显著负相关(r=-0.537,P<0.05),而M值与肌肉组织甘油三酯含量呈显著负相关(r=-0.509,P<0.05)。

图3 RYGB手术对大鼠肝及外周组织胰岛素敏感性影响(与RYGB假手术组比,*P<0.05)Fig.3 The effects of RYGB surgery on hepatic and peripheral tissue insulin sensitivity.(A) M-value and (B) HISI in each study group. (*P<0.05, vs. the RYGB sham group)

图4 肝及肌肉组织甘油三酯含量(与RYGB假手术组比,*P<0.05)Fig.4 Triglyceride content in the liver and muscle tissues in each rat group (A) Triglyceride in the liver. (B) Triglyceride in the muscle(*P<0.05 vs. RYGB sham group)
3 讨论
1967年Mason 首次提出采用Roux-en-Y胃旁路术治疗严重肥胖症,1980年初,人们发现肥胖合并2型糖尿病患者,RYGB术后短时间内血糖完全恢复,而且正常血糖可以长久维持。RYGB手术能够有效控制肥胖2型糖尿病患者血糖,这一结论被后续多个大型临床研究证实[2]。我们发现2型糖尿病大鼠RYGB术后血糖明显下降,术后1周空腹血糖降低45%,术后2周空腹血糖完全恢复正常。RYGB术后部分胃肠激素分泌水平变化,进而通过肠-胰岛轴调节胰岛内分泌功能,改善血糖[10,11]。RYGB手术对2型糖尿病胰岛素敏感性影响的研究结论并不一致。肝、肌肉及脂肪(外周组织)是胰岛素的主要作用靶点,为了评价RYGB手术对胰岛素敏感性的影响,本研究采用高胰岛素-正血糖钳夹结合示踪剂,观察了RYGB术后不同时间2型糖尿病大鼠肝及外周组织胰岛素敏感性的变化。
我们使用肝胰岛素敏感指数评估肝胰岛素敏感性,肝胰岛素敏感指数为肝葡萄糖生成与空腹胰岛素乘积的倒数。RYGB术后2周肝胰岛素敏感指数增加1倍,这与Dunn等对肥胖伴或不伴有2型糖尿病患者的研究结果一致,RYGB术后肝胰岛素抵抗减轻有助于早期糖代谢的改善[12]。我们通过高浓度胰岛素抑制肝糖输出,用钳夹最后30 min葡萄糖输注率的平均值M值评估外周组织(主要为肌肉组织)胰岛素敏感性的变化[9]。结果发现,与RYGB假手术组大鼠比较, RYGB术后2周大鼠外周胰岛素敏感性有改善,但没有达到统计学差异,直到术后4周M值显著升高。我们的研究结果提示,RYGB术后肝胰岛素抵抗改善对2型糖尿病术后早期血糖下降发挥重要作用,而肝及外周胰岛素敏感性持续增强有助于2型糖尿病术后血糖的长久缓解。
RYGB术后大鼠体重下降,体内脂肪含量显著降低,瘦体质量没有明显变化。同时,脂代谢紊乱状态(包括高甘油三酯,高总胆固醇及高游离脂肪酸)在术后短时间得以纠正,RYGB手术改善了2型糖尿病糖脂代谢异常[13]。我们观察了RYGB手术对胰岛素和C-肽分泌水平的影响,与其他研究结果一致[14],RYGB术后2周大鼠空腹胰岛素和C-肽浓度已经低于对照组大鼠,表明与胰岛素抵抗相关的胰岛素分泌代偿增高减轻。
我们进一步探讨了RYGB手术改善肝及外源组织胰岛素敏感性的可能机制。结果发现,RYGB手术减少肝及骨骼肌内甘油三酯沉积,即降低组织脂毒性[15],与术后肝及外周胰岛素敏感性上调密切相关。
总之,本研究利用高胰岛素-正血糖钳夹结合示踪剂,观察了RYGB术后不同时间肝及外周组织胰岛素敏感性的变化。结果发现,RYGB术后肝胰岛素敏感性增强对早期血糖下降起重要作用,而肝及外周组织胰岛素抵抗持续改善有助于2型糖尿病术后血糖长期稳定于正常水平。RYGB手术减少肝及骨骼肌脂肪沉积是术后肝及外周组织胰岛素敏感性上调的重要机制之一。
[1] Ng M, Fleming T, Robinson M, et al. Global, regional, and national prevalence of overweight and obesity in children and adults during 1980-2013: a systematic analysis for the Global Burden of Disease Study 2013[J]. Lancet, 2015, 384(9945):766-781.[2] Yan Y, Sha Y, Yao G, et al. Roux-en-Y gastric bypass versus medical treatment for type 2 diabetes mellitus in obese patients: a systematic review and meta-analysis of randomized controlled trials[J]. Medicine, 2016, 95(17):e3462.
[3] Camastra S, Gastaldelli A, Mari A, et al. Early and longer term effects of gastric bypass surgery on tissue-specific insulin sensitivity and beta cell function in morbidly obese patients with and without type 2 diabetes[J]. Diabetologia, 2011, 54(8): 2093-2102.
[4] Fabbrini E, Tamboli RA, Magkos F, et al. Surgical removal of omental fat does not improve insulin sensitivity and cardiovascular risk factors in obese adults[J].Gastroenterology, 2010, 139(2):448-455.
[5] Srinivasan K.Viswanad B, Asrat L, et al.Combination of high-fat diet-fed and low-dose streptozotocin-treated rat:a model for type 2 diabetes and pharmacological screening[J]. Pharmacol Res, 2005, 52(4):323-330.
[6] 杨架林, 李果, 刘优萍, 等.长期高脂饮食加小剂量链脲佐菌霉素建立人类普通2型糖尿病大鼠模型的研究[J].中国实验动物学报, 2003, 11(2):138-141.
[7] He B, Liu L, Yu C, et al. Roux-en-Y gastric bypass reduces lipid overaccumulation in liver by upregulating hepatic autophagy in obese diabetic rats[J]. Obes Surg, 2015, 25(1):109-118.
[8] 何冰,赵晟,张巍,等. 水杨酸钠对胰岛素抵抗大鼠胰岛素受体底物-1的影响[J].中国实验动物学报,2010,18(6):520-522.[9] Matsuda M, DeFronzo RA. Insulin sensitivity indices obtained from oral glucose tolerance testing: comparison with the euglycemic insulin clamp[J]. Diabetes Care, 1999, 22(9):1462-1470.[10] Seyfried F, Miras AD, Rotzinger L, et al. Gastric bypass-related effects on glucose control, β cell function and morphology in the obese Zucker rat[J]. Obes Surg, 2016, 26(6):1228-1236.
[11] Lindqvist A, Spégel P, Ekelund M, et al. Gastric bypass improves β-cell function and increases β-cell mass in a porcine model[J]. Diabetes, 2014, 63(5):1665-1671.
[12] Dunn JP, Abumrad NN, Breitman I, etal.Hepatic and peripheral insulin sensitivity and diabetes remission at 1 month after Rou-en-Y gastric bypass surgery in patients randomized to omentectomy[J].Diabetes Care, 2012, 35(1):137-142.
[13] Shoar S, Nguyen T, Ona MA, et al. Roux-en-Y gastric bypass reversal: a systematic review[J]. Surg Obes Relat Dis. 2016, S1550-7289(16): 68-X.
[14] Chambers AP1, Jessen L, Ryan KK,et al. Weight-independent changes in blood glucose homeostasis after gastric bypass or vertical sleeve gastrectomy in rats[J]. Gastroenterology, 2011, 141(3):950-958.
[15] Mosinski JD, Pagadala MR, Mulya A, et al. Gastric bypass surgery is protective from high-fat diet-induced non-alcoholic fatty liver disease and hepatic endoplasmic reticulum stress[J]. ActaPhysiol, 2016, 217(2):141-151.
Roux-en-Y gastric bypass increases hepatic and peripheral insulin sensitivity in rats with type 2 diabetes mellitus
LIU Hong-yuan, MA Nan-xi, MA Rui, HE Bing*
(Department of Endocrinology,Shengjing Hospital of China Medical University,Shenyang 110004,China)
Objective To investigate the effects of Roux-en-Y gastric bypass (RYGB) on hepatic and peripheral insulin sensitivity in rats with type 2 diabetes and their possible mechanisms. Methods 5-6 week old SPF male Sprague-Dawley rats were divided into 2 groups: diabetic RYGB group (n=21) and diabetic RYGB sham group (n=7). The hyperinsulinemic-euglycemic clamp with tracer infusion was completed at 2, 4, and 8 weeks postoperatively to assess the insulin sensitivity. The lipid content in liver and muscle tissue was examined. Results Postoperatively, the diabetic RYGB group had significant decreases in weight, fat mass, and RYGB had a profound effect on the plasma lipid profile. Two weeks after surgery, the hepatic insulin sensitivity index was significantly improved and the hepatic triglyceride was decreased in the RYGB group (P<0.05). The significant increased insulin sensitivity was not detected until four weeks after RYGB surgery, the M value was significantly increased and the TG content in the muscle tissue was significantly decreased (P<0.05). Conclusions The increased insulin sensitivity after RYGB occurs earlier in the liver than in the muscle and both may contribute to the long-term remission of type 2 diabetes. Reduced lipid content in hepatocytes and skeletal muscle cells after RYGB may contribute to the improved insulin sensitivity in these cells.
Type 2 diabetes mellitus; Obesity; Insulin resistance; Roux-en-Y gastric bypass; Rats
HE Bing. E-mail:hb3h@hotmail.com
国家自然基金面上项目(NO.81570765);辽宁省科学技术基金(NO.2015020539)。
刘红媛(1992-),女,硕士,研究方向:胃旁路术改善胰岛素抵抗机制研究。E-mail: 594966484@qq.com
何冰(1973-),女,副主任医师,硕士生导师,主要从事脂毒性胰岛素抵抗发病机制及干预研究。E-mail:hb3h@hotmail.com
Q95-33
A
1005-4847(2017)03-0270-05
10.3969/j.issn.1005-4847.2017.03.007
2016-09-18
