中国地鼠口腔颊囊黏膜癌变过程凋亡相关基因caspase-3、caspase-9、Bax、Bcl-2的表达
2017-07-18庞文彪李莉红皇甫冰刘茂林张锐虎宋国华
庞文彪,李莉红,皇甫冰,刘茂林,张锐虎,宋国华
(山西医科大学实验动物中心; 实验动物与人类疾病动物模型山西省重点实验室,太原 030001)
研究报告
中国地鼠口腔颊囊黏膜癌变过程凋亡相关基因caspase-3、caspase-9、Bax、Bcl-2的表达
庞文彪#,李莉红#,皇甫冰,刘茂林,张锐虎,宋国华*
(山西医科大学实验动物中心; 实验动物与人类疾病动物模型山西省重点实验室,太原 030001)
目的 探讨凋亡相关基因caspase-3、caspase-9、Bax、Bcl-2在中国地鼠口腔正常黏膜、上皮单纯增生、上皮异常增生和鳞状细胞癌组织中的表达及其意义。方法 采用免疫组织化学法、RT-PCR检测正常中国地鼠口腔黏膜上皮、单纯增生上皮、异常增生上皮和鳞癌组织中caspase-3、caspase-9、Bax、Bcl-2蛋白及mRNA的表达。结果 在口腔黏膜癌变过程中,鳞癌组织中抑制凋亡蛋白Bcl-2表达明显高于口腔正常黏膜、上皮单纯增生、上皮异常增生(P<0.05);异常增生上皮caspase-3、caspase-9、Bax表达均明显高于正常组(P<0.05),但随着增生程度的加重,caspase-3、caspase-9、Bax表达明显降低(P> 0.05)。相关性分析显示,鳞癌组织中Bcl-2与Bax、caspase-3、caspase-9呈负相关(P< 0.05)。 RT-PCR 结果表明,与正常组织相比,鳞癌组织中Bcl-2高表达,而caspase-3、caspase-9、Bax的mRNA表达显著下调(P<0.05)。结论 本实验在中国地鼠鳞癌组织中caspase-3、caspase-9、Bax表达降低而Bcl-2表达上升,揭示了caspase-3、caspase-9、Bax、Bcl-2表达与口腔鳞癌的发生、发展密切相关,可以为口腔颊囊黏膜癌的基因治疗提供一些线索或并为评价OSCC的生物学特征及预后提供参考。
中国地鼠;口腔鳞状细胞癌;凋亡
在我国,鳞状细胞癌在口腔颌面部的恶性肿瘤中占80%以上,5年的生存率约为60%,并且发病率呈逐年上升趋势[1]。随着人们生活习惯的不断改变,口腔鳞状细胞癌(OSCC)在人群中的发病情况由原来男女构成比约为2∶1转变为女性患者的增长速度大于男性[1]。在美国,每年约30 000口腔癌的新发病例中,有90%的口腔癌患者为口腔鳞状细胞癌[2]。目前,国内的口腔医疗与卫教虽已将进入发达国家之林,但遗憾的是大部分主要进行手术切除,这不仅使患者在日常生活存在许多不便,同时外形的改变造成患者心理上也存在一些疾病。相关学者针对口腔鳞状细胞癌的发病机制作了很多研究,但是具体机制还不太明确。
研究表明,肿瘤的形成是细胞增殖的调控与细胞凋亡发生紊乱的结果,细胞凋亡状态及其调控基因的异常参与了肿瘤的发生发展[3,4]。细胞凋亡即细胞程序性死亡,是细胞在基因与多种因子共同调控作用下发生的正常生理过程,细胞凋亡调控程序障碍会打乱机体细胞增殖与细胞凋亡的动态平衡,引起细胞的过度增殖,导致肿瘤的发生。口腔鳞状细胞癌的发生发展与口腔黏膜上皮细胞的增殖/凋亡失衡有关。caspase-3、caspase-9、Bax、Bcl-2是调控细胞凋亡过程中的关键蛋白,在许多恶性肿瘤中的研究较多,而在口腔癌中的联合研究比较少见。本文采用免疫组化、RT-PCR检测中国地鼠正常口腔黏膜组织、单纯增生组织、异常增生组织及口腔鳞状细胞癌组织中caspase-3、caspase-9、Bax、Bcl-2 的表达情况,并观察其与细胞凋亡及四基因之间的关系,为OSCC的发生机制研究提供科学依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
清洁级中国地鼠60只,8~10周龄,雄性,由山西医科大学实验动物中心提供【SCXK(晋)2015-0001】。动物实验在屏障环境【SYXK(晋)2015-0001】下进行,温度控制在25℃左右,相对湿度40%~70%,12 h/12 h光暗循环条件下,实验严格按照山西医科大学实验动物管理委员会的要求进行操作。
1.1.2 主要试剂
兔抗人、大鼠、小鼠、兔caspase-9、Bax、Bcl-2多克隆抗体,兔抗大鼠、小鼠caspase-3多克隆抗体,SABC免疫组化染色试剂盒,DAB显色试剂盒和30% H2O2,均购自武汉博士德生物公司;Trizol试剂、反转录试剂盒、荧光定量PCR试剂盒,均购自宝生物工程大连有限公司。
1.2 方法
1.2.1 口腔癌前病变和鳞癌动物模型制备
随机将60只雄性中国地鼠分为三个组,分别为模型组(24只)、溶剂对照组(12只)、空白对照组(24只)。每周一、三、五上午9:00进行以下实验操作:①模型组:用小头棉签在中国地鼠双侧颊囊涂擦0.5% DMBA丙酮液,用洗耳球吹干并禁食禁水2 h;②溶剂对照组:单涂丙酮液,涂抹方法同模型组;③空白对照组:不做任何处理。
持续15周,同时按WHO标准的12项分级记录判定[5]颊囊病理改变,最终成功建模。实验过程中遵循“3R”原则,实验结束后,采用符合实验动物福利的处死方法进行处理。
1.2.2 免疫组织化学法检测颊囊组织中caspase-3、caspase-9、Bax、Bcl-2蛋白的表达
根据病理鉴定后的结果,应用免疫组织化学法检测挑选出的口腔正常黏膜组织、上皮单纯增生组织、上皮异常增生组织及鳞癌组织。按SABC试剂盒给的说明书进行具体操作:载玻片防脱片剂处理;切片常规脱蜡至水;30% H2O21份+蒸馏水10份混合,室温5~10 min以灭活内源性酶,蒸馏水洗3次;热修复抗原;5%BSA 封闭;一抗、二抗处理;DAB 室温显色;苏木素轻度复染、脱水、透明、封片。显微镜下观察免疫组织化学切片caspase-9、caspase-3、Bax、Bcl-2蛋白表达情况,细胞质和/或细胞膜和/或细胞核呈棕黄色、棕褐色或弥漫性着色的为阳性细胞。每组选定3个重复,采用Image Pro Plus(IPP)图像分析软件进行半定量分析,随机选取每张切片不同的5个视野,在高倍镜(×200)下观察,测定每个视野下阳性反应的平均光密度值,以每例5个视野的平均光密度的平均值作为该例的测量值。平均光密度值越高说明表达越强,反映组织内蛋白含量越多。
1.2.3 RT-PCR法测定颊囊组织中caspase-3、caspase-9、Bax、Bcl-2 mRNA的表达
取15周颊囊冻存组织中口腔鳞癌组织(模型组)和正常组织(正常组),Trizol 法常规提取总RNA,用核酸浓度检测计和酶标仪测定RNA浓度和纯度(A260/280比值)。若A260/280≥1.8,说明RNA达到实验纯度要求,能够继续进行后续实验。按照逆转录试剂盒操作程序,以总RNA 为模板,逆转录为cDNA。用Primer Premier 5引物设计软件设计上下游引物,由软件Oligo 6评估引物,并在NCBI官方网站对引物进行Blast特异性检验,全部引物在华大基因公司合成,引物序列见表1。应用ABI 7300型荧光定量PCR仪进行PCR扩增,扩增反应体系为20 μL:2× SYBR® Premix Ex TaqII 10 μL;50× ROX Reference Dye 0.4 μL;上游引物0.8 μL(浓度10 μmol/mL);下游引物0.8 μL(浓度10 μmol/mL);cDNA溶液2 μL;灭菌蒸馏水(dH2O)6 μL。扩增程序为:95℃预变性30 s,(95℃ 5 s,60℃ 31 s)×40个循环,每个样本同时做三个重复。
β-Actin基因作为内参对照,实验结果采用2-△△CT进行数据的相对定量分析。

表1 实时定量PCR所用引物Tab.1 Primer sequences for the real-time quantitative PCR
1.3 统计分析

2 结果
2.1 病理鉴定结果
分别于第6、9、12、15周将模型组和空白对照组随机处死6只,溶剂对照组随机处死3只,在实验开始,6周内中国地鼠的形态呈相对稳定状态,改变不明显;在9周以后逐渐出现不典型增生,并逐渐严重;建模12周时,出现2只患有原位癌及鳞癌的中国地鼠,占13.3%;建模15周时患有原位癌及鳞癌的中国地鼠达到6只,占40%。空白对照组、溶剂对照组与模型组标本病理鉴定结果见表2。

表2 各组标本病理鉴定结果Tab.2 Results of pathological examination of the specimens
2.2 免疫组织化学检测中国地鼠口腔颊黏膜癌变各阶段的蛋白表达
2.2.1 caspase-3、caspase-9蛋白表达
免疫组织化学结果显示caspase-3、caspase-9阳性染色表达于细胞胞膜及胞质,表现为黄色、棕黄或棕褐色颗粒(见图1)。在正常口腔黏膜中caspase-3、caspase-9表达程度较均一,可见中等阳性反应,主要为基底细胞和棘细胞层底部或极少量表层细胞的胞质着色,及角化层着色,偶见基底上细胞或表层细胞胞核着色。上皮单纯增生caspase-3、caspase-9的阳性表达较正常黏膜组织轻度增加,差异无显著性(P>0.05)。随着上皮异常增生程度的加剧,caspase-3、caspase-9阳性表达逐渐增强,在重度上皮异常增生组织中表达最强,染色最深呈棕褐色,阳性细胞弥漫遍布上皮全层。在鳞状细胞癌组织中,caspase-3阳性表达明显减少,表现为弱阳性染色,染色较浅呈淡黄色且不规则的分布在癌细胞的细胞质中。从正常口腔黏膜到异常增生,caspase-3、caspase-9的表达呈增加趋势,其caspase-3的平均光密度明显高于鳞癌组织,caspase-3阳性表达显著低于正常组、上皮单纯增加和上皮异常增生组(P<0.001)。经单因素方差分析caspase-3、caspase-9在正常口腔黏膜、上皮单纯增生组织、上皮异常增生组织及鳞癌组织中的表达差异有显著性(F=149.16,P<0.001;F=206.48,P<0.001)。caspase-3除正常口腔黏膜与上皮异常增生之间,其他各组之间差异有显著性(P<0.001)。caspase-9多重比较分析两组之间差异有显著性(见表3和图2)。

表3 caspase-3、caspase-9在口腔黏膜癌变各阶段A值比较Tab.3 Comparison of the OD values of caspase-3 and caspase-9 at different stages of the oral mucosa carcinogenesis
注:与对照组比较,*P<0.05,**P<0.01,***P<0.001; 与单纯增生组比较△P<0.05,○P<0.01,☆P<0.001;与异常增生组比较▲P<0.05,●P<0.01,★P<0.001。(下表同)
Note. Compared with the control group,*P<0.05,**P<0.01,***P<0.001; Compared with the simple hyperplasia group,△P<0.05,○P<0.01,☆P<0.001; Compared with the epithelial dysplasia group,▲P<0.05,●P<0.01. (The same in following tables)
2.2.2 Bax、Bcl-2蛋白表达
免疫组织化学实验观察,Bax、Bcl-2蛋白阳性染色表现为不同程度的棕黄色或棕褐色颗粒状着色,Bax阳性物质主要见于细胞质内,阳性细胞呈弥漫性分布,少数见散在分布(见图1),Bcl-2 阳性物质主要见于胞核和/或胞质,细胞轮廓较为清晰。经单因素方差分析,Bax、Bcl-2组间比较差异均有显著性(F=72.096,P<0.001;F=63.439,P<0.001)。正常口腔黏膜Bax表达程度较均一,为局限于基底层与角化层细胞的棕黄色中阳性表达,Bcl-2仅在基底层有少量阳性细胞,表现为黄色或棕色颗粒。从上皮单纯增生到异常增生,相对于正常组,Bax、Bcl-2阳性表达均有所增强,Bax阳性细胞几乎遍布角质层以下的上皮各层但染色强度无明显改变,总体增幅较小,单纯增生与异常增生之间差异无显著性(P>0.05);异常增生组织中Bcl-2阳性表达和着色强度明显增加,与正常组和单纯增生组相比差异有显著性(P<0.05)。鳞癌组织中,Bax阳性表达明显下降,细胞着色较淡呈浅黄色,为弱阳性表达。Bcl-2阳性细胞在鳞癌组表达最强,呈弥漫性表达于胞核及胞质, 着色呈现异质性,表现为棕色或棕褐色颗粒。鳞癌组Bax、Bcl-2阳性表达与正常组、单纯增生组、鳞癌组相比差异均有显著性(P<0.001)(表4、图2)。
2.2.3 四种蛋白表达的相关性分析
实验结果显示口腔黏膜癌变过程中caspase-3、caspase-9、Bax、 Bcl-2 均存在显著的变动趋势,我们猜想基因之间可能存在着一定的关系,共同参与了肿瘤的发生发展。进一步的相关性分析揭示在鳞癌组织中,caspase-3与caspase-9在口腔异常增生组织(r=0.90,P<0.05)、鳞癌组织(r=0.89,P<0.05)中存在明显的相关性,结果具有统计学意义;Bax与Bcl-2在鳞癌组织中表达呈负相关(r=-0.92,P<0.05);鳞癌组织中caspase-3、caspase-9的表达与Bax呈正相关,与Bcl-2呈负相关。四个基因在鳞癌组织中两两之间均存在相关关系(P<0.05)。
2.3 RT-PCR法测定中国地鼠颊囊组织中caspase-3、caspase-9、Bax、Bcl-2 mRNA的表达
为了明确凋亡相关因子在口腔癌中的表达情况,我们进一步利用以β-actin为内参的RT-qPCR检测了两组地鼠颊囊组织中凋亡相关因子caspase-3、caspase-9、Bax、Bcl-2 mRNA的表达水平。RT-qPCR实验结果显示:与正常组织相比,地鼠颊囊鳞癌组织中caspase-3、caspase-9、Bax的mRNA表达显著下调(P<0.05),Bcl-2在鳞癌组织中高表达,在正常组织中低表达,差异有显著性(t=5.50,P<0.01)(见表5和图3)。

表4 Bax、Bcl-2在口腔黏膜癌变各阶段A值比较Tab.4 Comparison of the A values of Bax and Bcl-2 at different stages of oral mucosa carcinogenesis
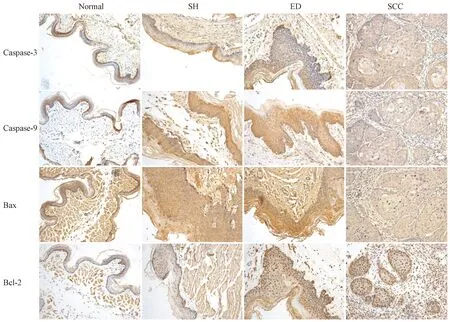
注:Normal:对照组;SH:单纯增生组;ED:异常增生组;SCC:鳞癌组。图1 caspase-3、caspase-9、Bax、Bcl-2 的免疫组化结果(IHC×200,bar=100 μm)Note.Normal:the control group;SH:the simple hyperplasia group;ED:the epithelial dysplasia group;SCC:the squamous cell carcinoma group.Fig.1 Expressions of caspase-3,caspase-9,Bax and Bcl-2 at different stages of carcinogenesis. (Immunohistochemical staining)

注:A:与对照组比较*P<0.05,**P<0.01,***P<0.001; 与单纯增生组比较△P<0.05,○P<0.01,☆P<0.001;与异常增生组比较▲P<0.05,●P<0.01,★P<0.001。图2 口腔黏膜癌变各阶段caspase-3、caspase-9、Bax、Bcl-2 蛋白的表达Note. Compared with the control group,*P<0.05, **P<0.01, ***P<0.001; Compared with the simple hyperplasia group,△P<0.05,○P<0.01,☆P<0.001; Compared with the epithelial dysplasia group,▲P<0.05,●P<0.01,★P<0.001.Fig.2 The expression of caspase-3,caspase-9,Bax and Bcl-2 protein at different stages of oral mucosa carcinogenesis

基因名Genes正常口腔黏膜Normaloralmucosa原位癌及鳞癌Carcinomainsituandsquamouscellcarcinomascaspase-31.00±0.050.27±0.10***caspase-91.04±0.370.44±0.06**Bax1.38±0.260.65±0.11**Bcl-21.01±0.202.09±0.27**
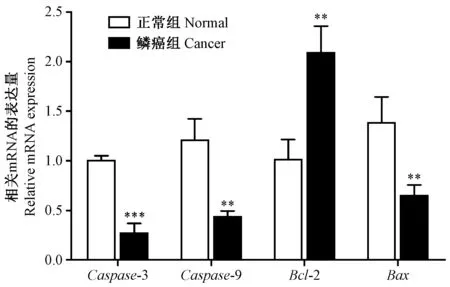
注:A:与对照组比较*P<0.05,**P<0.01,***P<0.001。图3 口腔黏膜癌变各阶段caspase-3、caspase-9、Bax、Bcl-2 mRNA的表达Note. Compared with the control group,*P<0.05,**P<0.01,***P<0.001.Fig.3 The expression of caspase-3, caspase-9, Bax and Bcl-2 mRNA at different stages of the oral mucosa carcinogenesis
3 讨论
近年来,大量学者关于人类恶性肿瘤的研究不仅局限于分子层面而且已经深入到基因水平。恶性肿瘤的发生发展是一个复杂且多因素引起的过程,其最主要的原因就是恶性肿瘤细胞的无限增殖与细胞凋亡障碍,即细胞增殖与细胞凋亡失衡所引起的。
细胞凋亡是一种重要的自稳机制, 对多细胞动物机体的正常发育和自身稳定具有极其重要的作用, 细胞凋亡失衡与许多疾病尤其是与肿瘤的发生发展有关[6]。细胞凋亡在肿瘤发生发展过程中主要起负调控作用, 可以阻遏肿瘤细胞迅速生长。根据目前对细胞凋亡调控机制的认识, 可将与细胞凋亡相关的基因大致分为促凋亡基因和抗凋亡基因两大类。当细胞促凋亡基因活性受抑制和/或抗凋亡基因被激活, 使该细胞不能凋亡而长期存活, 再加上癌基因异常高表达和/或肿瘤抑制基因活性受抑制, 最终可能导致细胞癌变和肿瘤形成[7]。与其他肿瘤一样,口腔癌作为头颈部较常见的肿瘤之一,其发生发展也与细胞凋亡失衡有关。OSCC综合治疗效果不佳且预后较差,在过去三十年里,虽然在临床诊断及治疗上取得很大进步,但其5年生存率并没得到很好改善[8,9]。因此,从细胞凋亡方面研究口腔癌的发生发展具有重要意义。
严格控制细胞凋亡过程的众多基因在种属之间非常保守,如Bcl-2 家族、caspase家族、癌基因C-myc、抑癌基因p53 等[10]。研究发现,Bcl-2家族是一类在细胞凋亡信号途径中发挥重要作用的蛋白质[11],Bcl-2 和Bax分别是Bcl-2 家族中最有代表性的抑制凋亡和促进凋亡基因,在肿瘤细胞凋亡中具有重要的调控作用[12],当Bcl-2表达量增多时,Bcl-2/Bax异源二聚体的数量相应增加,通过抑制线粒体内细胞色素C的释放来抑制细胞凋亡;而当Bax表达量较高时,Bax/Bax同源二聚体数量增加,此同源二聚体与增加线粒体膜上的通道结合使其通透性增加,促进细胞色素C释放,从而激活caspase成员的一系列反应而促使生物细胞凋亡[13]。caspase 家族是细胞凋亡过程中极其重要的一组蛋白酶,无活性的caspase 酶原被不同信号分子激活裂解维持细胞生存的蛋白,从而导致细胞凋亡[14]。caspase-3和caspase-9是caspase家族中的关键效应酶,caspase-9位于内源性传导通路的起始部分,是重要的凋亡启动因子。细胞色素C在dATP条件下与Apaf-1(凋亡因子1)结合形成多聚体,激活caspase-9,进而激活caspase-3,导致细胞凋亡[15]。
本研究中,当上皮出现异常增生时,Bax的表达达到最强,提示机体试图通过Bax/Bax表达加强来促进异常增生细胞凋亡,进而拮抗细胞的增殖;随组织学分级的增加,Bcl-2表达水平越来越高,Bax的表达越来越低,Bcl-2/Bax比例逐级加剧,癌细胞的凋亡受抑制,癌细胞积累加强,促使了肿瘤的形成。许多研究发现caspase-3和caspase-9在乳腺癌、结直肠癌、胃癌等肿瘤中表达量明显降低[16-18]。本实验中,caspase-3和caspase-9在口腔鳞癌组织中的蛋白和mRNA表达均明显下降,与口腔正常黏膜相比,差异有显著性(P< 0.05),呈正相关,提示caspase-3和caspase-9 在OSCC的发生发展中起协同作用,其机制可能为促进细胞凋亡。还有相关研究指出,Bax 蛋白作为线粒体膜上离子通道的组成成分,上调可使Cyt-C 可穿过线粒体膜,激活caspase-9蛋白,进一步激活caspase-3 蛋白,导致细胞凋亡[19],提示我们Bax减少Bcl-2含量增多可能会抑制caspase-9蛋白活性进而抑制caspase-3蛋白活性,引起肿瘤发生。我们进一步分析显示,鳞癌组织中Bcl-2含量确实增加而caspase-3、caspase-9、Bax降低,提示caspase-3、caspase-9、Bax、Bcl-2基因在口腔黏膜癌发病过程中,参与细胞凋亡与癌变,与口腔鳞癌的发生、发展密切相关,为口腔癌的发生、发病机制,及临床治疗及预后判断提供理论依据。
[1] 张志愿. 口腔颂面外科学 [M]. 7版. 北京:人民卫生出版社, 2013.
[2] 郑婧, 南欣荣. 蛋白在口腔鳞状细胞癌中的表达及意义 [D]. 山西医科大学, 2016.
[3] 郭斌, 杨为民, 谢凯. 膀胱移行细胞癌组织中caspase-3和Bcl-2蛋白的表达及其意义 [J]. 临床泌尿外科杂志, 2010, 25(7): 517-520.
[4] Thompson CB. Apoptosis in the pathogenesis and treatment of disease [J]. Science, 1995, 267(5203): 1456-1462.
[5] WHO Collaborating Centre for Oral Precancerous Lesions. Definition of leukoplakia and related lesions: an aid to studies on oral precancer [J]. Oral Surg 1978, 46(4): 518-539.
[6] 李娜, 高俊岩, 刘敏. 细胞凋亡和肿瘤的关系研究进展 [J]. 当代医学, 2009, 15(16): 13-14.
[7] 欧阳高亮, 李祺福. 细胞凋亡与肿瘤的发生发展和治疗 [J]. 国外医学肿瘤学分册, 2000, 27, (5): 266-269.
[8] Ge L, Liu S, Xie L, et al. Differential mRNA expression profiling of oral squamous cell carcinoma by high-throughput RNA sequencing [J]. J Biomed Res, 2015, 29(5): 397-404.
[9] 皇甫冰, 宋国华. 基于高通量测序的中国地鼠颊囊鳞癌转录组差异表达研究 [D]. 山西医科大学硕士论文, 2016.
[10] 王裕,宋国华. 氟对大鼠肾小管上皮细胞的毒性作用及硒干预机制的研究 [D]. 山西医科大学硕士论文, 2015.
[11] Sahi H, Koljonen V, Kavola H, et al. Bcl-2 expression indicates better prognosis of Merkel cell carcinoma regardless of the presence of Merkel cell polyomavirus [J]. Virchows Arch, 2012, 461(5): 553-559.
[12] Anvekar RA, Asciolla JJ, Missert DJ, et al. Born to be alive: a role for theBCL-2 family in melanoma tumor cell survival, apoptosis, and treatment [J]. Front Oncol. 2011, 1(34). pii: fonc.2011.00034.
[13] 张丙信, 张金库.Apaf-1、caspase-9、Bax、Bcl-2 和p53 在基底细胞样乳腺癌中的表达及临床意义 [D]. 承德医学院, 2015.
[14] 陈力, 李凡, 任国胜. 靶向Livin 的RNA 干扰对食管癌Eca-109 细胞凋亡相关蛋白caspase- 3 和caspase- 9 表达的影响 [J]. 重庆医科大学学报, 2011, 36(3): 298-302.
[15] Wong RS.Apoptosis in cancer: from pathogenesis to treatment [J].J Exp Clin Cancer Res, 2011, 30: 87. doi: 10.1186/1756-9966-30-87.
[16] Pilco-Ferreto N, Calaf GM. Influence of doxorubicin on apoptosis and oxidative stress in breast cancer cell lines [J]. Int J Oncol. 2016, 49(2): 753-762.
[17] Lee MH, Hong SH, Park C, et al. Hwang-Heuk-San induces apoptosis in HCT116 human colorectal cancer cells through the ROS-mediated activation of caspases and the inactivation of the PI3K/Akt signaling pathway [J]. Oncol Rep, 2016, 36(1): 205-214.
[18] Dolatkhah H, Movahedian A, Somi MH, et al. Effect of PUFAs oral administration on the amount of apoptotic caspases enzymes in gastric cancer patients undergoing chemotherapy [J]. Anticancer Agents Med Chem. 2017, 17(1): 93-101.
Expression of apoptosis-related genescaspase-3,caspase-9,BaxandBcl-2 during oral buccal mucosa carcinogenesis in Chinese hamster
PANG Wen-biao#, LI Li-hong#, HUANG Fu-bing, LIU Mao-lin, ZHANG Rui-hu, SONG Guo-hua*
(Laboratory Animal Center,Shanxi Medical University; Shanxi Key Laboratory Of Experimental Animal Science And Human Disease Animal Models, Taiyuan 030001,China)
Objective To study the expression and significance of apoptosis-related genescaspase-3,caspase-9,BaxandBcl-2 in oral normal mucosa, oral simple hyperplasia, oral epithelial dysplasia and oral squamous cell carcinomas (OSCC) in Chinese hamsters. Methods The expressions of mRNA and protein of caspase-3, caspase-9, Bax and Bcl-2 in the oral normal mucosa, oral simple hyperplasia, oral epithelial dysplasia and OSCC tissues in Chinese hamsters were examined by immunohistochemistry and RT-PCR. Results During the process of oral carcinogenesis, the expression of Bcl-2 protein was significantly higher in OSCC than in oral normal mucosa, oral simple hyperplasia, and oral epithelial dysplasia (P<0.05). In dysplastic epithelia, the protein expressions of caspase-3, caspase-9 and Bax were more than that of normal epithelia, and along with the increased dysplasis, the expression level was decreased. Further analysis showed that expression of Bcl-2 was negatively related with the expressions of Bax, caspase-3 and caspase-9 (P<0.05). The result of RT-PCR showed thatBcl-2 was significantly increased in OSCC compared with normal mucosa, while the expressions ofcaspase-3,caspase-9 andBaxwere decreased (P<0.05). Conclusions In the Chinese hamster squamous carcinoma, the expressions ofcaspase-3,caspase-9 andBaxare reduced and theBcl-2 expression are increased, indicating that the expressions ofcaspase-3,caspase-9,BaxandBcl-2 are closely related with the occurrence and development of oral squamous cell cancinoma. This study can offer some clues for gene therapy of OSCC, or can provide a reference for evaluating the biological characteristics and prognosis of OSCC.
Chinese hamster; Oral squamous cell carcinomas(OSCC); Apoptosis
SONG Guo-hua. E-mail: ghsongg@hotmail.com
山西省实验动物专项(2014k08、2015k03)。
庞文彪 (1977-),男,硕士,研究方向:人类疾病动物模型。E-mail: 404535486@qq.com;李莉红 (1988-),女,硕士研究生,研究方向:人类疾病动物模型。E-mail: 1179407927@qq.com。# 共同第一作者
宋国华 (1973-),女,博士,主要研究方向:人类疾病动物模型。E-mail: ghsongg@hotmail.com
Q95-33
A
1005-4847(2017)03-0263-07
10.3969/j.issn.1005-4847.2017.03.006
2016-11-30
