三种方法复制“二次打击”急性呼吸窘迫综合征动物模型的比较与评价
2017-07-18姚敦琛潘龙陈秉钧余雨中李晟杰胡桂和马明明涂永生
姚敦琛,潘龙,陈秉钧,余雨中,李晟杰,胡桂和,马明明,涂永生
(广州医科大学 1.基础学院生理学教研室; 2.第三临床学院; 3.第一临床学院, 广州 511436;4.中山大学中山医学院药理学教研室, 广州 510080)
研究报告
三种方法复制“二次打击”急性呼吸窘迫综合征动物模型的比较与评价
姚敦琛1,2,潘龙1,2,陈秉钧1,2,余雨中1,2,李晟杰1,3,胡桂和1,2,马明明4,涂永生1*
(广州医科大学 1.基础学院生理学教研室; 2.第三临床学院; 3.第一临床学院, 广州 511436;4.中山大学中山医学院药理学教研室, 广州 510080)
目的 通过研究三种不同“二次打击”急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)动物模型的特点,寻找较为理想的ARDS动物模型。方法 将48只大鼠随机分为4组,每组12只。对照组(Control组):尾静脉先注射生理盐水(normal saline, NS)2.5 mL/kg,30 min后注射NS 2.5 mL/kg;油酸+油酸组(OA+OA组):尾静脉先注入OA 0.05 mL/kg,30 min后继续注射OA 0.5 mL/kg;内毒素+内毒素组(LPS+LPS组):尾静脉先注入LPS 2.5 mg/kg,30 min后继续注射LPS 2.5 mg/kg;油酸+内毒素组(OA+LPS组):尾静脉先注入OA 0.05 mL/kg,30 min后注射LPS 2.5 mg/kg。5 h后处死动物采集标本,检测动脉血气,支气管肺泡灌洗液(bronchoalveolar lavage fluid, BALF)中白细胞总数、多形核白细胞百分比(polymorphonuclear leukocyte ratio, PMN%)、肿瘤坏死因子(tumor necrosis factor α, TNF-α)水平、总蛋白含量,肺干湿重比(lung wet-dry weight ratio, W/D),观察肺组织病理改变并进行肺损伤评分。结果 与control组比较,LPS+LPS组、OA+OA组及OA+LPS组的氧分压(PaO2)下降(P<0.05)、二氧化碳分压(PaCO2)、BALF中白细胞总数、PMN%、TNF-α、总蛋白含量,W/D、肺损伤评分均升高(P<0.05)。OA+LPS组总蛋白含量、W/D均高于LPS+LPS组,差异有显著性(P<0.05),而与OA+OA组比较则差异无显著性;OA+LPS组BALF中白细胞计数、PMN%、TNF-α较OA+OA组高(P<0.05),而与LPS+LPS组比较则差异无显著性;OA+LPS组肺病理改变最典型,肺损伤评分最高。结论 OA+OA、LPS+LPS和OA+LPS复合打击法均可建立“二次打击”ARDS大鼠模型,其中OA+LPS复合打击法所复制的ARDS模型与临床ARDS特点更为接近,有利于研究ARDS的病理生理过程,是一种较为理想的“二次打击”ARDS动物模型。
急性呼吸窘迫综合征;“二次打击”模型;油酸;内毒素
急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)是一种临床上常见的急性低氧性呼吸功能不全的疾病,晚期表现为进行性呼吸窘迫和顽固性低氧血症,其发病机制、病理生理过程等至今尚未完全阐明。因此,ARDS动物模型的建立对于研究其发病机制、病理生理改变、治疗、预防等方面的实验研究有重要意义。临床中ARDS的发生、发展通常由多种致病因素接连导致。目前研究认为ARDS发病机制除原发病因造成肺部损伤外,还存在手术创伤、肠道细菌毒素入血等“二次打击”因素[1-3]。简单来说,“二次打击”的理论基础是:第一次打击(严重创伤或感染等)引起机体全身炎症反应综合征(systemic inflammatory response syndrome, SIRS),机体敏感性增高。此基础上第二次打击(创伤后感染、不恰当的复苏等)引发SIRS失控,体内炎症反应和抗炎反应失衡,机体发生ARDS,甚至多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS)。因此“二次打击”模型能更好地模拟人类的ARDS过程,建立理想的“二次打击”ARDS动物模型对于揭示ARDS的发病机制及其防治有着重要意义[4,5]。近十几年来,相关学者使用不同的方法陆续建立了多种“二次打击”ARDS动物模型,与“一次打击”模型比较,“二次打击”模型从临床表现、血气分析结果和肺病理损伤等方面更符合ARDS的诊断标准,模型也更加稳定、持久[6,7]。但还未有建立“二次打击”ARDS动物模型公认、权威的方法,至今没有学者对各种“二次打击”ARDS模型进行比较。目前ARDS模型有整肺灌洗型、盐酸吸入型、油酸型、内毒素型等[8]。其中油酸、内毒素诱导的ARDS模型被普遍应用。本研究分别采用油酸和(或)内毒素构建“二次打击”ARDS大鼠模型,观察和比较不同方法建立的“二次打击”ARDS大鼠模型的特点,了解不同方法复制的ARDS模型在发病机制上的差异,为临床治疗和研究ARDS提供可靠理想的动物模型。
1 材料与方法
1.1 材料
1.1.1 实验动物
清洁级雄性SD大鼠48只,体重200~220 g,6~8周。由广州中医药大学实验动物中心提供【SCXK(粤)2013-0034】。饲养期间给予啮齿类动物标准颗粒饲料(由实验动物中心提供)及自由饮水,恒定湿度,室温(25±2)℃。实验大鼠饲养及组织取材均在广州医科大学实验动物中心进行【SYXK(粤)2010-0104】。本实验所有操作均符合中华人民共和国《实验动物管理条例》。
1.1.2 仪器与试剂
大肠杆菌脂多糖(lipopolysaccharide, LPS),血清型O111:B4(Sigma,美国),BCA蛋白含量测定试剂盒(凯基,中国),肿瘤坏死因子(tumor necrosis factor α, TNF-α)ELISA试剂盒(伊莱瑞特,中国),油酸(oleic acid, OA),分析纯(西陇化工,中国),全自动血气分析仪(Radiometer,丹麦),全自动血细胞分析仪(Sysmex,日本)。
1.2 方法
1.2.1 动物分组及处理
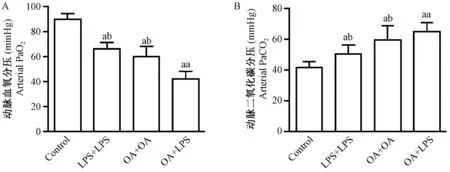
注:A:动脉血氧分压;B:动脉二氧化碳分压。与Control组比较,aP<0.05,aaP<0.01;与LPS+OA组比较,bP<0.05。图1 各组动脉血气结果比较Note. A: PaO2; B: PaCO2. aP< 0.05,aaP< 0.01, compared with the control group; bP< 0.05, compared with the OA+LPS group.Fig.1 Comparison of results of arterial blood gas analysis among the four rat groups
雄性SD大鼠48只,随机分为4组,每组12只。大鼠标记称重后用10%水合氯醛按1 mg/kg麻醉,仰位固定。对照组(Control组):尾静脉注射生理盐水5 mL/kg;油酸+油酸组(OA+OA组):尾静脉先注入OA 0.05 mL/kg,30 min后注射OA 0.5 mL/kg;内毒素+内毒素组(LPS+LPS组):尾静脉先注入LPS 2.5 mg/kg,30 min后注射LPS 2.5 mg/kg;油酸+内毒素组(OA+LPS组):尾静脉先注入OA 0.05 mL/kg,30 min后注射LPS 2.5 mg/kg。完成第二次注射后,各组于5 h后处死大鼠并采集标本。
1.2.2 血气分析
处死大鼠前经颈动脉采集动脉血1 mL,用血气分析仪测定PaO2、PaCO2值。
1.2.3 支气管肺泡灌洗液(bronchoalveolar lavage fluid, BALF)的收集及相关指标的测定
参照文献[8],收集支气管肺泡灌洗液。取部分灌洗液用于白细胞计数(white blood cell count, WBC)、多形核白细胞百分比(polymorphonuclear ratio, PMN%)。灌洗液静置后低温离心机2000 r/min离心20 min,取上清液于-80℃低温保存,待测TNF-α、总蛋白含量。TNF-α采用ELISA法测定,具体操作按试剂盒说明进行。总蛋白测定采用BCA法,绘制标准曲线,根据样品的吸光度在标准曲线上查出浓度,计量单位g/L。白细胞计数、多形核白细胞百分比测定采用血细胞分析仪。
1.2.4 肺组织干湿重比、HE染色及肺损伤评分
取左肺称重(湿重),然后至70℃恒温干燥箱烘烤2 d至恒重后称重,计算肺组织干湿重比(lung wet-dry weight ratio, W/D)。右肺中叶组织行常规HE染色,参照文献[9],进行肺损伤评分。
1.3 统计分析
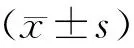
2 结果
2.1 动脉血气分析
LPS+LPS组、OA+OA组、OA+LPS组与control组相比,各实验组大鼠PaO2均有不同程度降低,PaCO2均有不同程度升高(P<0.05)。OA+LPS组与LPS+LPS组、OA+OA组相比,PaO2下降最明显,PaCO2显著升高(P<0.05),见图1。
2.2 肺水肿程度评估
致伤各组BALF中总蛋白含量和W/D均明显高于Control组(P<0.01)。其中OA+LPS组总蛋白含量、W/D均高于LPS+LPS组(P<0. 05),而与OA+OA组比较则无明显差异,见图2。
2.3 炎症反应评估
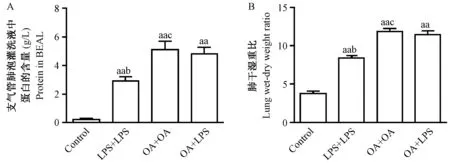
致伤各组WBC、PMN%、TNF-α与Control组比较,均显著升高(P<0.01)。OA+LPS组WBC、PMN%、TNF-α较OA+OA组高(P<0.05),而与LPS+LPS组比较则差异无显著性,见图3。
注:A:BALF中蛋白含量变化;B:肺干湿重比。与Control组比较,aP< 0.05, aaP< 0.01;与OA+ LPS组比较,bP< 0.05;与LPS+LPS组比较,cP<0.05图2 各组BALF中蛋白含量及W/D的变化Note. A: Protein in BALF; B: Lung wet-dry weight ratio. aP< 0.05,aaP< 0.01, compared with the control group,bP< 0.05, compared with the OA+LPS group,cP<0.05, compared with the LPS+LPS group. BALF:Bronchoalveolar lavage fluid.Fig.2 Changes of protein concentration in BALF and W/D among the four rat groups
注:BALF中白细胞总数(A),多形核白细胞百分比(B),肿瘤坏死因子(C)的变化。与Control组比较,aP<0.05, aaP<0.01;与OA+LPS组比较;bP<0.05,与LPS+LPS组比较,cP<0.05。图3 各组BALF中WBC,PMN%及TNF-α的变化Note.WBC (A), PMN% (B), TNF-α (C) in BALF.aP< 0.05,aaP< 0.01, compared with the control group;bP< 0.05, compared with the OA+LPS group;cP<0.05, compared with the LPS+LPS group.Fig.3 Changes of WBC, PMN% and TNF-α in BALF among the four rat groups
2.4 肺组织病理形态学观察及肺损伤评分
光镜下,各组均可见不同程度的肺组织结构破坏,肺泡腔及肺间质水肿、出血、炎症细胞浸润。LPS+LPS组主要表现为肺泡隔增宽,组织结构有保留,呈局灶性肺气肿,大量炎症细胞浸润。OA+OA组主要表现为肺泡腔内大量水肿液积聚,透明膜形成,大量红细胞聚集,组织结构仍有保留。OA+LPS组则兼顾了LPS+LPS组、OA+OA组的病理改变,既有明显的水肿液积聚,亦有明显的炎症细胞浸润,透明膜形成,组织结构严重破坏,见图4。此外,我们对各组大鼠肺组织损伤进行了评分。各实验组对比Control组,评分均明显增高(P<0.01),其中OA+LPS组评分最高,较OA+OA组、LPS+LPS组差异有显著性(P<0.05),OA+OA组和LPS+LPS组之间差异无显著性,见图5。
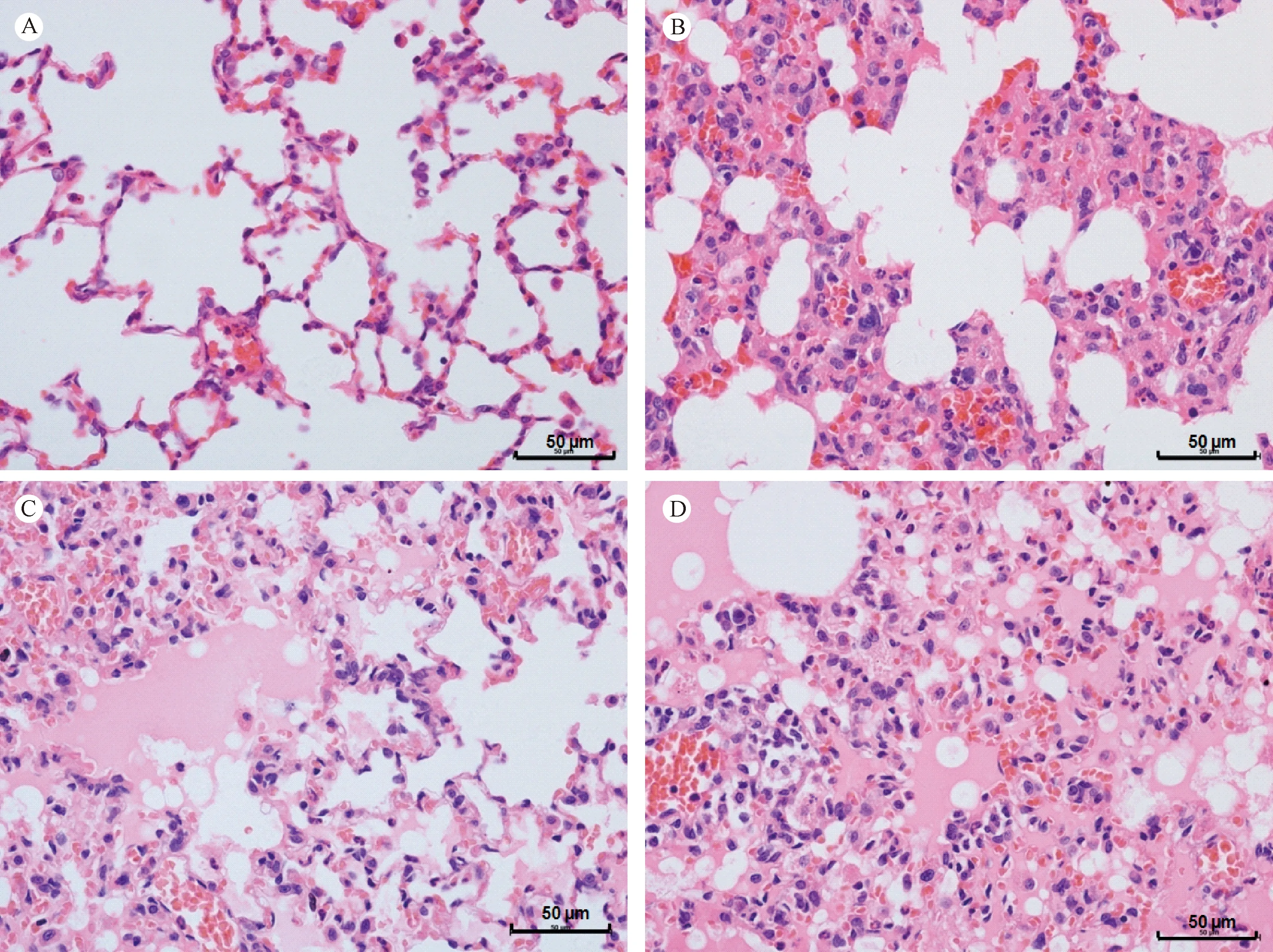
注:Control组(A):正常肺组织结构。LPS+LPS组(B):中度肺组织结构破坏,肺泡隔增宽,大量炎症细胞浸润及中等量蛋白水肿液。OA+OA组(C):中度肺组织结构破坏,肺泡隔增宽,中量炎症细胞浸润及广泛蛋白水肿液。OA+LPS组(D):重度肺组织结构破坏,重度炎症细胞浸润及广泛蛋白水肿液。代表性肺组织病理照片(HE染色)。图4 各组光镜下肺病理改变(×400)Note.Control(A): normal lung tissue structure. LPS+LPS(B): moderate destruction of lung tissue structure, widened alveolar septum, a large number of inflammatory cell infiltration and mild protein edema fluid. OA+OA(C): moderate destruction of lung tissue structure, widened alveolar septum, moderate inflammatory cell infiltration and extensive alveolar edema. OA+LPS(D): severe destruction of lung tissue structure, severe inflammatory cell infiltration and extensive alveolar edema. Representative image of lung tissue. HE staining. Figures are shown at 400x magnification.Fig.4 Pathological changes in the lung issues of the three “two-hit” animal models of ARDS
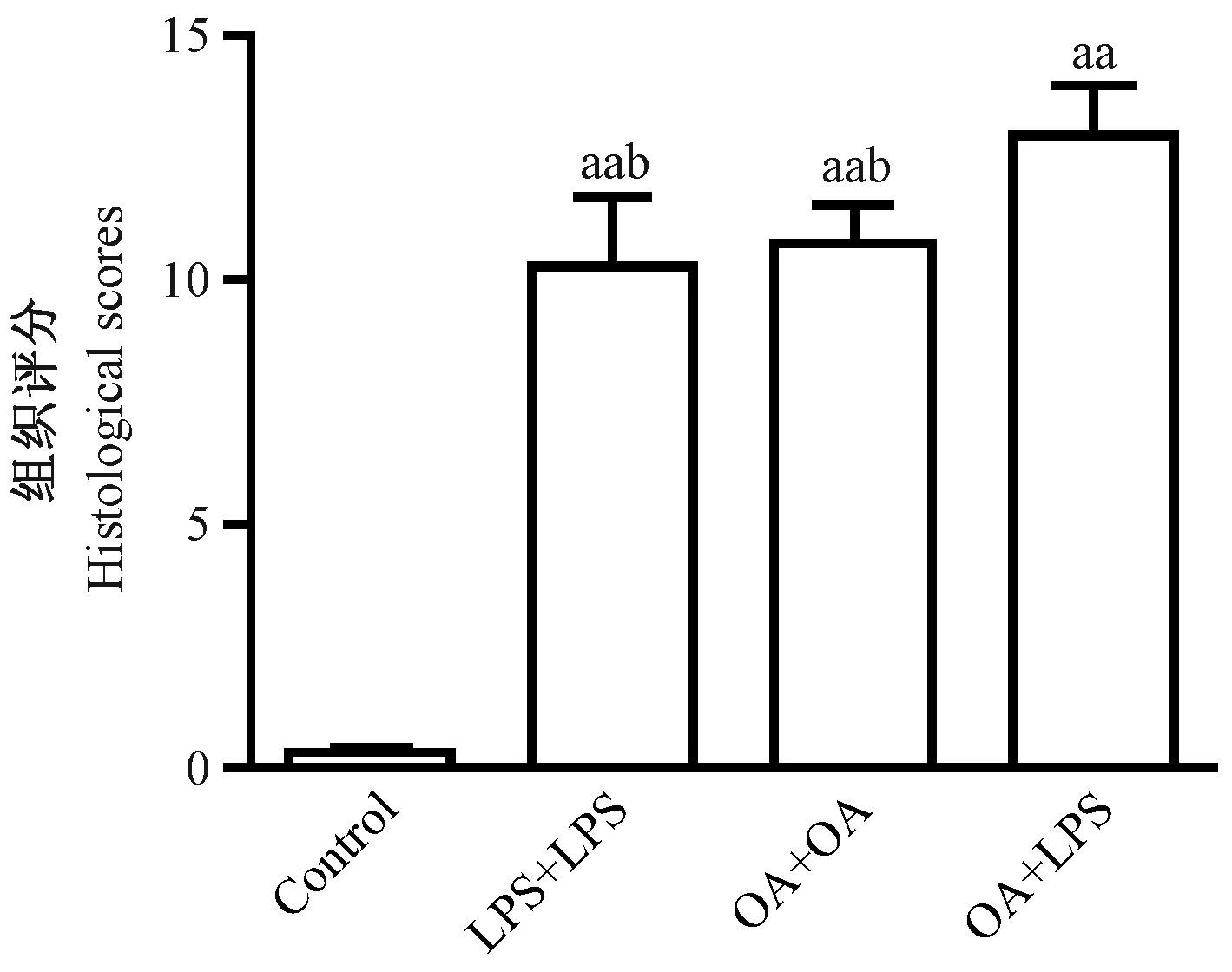
注:与Control组比较,aaP<0.01;与OA+LPS组比较,bP<0.05图5 肺组织损伤评分Note.aaP< 0.01, compared with the control group;bP< 0.05, compared with the OA+LPS group.Fig.5 Histological scores in the three “two-hit” animal models of ARDS
3 讨论
目前研究认为“二次打击”ARDS动物模型更贴近临床ARDS的发生发展。但至今为止,仍没有标准、权威的“二次打击”ARDS建模。本研究采用三种不同方法构建“二次打击”模型,我们发现LPS+LPS组主要以引起肺组织炎症反应为主,OA+OA组主要以导致肺血管通透性增加,引起肺水肿为主,而OA+LPS组结合了前两组的特点,更加符合临床上ARDS的特点。
本研究造模后三组实验大鼠均出现呼吸急促、窘迫,四肢发绀,PaO2下降、PaCO2升高,BALF中WBC、PMN%、TNF-α、蛋白含量及W/D、肺损伤病理评分均显著升高,而光镜下则可见各组不同程度不同形态的肺损伤,表明三种方法均建模成功。
炎症反应是ARDS发生发展的中心环节,其中PMN是主要的炎症细胞,而TNF-α则是主要的炎症因子[10]。而BALF中蛋白含量的变化及W/D则是反映肺水肿程度的指标,两者数值的升高均是肺毛细血管通透性增加的结果。本研究发现LPS+LPS组BALF中WBC、PMN%、TNF-α最高,与OA+OA组比较升高明显,而与OA+LPS组无明显差异。与之相反,OA+OA组蛋白含量及W/D最高,与LPS+LPS组比较显著升高,而较OA+LPS组无明显差异。这种差异提示OA和LPS不同的致病机制。有研究表明,油酸对血管内皮细胞有直接毒性作用,静脉注射OA通过刺激肺动脉血管收缩、直接损伤肺泡毛细血管内皮细胞和抑制钠离子通道[11-13]。从而导致肺血管通透性增加、大量蛋白水肿液渗出,肺泡内液体重吸收障碍,促进ARDS的发生。而LPS对肺的直接损伤较小[14,15],LPS作为内毒素的主要成分,进入机体后激活巨噬细胞释放促炎因子如TNF-α等,趋化并激活PMN,使大鼠机体处于一种SIRS状态,同时肺作为最敏感的器官之一,最先受到损伤,而肺损伤又进一步招募PMN、趋化各种炎症因子聚集到肺组织中,促使ARDS的形成[16]。因此OA相比于LPS以破坏大鼠肺血管内皮细胞为主,导致肺血管通透性增加,水肿液渗出,而LPS较OA以不受控制的炎症级联反应为主,导致肺部炎症反应。这点在肺组织病理形态的改变中表现得更加直观。LPS+LPS组肺组织中大量炎症细胞聚集,而水肿液较少;OA+OA组肺组织中大量水肿液聚集,而炎症细胞较少;而OA+LPS组肺组织中既有较多的水肿液聚集,又有较多的炎症细胞浸润。这也导致肺组织结果严重破坏,肺换气功能障碍乃至衰竭,反映在血气分析上则表现为OA+LPS组PaO2值最低、PaCO2值最高。
综上所述,三种方法建立“二次打击”ARDS动物模型,但在炎症机制、蛋白渗漏及病理方面均存在一定的差异,说明ARDS的发生发展与其致病因素密切相关。OA主要以肺组织局部损伤为主,未见其对心脏、脑组织的直接损伤[17],而LPS主要以全身内毒素血症为主,对心脏、脑、肝、肾等各靶器官均有不同程度的损伤[18-20]。油酸+内毒素型ARDS模型结合了油酸以及内毒素两者对肺损伤的不同机制,先后静脉注射的内毒素和油酸产生协同作用,该模型拥有肺毛细血管通透性显著增高及肺内大量炎症细胞浸润的病理生理特点,同时弥补了油酸+油酸型及内毒素+内毒素型肺损伤模型的各自不足,在发病机制、病理改变上更接近临床ARDS的发生发展过程,适用于对ARDS不同发病机理的研究,是一种较为理想的“二次打击”ARDS动物模型。
[1] 于振香,刘喜春,赵雪俭.人参二醇组皂苷对抗二次打击诱导大鼠急性肺损伤[J].中国病理生理杂志,2008,24: 2402-2406.
[2] 王占海,沈凌鸿,陈向东.水飞蓟素对脂多糖性大鼠急性肺损伤的拮抗作用[J].中国病理生理杂志,2007,23: 280-283.
[3] Mattthay MA, Zimmerman GA, Esmon C, et al. Future research directions in acute lung injury:summary of a National Heart, Lung, and Blood Institute Working Group[J]. Am J Respir Crit Care Med, 2003, 167:1027-1035.
[4] Mikawa K, Nishina K, Takao Y, et al. ONO-1714, a nitric oxide synthase inhibitor, attenuates endotoxin-induced acute lung in rabbits[J]. Anesth Analg, 2003, 97:1751-1755.
[5] Lang JD, Hickman-Davis JM. One-hit... is there really any benefit? [J]. Clin Exp Immunol, 2005, 141:211-214.
[6] 李玉梅,卫洪昌,俞小宛,等.内毒素“二次打击”顽固性低氧血症大鼠ARDS模型建立与评价[J].中国病理生理杂志,2009,25: 2235-2239.
[7] Voelker MT, Fichtner F,Kasper M, et al. Characterization of a double-hit murine model of acute respiratory distress syndrome[J].Clin Exp Pharmacol, 2014, 41:844-853.
[8] Matute-Bello G,Frevert CW, Homas R. Martin TR, et al.Animal models of acute lung injuryJ]. Lung Cell Mol Physiol, 2008, 295(3):3354-3355.
[9] 潘龙,姚敦琛,余雨中,等.程序性坏死参与油酸诱导的大鼠急性呼吸窘迫综合征的发病过程[J].生理学报,2016,68: 661-668.
[10] 谢仰民,陈韩秋,陈穗,等.大鼠急性呼吸窘迫综合征动物模型的建立[J].中国实验动物学报,2002,10:244-246.
[11] Pierrakos C, Karanikolas M, Scolletta S, et al. Acute respiratory distress syndrome: pathophysiology and therapeutic options[J]. J Clin Med Res, 2011, 4: 7-16.
[12] Wang HM, Bodenstein M, Markstaller K. Overview of the pathology of three widely used animal models of acute lung injury[J]. Eur Surg Res, 2008, 40: 305-316.
[13] Goncalves-de-Albuquerque CF, Burth P, Silva AR,et al. Oleic acid inhibits lung Na/K-ATPase in mice and induces injury with lipid body formation in leukocytes and eicosanoid production[J]. J Inflamm (Lond), 2013, 10:1.
[14] Ghosh S, Wilson MR, Choudhury S, et al. Effects of inhaled carbon monoxide on acute lung injury in mice[J]. Am J Physiol Lung Cell Mol Physiol, 2005, 288:L1003-L1009.
[15] Rojas M, Woods CR, Mora AL, et al. Endotoxin -induced lung injury in mice: structural, functional, and biochemical responses[J]. Am J Physiol Lung Cell Mol Physiol, 2005, 288: L333-L341.[16] Zhou ZH, Kozlowski J, Schuster DP. Physiologic, biochemical, and imaging characterization of acute lung injury in mice[J].Am J Resp Crit Care Med, 2005, 172:344-351.
[17] Matute-Bello G, Frevert CW, Martin TR. Animal models of acute lung injury[J]. Am J Physiol Lung Cell Mol Physiol, 2008, 295: L379-399.
[18] 周发春.大鼠油酸型ARDS肺、心、脑的形态学改变及机理探讨[D]. 重庆:重庆医科大学,2003:1-46.
[19] 裴卉,张宇忠,吴海燕,等.四逆汤对内毒素性休克大鼠脑组织肿瘤坏死因子-α及超氧化物歧化酶的影响[J].中华中医药杂志,2009,6: 728-730.
[20] 李钦,刘晓青,代蓉,等.内毒素诱导大鼠感染性休克模型复制的探索[J].中国临床研究, 2016, 29(7): 865-868.
[21] 吴小红,郭彦,刘晨风,等.LPS/D-GalN诱导小鼠急性肝损伤模型的建立[J].中国实验动物学报,2014,22(3):15-19.
Comparison and evaluation of three “two-hit” animal models of acute respiratory distress syndrome induced by different methods
YAO Dun-chen1,2,PAN Long1,2,CHEN Bing-jun1,2,YU Yu-zhong1,2,LI Sheng-jie1,3,HU Gui-he1,2,MA Ming-ming4,TU Yong-sheng1*
(1. Department of Physiology, School of Basic Sciences; 2. The Third Clinical College; 3. The First Clinical College, Guangzhou Medical University, Guangzhou 511436, China; 4. Department of Pharmacology, Zhongshan School of Medicine, Sun Yat-sen University, Guangzhou 510080)
Objective To find an ideal animal model of acute respiratory distress syndrome (ARDS) through investigating the characteristics of three “two-hit” animal models of ARDS. Methods Forty-eight SD rats were randomly divided into 4 groups: Control group [2.5 mL/kg normal saline (NS) i.v. given at 0 min and 30 min]; OA+OA group [0.5 mL/kg oleic acid (OA) i.v. given at 0 min and 30 min]; LPS+LPS group [2.5 mg/kg lipopolysaccharide (LPS) i.v. given at 0 min and 30 min]; and OA+LPS group [0.5 mL/kg OA i.v. given at 0 min and 2.5 mg/kg LPS, i.v. given at 30 min]. The samples were collected at 5 h after the second drug injection. White blood cells count (WBC), polymorphonuclear leukocyte ratio (PMN%), total protein concentration, tumor necrosis factor α (TNF-α) level in bronchoalveolar lavage fluid (BALF), arterial blood gas analysis and lung wet-dry weight ratio (W/D) were measured, respectively. Pathological changes in the lung tissues were observed and histological scores were evaluated. Results Compared with those in the control group, PaCO2,WBC, PMN%, total protein concentration and TNF-α levels in BALF were significantly increased, while PaO2was dramatically decreased (P<0.01) in the OA+OA, LPS+LPS and OA+LPS groups. The levels of protein concentration in BALF and lung W/D ratio in the OA+LPS group were significantly higher than these in the LPS+LPS group (P<0.05 for all), but had no statistically significant difference compared with these in the OA+OA group. The levels of WBC, PMN% and TNF-α in BALF in the OA+LPS group were significantly higher than those in the OA+OA group (P<0.05), but not significantly different from those in the LPS+LPS group. The most typical pathological changes and the highest pathological scores were found in the OA+LPS group. Conclusions All the three different methods including OA+OA, LPS+LPS, and OA+LPS can be used to establish “two-hit” animal models of acute respiratory distress syndrome. The “two-hit” animal model of acute respiratory distress syndrome induced by OA+LPS is more closer to clinical ARDS and is useful for studies on the pathophysiology of ARDS, and is an ideal “two-hit” animal model of ARDS.
Acute respiratory distress syndrome; “Two-hit” animal model; Oleic acid; Lipopolysaccharide;
TU Yong-sheng. E-mail: tuys@gzhmu.edu.cn
国家自然科学基金(编号:81302771);广东省医学科学研究基金(编号:A2016382);广东省自然科学基金(编号:2014A030313087);国家级大学生创新创业训练计划项目(编号:2015105700010);广州医科大学大学生科技创新项目(编号:2014A015)。
姚敦琛(1993-),男,研究方向:实验动物模型建立。Email: 823818504@qq.com;潘龙(1994-),男,研究方向:实验动物模型建立。Email: 763552698@qq.com。共同第一作者
涂永生(1976-),男,副教授,研究方向:呼吸系统相关疾病的研究。Email: tuys@gzhmu.edu.cn
Q95-33
A
1005-4847(2017) 03-0235-06
10.3969/j.issn.1005-4847.2017.03.002
2016-11-14
