小鼠慢性骨盆疼痛综合征模型与机械痛阈及自噬水平的相关性探索
2017-07-18韦丽娟韦苏益胡艳玲雷丹青
韦丽娟,韦苏益,胡艳玲,雷丹青*
(1. 广西医科大学生命科学研究院, 南宁 530021;2. 桂林医学院生物技术学院,广西 桂林 541100)
研究报告
小鼠慢性骨盆疼痛综合征模型与机械痛阈及自噬水平的相关性探索
韦丽娟1,韦苏益2,胡艳玲1,雷丹青1*
(1. 广西医科大学生命科学研究院, 南宁 530021;2. 桂林医学院生物技术学院,广西 桂林 541100)
目的 构建慢性骨盆疼痛综合征前列腺炎(chronic prostatitis /chronic pelvic pain syndrome, CP/CPPS)C57BL/6小鼠模型,探索其机械痛阈和自噬相关微管轻链蛋白LC3和底物蛋白p62表达水平随造模时间的变化规律,为CP/CPPS疼痛及自噬水平研究提供动物实验依据。方法 将36只雄性C57BL/6小鼠随机均分为空白组、对照组和模型组,模型组小鼠皮下多点注射大鼠前列腺蛋白提取液和完全弗式佐剂的混悬液,建立CP/CPPS小鼠模型。通过HE染色观察前列腺病理变化,运用Von Frey纤维丝测定骨盆区域机械痛阈,通过免疫组化染色检测LC3和p62表达水平,运用Image Pro Plus 6.0软件计算平均光密度。结果 HE染色可见模型组小鼠出现慢性前列腺炎,表现为不同程度的上皮增生和淋巴细胞侵润,且实验后第6个月前列腺出现上皮内瘤(prostatic intraepithelial neoplasia,PIN),表现为基底膜消失和细胞核异形性明显等,空白组和对照组则表现为正常组织学形态。与空白组及对照组相比,模型组机械痛阈随造模时间延长逐渐降低[初始痛阈值为(0.35±0.154)g,第22周为(0.008±0.000)g],差异有显著性(P<0.05)。其LC3和p62表达水平逐渐增高[LC3,p62平均光密度值分别为,第1个月:(2.767±0.464)%,(2.872±1.642)%;第6个月:(13.501±1.900)%,(9.070±0.490)%],差异有显著性(P<0.05)。结论 成功建立了CP/CPPS模型,且造模后第6个月出现PIN。模型组小鼠机械痛阈随造模时间的延长逐渐降低,LC3和p62表达逐渐增高,表明CP/CPPS炎症微环境促进疼痛产生及加剧,并提高小鼠前列腺自噬水平,与PIN的发生发展密切相关。
慢性骨盆疼痛综合征;C57BL/6小鼠;机械痛阈;自噬
慢性骨盆疼痛综合征前列腺炎(chronic pelvic pain syndrome/chronic prostatitis, CP/CPPS)是成年男性最常见的泌尿系统疾病之一,约占慢性前列腺炎患者的90%~95%[1,2],但其发病机制并不十分明确。患者特征性临床表现为药物治疗无效的持续性盆腔会阴区域疼痛,排尿困难,性功能障碍等,导致患者生活质量严重下降[3]。已有研究表明,慢性炎症微环境可促进前列腺组织增生及细胞因子表达异常等,从而诱导肿瘤和癌症的发生与发展[4]。目前,肿瘤和癌症与自噬的相关研究已引起广泛关注。活跃的自噬在炎症反应中可能会损伤机体细胞从而破坏内环境稳定[5]。微管轻链蛋白3(microtubule-associated protein 1 light chain 3,LC3)和底物蛋白(sequestosome 1/SQSTM1,又称p62)是重要的自噬标志物,且有研究报道LC3表达量与前列腺癌的Gleason评分呈正相关[6, 7]。为了深入研究前列腺炎和疼痛及自噬水平的关系,增加对前列腺肿瘤和癌症的发生发展机制的认识,本研究通过建立慢性骨盆疼痛综合征前列腺炎C57BL/6小鼠模型,运用HE染色检测前列腺组织的病理变化,使用von Frey纤维丝测痛仪对小鼠下腹盆腔区域进行刺激,以获得机械痛阈[8],并且通过运用免疫组化检测自噬微管相关轻链蛋白LC3和底物蛋白p62蛋白在小鼠前列腺组织中的表达水平,初步探索其自噬程度,为慢性骨盆疼痛综合征前列腺炎疼痛及自噬研究提供动物实验依据,并为前列腺相关疾病的临床治疗研究提供一条实验性途径。
1 材料与方法
1.1 材料
1.1.1 动物
SPF级9~11周龄雄性C57BL/6小鼠36只,体重25~30 g, 购于南京君科生物工程有限公司【SCXK(苏)2011-0003】,饲养于广西医科大学动物医学实验中心SPF级环境【SYXK(桂)2014-0002】。室温(20~26)℃,相对湿度(40~70)%,光照12 h,黑暗12 h;塑料笼大小为400 mm×350 mm×200 mm,6只/笼,自由饮水和摄食。动物管理和实验研究均达到广西医科大学实验动物管理与伦理委员会要求。
1.1.2 主要试剂
完全弗式佐剂(#F5881,Sigma,美国); 细胞膜蛋白与细胞浆抽提试剂盒(#P0033,碧云天,中国);LC3B小鼠单克隆抗体(#L7543,Sigma,美国);p62小鼠单克隆抗体(#ab56416,Abcam,英国)。
1.1.3 实验仪器
Von Frey纤维丝测痛仪(Ugo Basile Srl,意大利);疼痛检测钢丝笼30 cm × 15 cm × 15 cm;手提式压力蒸汽灭菌器(申安,中国);低温冷冻离心机(Eppendorf,德国);全波长读数仪器(Thermo Fisher Scientific,美国);KQ5200E型超声波清洗器(昆山,中国);冷冻干燥机(松源华兴,中国); Olympus BX53正置荧光显微镜(奥林巴斯株式会社,日本)。
1.2 实验方法
1.2.1 前列腺蛋白提纯液制备
取3只SPF级体重为250~300 g雄性性成熟SD大鼠,在无菌条件下处死并进行解剖,将前列腺组织与附着的脂肪和结缔组织分离干净,然后将其放入灭菌的冷生理盐水中冲洗。用剪刀尽量小心剪切成细小的组织碎片,运用细胞膜蛋白与细胞浆抽提试剂盒提取前列腺总蛋白,再用冷冻干燥机将其制备成冻干粉末,储存于-80℃冰箱。临用前将前列腺蛋白冻干粉与适量无菌双蒸水混合,制成1.0 mg/mL前列腺蛋白提纯液。取适量提纯液经LB固体培养基37℃培养24 h,无明显菌落出现。
1.2.2 动物造模
36只9~11周龄雄性C57BL/6小鼠,体重25~30 g,随机均分为空白组,对照组和模型组(每组12只)。模型组小鼠使用1%戊巴比妥钠溶液腹腔麻醉后,每只多点皮下注射(点数≥6)前列腺蛋白提纯液与CFA(等比混匀)混悬液200 μL。对照组小鼠在相同条件下,腹腔麻醉、多点皮下注射CFA与无菌双蒸水(等比混匀)混悬液200 μL。空白组小鼠不做任何处理。
1.2.3 体重测定
于实验开始第0天起,每个月使用电子天平对各组小鼠体重进行测定并记录,制成体重变化曲线。
1.2.4 机械性异常痛敏测定
在安静环境下,将小鼠置于疼痛检测钢丝笼里,适应10 min 后,采用von Frey纤维丝触压各组小鼠的下腹部,每次测定均从轻到重水平,即0.008 g 到4 g。痛阈测定包括10次刺激,每次进行10 s,两次刺激间隔15 s。刺激时出现腹部尖锐隆起,瞬间舔抓或者跳跃列则为阳性表现,记录纤维丝的压力值,即疼痛阈值(g)[9]。
1.2.5 前列腺组织光镜检查
每组每次处死6只小鼠,即造模第1个月随机处死,第6个月全部处死。并立即解剖,分离前列腺组织,用生理盐水漂洗的小鼠前列腺组织后用滤纸吸干,放入4%多聚甲醛溶液中固定并石蜡包埋,常规切片后进行HE染色,光镜下观察间质与实质的组织病理学改变。
1.2.6 免疫组化
组织脱蜡入水,3% H2O2去除内源性过氧化物酶活性30 min,室温下PBS浸洗5 min ×3, 0.01 mol/L枸橼酸缓冲液(pH6.0)高压修复10 min,BSA 37℃封闭1 h;分别孵育一抗LC3(1∶1000),p62(1∶1000)4℃湿盒内孵育过夜,PBS 振洗10 min ×3;加生物素标记的羊抗鼠/兔lgG 37℃10 min,PBS 洗5 min ×3;加链霉卵蛋白素-过氧化氢酶37℃10 min,PBS振洗5 min ×3; 0.1% DAB显色1 min,苏木素对比染色,显微镜下观察染色情况。运用Image Pro Plus 6.0软件计算各组前列腺免疫组化平均光密度值(Average IOD,%)[10]。
1.2.7 统计学分析
运用GraphPad Prism 5统计软件进行双因素方差分析(Two-way ANOVE analysis),P< 0.05为差异有统计学意义。
2 结果
2.1 体重变化
如图1所示,从实验开始第0天起,每组小鼠体重都呈现稍微上升的趋势,与空白组及对照组比较,可以看出模型组小鼠体重增长较为缓慢,双因素方差统计结果显示,除第3个月模型组与空白组之间差异有显著性[(29.267±1.029)g vs.(32.077± 0.874)g,P<0.05)]之外,其他时间点各组间差异无显著性。

图1 C57BL/6小鼠体重变化 Fig.1 Changes of body weight in the mice at different time points
2.2 机械性异常痛敏的变化
由图2可知,各组小鼠机械痛阈值逐渐降低,模型组与对照组和空白组相比,其机械痛阈显著降低。实验后第1~22周,模型组与空白组相比,每个时间点差异有显著性(P<0.05);而与对照组相比,差异显著性存在于实验后第2、3、6、14周(P<0.05)。
2.3 前列腺组织学变化
奥林巴斯显微镜下观察发现空白组和对照组前列腺组织结构完整,腺腔内有粉染的分泌物,腺泡间纤维及平滑肌正常分布,腺腔及间质内无炎症细胞侵润,无充血和水肿;实验后第1个月解剖的6只模型组小鼠前列腺组织均出现慢性炎症症状。病理变化为腺腔扩张增大,腔内可见分泌物,血管扩张充血,腺泡上皮细胞乳头状增生明显,间质明显纤维化且有大量淋巴细胞和浆细胞。实验后第6个月,发现解剖的6只模型组小鼠中,5只小鼠前列腺组织局部腺体出现基底膜消失,细胞核异形性明显,核大深染且存在核裂像,表明该炎症促进前列腺上皮内瘤的发生(图3)。
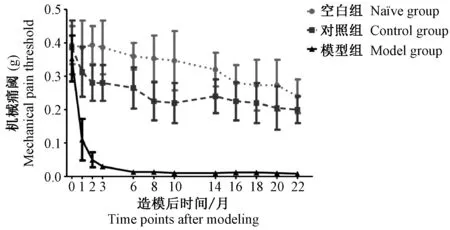
图2 C57BL/6小鼠机械痛阈变化 Fig.2 Changes of mechanical pain threshold in the mice at different time points
2.4 自噬相关微管轻链蛋白LC3和底物蛋白p62蛋白在小鼠前列腺组织中表达水平的变化
通过免疫组化检测及Image Pro Plus 6.0软件计算,与空白组及对照组比,模型组小鼠前列腺组织自噬相关微管轻链蛋白LC3和底物蛋白p62蛋白表达水平均显著增高(图4),第1个月平均光密度值为[模型组vs.对照组vs.空白组:(2.767±0.464)% vs. (0.227±0.091)% vs. (0.087±0.040)%,LC3,P<0.05;(2.87±1.64)% vs. (0.693±0.184)% vs. (0.276±0.078)%,p62,P<0.05],第6个月平均光密度值[模型组vs.对照组vs.空白组为:(13.501±1.900)% vs. (0.693±0.184)% vs. (0.276±0.078)%,LC3,P<0.05;(9.07±0.49)% vs. (0.651±0.043)% vs. (0.307±0.030)%,p62,P<0.05],表明慢性炎症微环境下自噬行为活跃(图5)。

注:实验后第1及第6个月:A.和D. 空白组;B.和E. 对照组;C.和F. 模型组 图3 C57BL/6小鼠前列腺组织病理图(HE, ×400)Note.1M/6M: A.& D. Naïve group; B.& E. Control group; C.& F. Model group Fig.3 Histopathological changes in the prostate tissues of the mice

注:实验后第1及第6个月LC3:A.和G. 空白组;B.和H. 对照组;C.和I. 模型组实验后第1及第6个月p62:D.和J. 空白组;E.和K. 对照组;F.和L. 模型组。 图4 C57BL/6小鼠前列腺组织LC3、p62免疫组化结果(ICH, ×400)Note. 1M/6M, LC3: A.& G. Naïve group; B.& H. Control group; C.& I. Model group 1M/6M, p62: D.& J. Naïve group; E.& K. Control group; F.& L.Model group. Fig.4 Immunohistochemical images of LC3 and p62 stained prostate tissues of the mice

注:与空白对照组及对照组比较:*P<0.05,**P<0.01,***P<0.001。 图5 C57BL/6小鼠前列腺组织LC3和p62免疫组化平均光密度(ICH, ×400)Note. Compared with the control group,*P<0.05,**P<0.01,***P<0.001. Fig.5 Average IOD of LC3 and p62 immunohistochemical staining in the mouse prostate tissues
3 讨论
目前CP/CPPS发病机制仍未明确,可能与病原体感染、尿液返流、免疫异常、心理压力等多因素有关。近年来全身或局部原因所致的免疫紊乱这一病因逐渐被大多数学者接受和重视,并成为CP/CPPS研究热点[11, 12]。动物模型通过复制人类疾病从而促进医学发展,其在探讨发病机制或改进治疗方法中都起着重要作用[13]。C57BL/6小鼠常用于制作CP/CPPS动物模型,其自发性、年龄依赖性前列腺炎病理学改变与人类CP/CPPS相似[14]。本研究利用大鼠前列腺蛋白提纯液做为自身免疫抗原,成功构建了C57BL/6小鼠CP/CPPS模型(成模率,100%),模型组小鼠造模后的活动减少,毛色暗淡,对抓捕反应敏感,免疫部位出现轻度红肿并逐渐硬结肿块。HE染色结果显示实验后第1个月,模型组小鼠前列腺组织出现明显炎症症状。且实验后第6个月可观察到PIN的发生。这些现象表明本实验构造的C57BL/6小鼠CP/CPPS模型很好地模拟了人类CP/CPPS,并说明了CP/CPPS与PIN的发生发展密切相关,为前列腺炎发病机制及临床用药提供实验动物基础。
疼痛症状是CP/CPPS患者主要临床症状,患者通常感觉会阴部或前列腺区域存在坠胀感、酸胀痛甚至剧痛[15]。该症状被认为是一种保护性机制,指引疼痛者采取相应措施来终止或避免疼痛的产生。然而疼痛机制十分复杂,Breaser 等[16]建立了NOD,C57BL/6 和BALB/c三种实验性自身免疫前列腺炎小鼠模型,结果显示三种小鼠多种炎症因子表达水平及慢性疼痛水平显著升高,其中NOD和C57BL/6小鼠升高的趋势比BALB/c小鼠明显。Stephen等[17]IL-17表达水平与疼痛的发展呈正相关,认为细胞因子参与了CP/CPPS所致的慢性疼痛。由于无法直接定量评估动物的自发痛,机械测痛法被认为是定量衡量疼痛的较好检测方式之一,故当动物受刺激后出现腹部退缩,瞬间舔抓或者跳跃列行为时,均提示其已出现自发痛。本研究采用Von Frey 纤维丝测痛仪刺激小鼠骨盆区域,获得机械性异常痛敏。结果发现与空白组及对照组相比,模型组小鼠的机械痛阈从第2周开始多个时间点出现显著差异,表明CP/CPPS炎症微环境促进疼痛产生及加剧疼痛的进展。该实验进一步证明了机械测痛法是定量衡量疼痛阈值的较好的检测方法。
自噬是真核生物细胞特有的一种代谢方式,自噬体双层膜结构的由Atg12 和LC3两个核心体系构成[18]。此外LC3 蛋白是自噬膜延伸所需的第二套系统,其与自噬体衔接蛋白(包括p62 和NBR1)一段特殊的LI-R结构域结合,调节自噬体的形成[19]。正常生理条件下,细胞内自噬水平低,在饥饿、缺血/ 缺氧、感染等因素的诱导下,细胞启动自噬,降解清除受损细胞器、蛋白质聚集物等危险物质,以增强自身生存力,但过度的自噬能够诱导细胞发生程序性死亡[20, 21]。已有研究发现克罗氏病和脓毒症中自噬水平显著升高[22, 23]。本次研究通过免疫组化实验发现,LC3和p62两个重要自噬标志物在模型组小鼠前列腺组织中表达水平显著增高,表明长期CP/CPPS炎症微环境促进自噬水平的提高,且活跃的自噬行为常出现于PIN的发生部位,因此本实验显示,有效地调控自噬水平与治疗前列腺肿瘤和癌症相关。
综上所述,本研究成功建立了CP/CPPS小鼠模型(成模率6/6,即100%),且造模后第6个月出现前列腺PIN(成模率5/6,即83.3%)。模型组小鼠机械痛阈值随造模时间的延长逐渐降低,异常痛敏增高,LC3和p62表达逐渐增高。这些现象表明CP/CPPS炎症微环境促进疼痛产生及加剧,并提高小鼠前列腺组织自噬水平,与小鼠前列腺肿瘤和癌症的发生发展密切相关。然而疼痛和自噬参与肿瘤和癌症发生发展的机制十分复杂,且C57BL/6小鼠与人类为不同种属,因此仍需从多方面进行深入探索,进而为人类前列腺相关疾病提供新的治疗方案。
[1] Liao CH, Lin HC, Huang CY. Chronic prostatitis/chronic pelvic pain syndrome is associated with irritable bowel syndrome: A population-based study [J]. Scient Reports, 2016, 6: 26939.
[2] Qi X, Han L, Liu X, et al. Prostate extract with aluminum hydroxide injection as a novel animal model for chronic prostatitis/chronic pelvic pain syndrome [J]. Basic Translat Sci, 2012, 80(6):1389.e9-15.
[3] Haverkamp JM, Charbonneau B, Crist SA, et al. An inducible model of abacterial prostatitis induces antigen specific inflammatory and proliferative changes in the murine prostate [J]. Prostate, 2011, 71(11): 1139-1150.
[4] Kwon OJ, Zhang L, Ittmann MM, et al. Prostatic inflammation enhances basal-to-luminal differentiation and accelerates initiation of prostate cancer with a basal cell origin [J]. Proc Natl Acad Sci U S A, 2014, 111(5): E592-600.
[5] 蔡永青,胡建辉,李小丽. 炎症因子调节细胞自噬的研究进展 [J]. 免疫学杂志,2014,32(9): 821-824.
[6] 王红群,李道旺,吴正升. LC3A蛋白在前列腺癌中的表达及意义 [J]. 中华男科学杂志,2014,20(2): 142-146.
[7] 古艳婷,赵婷婷,李平,等. 二氢生物喋呤还原酶参与调控HEK293T细胞自噬作用的初步研究 [J]. 2012,22(11): 1-5.
[8] Wong L, Done JD, Schaeffer AJ, et al. Experimental autoimmune prostatitis induces microglial activation in the spinal cord [J]. Prostate, 2015, 75(1): 50-59.
[9] Altuntas CZ, Daneshgari F, Veizi E, et al. A novel murine model of chronic prostatitis/chronic pelvic pain syndrome (CP/CPPS) induced by immunization with a spermine binding protein (p25) peptide [J]. Am J Physiol Regul Integr Comp Physiol, 2015, 304(6): R415-R422.
[10] Chen T, Wang C, Wu F, et al. Altered localization of p120 catenin in the cytoplasm rather than the membrane correlates with poor prognosis in esophageal squamous cell carcinoma [J]. PLoS One, 2015, 10(3): e0118645.
[11] 韩蕾,周晓辉. 慢性非细菌性前列腺炎动物模型的研究进展 [J]. 中国实验动物学报, 2008,16(2):157-159.
[12] 周莉,骆永伟,王永,等. 雌激素诱导SD大鼠前列腺炎与内环境改变的关系 [J]. 中国比较医学杂志,2014,24(2): 33-38.[13] 宋国宏,艾斯卡尔·吐拉洪,何丽娟,等. 自身免疫性前列腺炎大鼠机械痛阈变化的研究 [J]. 中华男科学杂志,2014,20(6): 490- 494.
[14] 李天赋,李卫巍,夏欣一,等. 慢性前列腺炎动物模型研究进展 [J]. 中华男科学杂志,2013,19(12): 1124-1128.
[15] Lin G, Reed-Maldonado AB, Lin M, et al. Effects and mechanisms of low-intensity pulsed ultrasound for chronic prostatitis and chronic pelvic pain syndrome [J]. Int J Mol Sci, 2016, 17(7): 1057.
[16] Breser ML, Motrich RD, Sanchez LR, et al. Chronic pelvic pain development and prostate inflammation in strains of mice with different susceptibility to experimental autoimmune prostatitis [J]. Prostate, 2016. 77(1): 94-104.
[17] Murphy SF, Schaeffer AJ, Done J, et al. IL17 mediates pelvic pain in experimental autoimmune prostatitis (EAP) [J]. PLoS One, 2015, 10(5): e0125623.
[18] 张创杰, 张连峰, 周琳. 自噬相关蛋白Beclin1、LC3和P62在进展期胰腺癌中的表达及临床意义 [J]. 世界华人消化杂志,2015,23(2): 318-323.
[19] 刘玉文,蒋长斌. 细胞自噬与炎症小体间的相互调控作用 [J]. 广东医学, 2014,35(14): 2285-2287.
[20] 刘烨,余娇,蔡艳星,等. 自噬在炎症性疾病中的研究进展 [J]. 中华危重病急救医学,2015,27(6): 527-529.
[21] 金贺,王蓉. 阿尔茨海默病: 自噬与β 淀粉样肽关系的研究进展 [J]. 中国比较医学杂志,2015,25(8): 68-75.
[22] 罗继壮,盛欣成,易静. 自噬相关基因多态性与克罗恩病 [J]. 中国细胞生物学学报,2014,36(11): 1592-1596.
[23] 刘奔,潘频化. 细胞自噬与脓毒症 [J]. 中国感染控制杂志,2014,13(12): 764-766.
Correlative exploration in changes of mechanical pain thresholds and autophagy levels with chronic pelvic pain syndrome mice model
WEI Li-juan1, WEI Su-yi2, HU Yan-ling1, LEI Dan-qing1*
(1. Life Sciences Institute of Guangxi Medical University, Nanning 530021, China; 2. College of Biotechnology, Guilin Medical University, Guilin 541000)
Objective To observe the changes of mechanical pain thresholds and autophagy related proteins microtubule-associated protein 1 light chain 3 (LC3) and sequestosome 1 (SQSTM1 also known as p62) expression levels in the C57BL/6 mouse models of chronic prostatitis/ chronic pelvic pain syndrome (CP/CPPS), and provide animal experimental evidence for CP/CPPS pain and autophagy study. Methods 36 male C57BL/6 mice were randomly divided into three groups: the model group, control group and naïve group. The CP/CPPS model was established by subcutaneous injection in the lower abdomen region with suspension liquid, containing protein extract of male SD rat prostate gland and complete Freund adjuvant. At 1month and 6 months after modeling, the mice were sacrificed and prostate tissues were harvested for histological examination using HE staining. Mechanical tactile hyperalgesia was measured with von Frey filaments. The autophagy-related proteins LC3 and p62 expression levels were detected by immunohistochemistry, respectively. The average IOD was measured by Image Pro Plus 6.0, and the statistical analysis was performed with GraphPad Prism 5 software. Results The histopathology showed the appearance of chronic prostatitis in the model group, representing hyperplasia and lymphocytic infiltration to a different degree and lasted for 6 months after modeling. Moreover, prostate intraepithelial neoplasia (PIN) appeared in the model group at 6 months after modeling, characterized by the disappearence of basement membrane and obvious nuclear abnormality, while the control and naïve groups showed normal histology during the 1-6 months. Compared with the control and naïve groups, the mechanical pain threshold in the model group was significantly decreased along with the time from (0.353±0.154) g at 0 week to (0.008±0.00) g at 22 weeks (P<0.05). The average IOD of LC3 and p62 expression in the model group was significantly increased with timing from [(2.767±0.464)%, (2.872±1.642)%] at 1month to [(13.501±1.900)%, (9.07±0.49)%] at 6 month,P<0.05. Conclusions A CP/CPPS model is successfully established in C57BL/6 mice. For the model group, the mechanical pain threshold is decreased and autophagy levels are increased gradually with time. These phenomena show that chronic inflammation microenvironment may promote pain and autophagy activity in the prostate, which is closely related with the occurrence and development of prostatic intraepithelial neoplasia.
Chronic pelvic pain syndrome; C57BL/6 mice; Mechanical pain threshold; Autophagy
LEI Dan-qing. Email: ldq0422@126.com
国家自然科学基金(项目批准号:81472414)。
韦丽娟,女,硕士研究生,专业:生物医学工程。Email: weilijuancpu@163.com
雷丹青,女,硕士生导师,研究员,研究方向:生化药物的研究与开发。Email: ldq0422@126.com
Q95-33
A
1005-4847(2017) 03-0229-06
10.3969/j.issn.1005-4847.2017.03.001
2016-11-25
