力竭运动对大鼠前额叶皮层小清蛋白阳性神经元及NMDAR2B表达的影响
2017-07-18崔书强刘晓莉乔德才郑健
崔书强刘晓莉乔德才郑健
1北京师范大学体育与运动学院(北京100875)2北京市体育科学研究所(北京100075)3广州中医药大学(广州510006)
力竭运动对大鼠前额叶皮层小清蛋白阳性神经元及NMDAR2B表达的影响
崔书强1,2刘晓莉1乔德才1郑健3
1北京师范大学体育与运动学院(北京100875)2北京市体育科学研究所(北京100075)3广州中医药大学(广州510006)
目的:通过观察力竭运动后大鼠前额叶皮层小清蛋白(parvalbumin,PV)阳性神经元的表达变化,探讨运动疲劳对前额叶皮层神经微环路可塑性的影响,同时观察前额叶皮层N-甲基-D-天门冬氨酸受体NR2B亚型(N-methyl-D-aspartatereceptor NR2B subunit,NMDAR2B)表达的变化,进一步探讨运动疲劳中枢调节的可能机制。方法:雄性Wistar大鼠36只随机分为一次力竭运动组、重复力竭运动组和对照组。力竭运动方案采用本实验室改进的Bedford渐增负荷动物运动方案:I级:8.2 m/min,15 min;II级:15 m/min,15 min;III级:20 m/min,至力竭,重复力竭运动组连续进行7天力竭性跑台运动,在运动力竭后采用免疫荧光染色技术观察大鼠前额叶皮层PV阳性神经元的表达情况,并记录阳性细胞个数。采用免疫荧光染色技术和免疫印迹法检测前额叶皮层NMDAR2B的表达情况。结果:一次力竭运动组及重复力竭运动组大鼠前额叶皮层PV阳性神经元个数较对照组显著增加(P<0.01)。免疫荧光染色结果显示,前额叶皮层NMDAR2B阳性神经元在对照组和重复力竭运动组未见明显表达,一次力竭运动组可见阳性神经元表达;Western blot结果显示,与对照组相比,一次力竭运动组NMDAR2B表达相对较高,而重复力竭运动组表达相对较低,但均无显著性差异(P>0.05);NMDAR2B表达与运动距离呈显著负相关(P<0.01,r=-0.936)。结论:力竭运动通过PV阳性神经元的局部环路的调节影响大鼠前额叶皮层神经网络的可塑性,其参与了运动疲劳的中枢调节,为运动疲劳中枢机制研究提供了形态学基础。
运动疲劳;NMDAR2B;小清蛋白;前额叶皮层;中枢调节
运动疲劳可引起肌肉到中枢多个水平的改变,越来越多的研究认为,运动疲劳的产生是来自皮层高级中枢的控制[1]。最近有学者指出前额叶皮层对运动耐力以及运动的终止起很重要的作用[2],人体研究也发现运动疲劳时前额叶皮层会受到明显激活[3,4]。前额叶皮层是哺乳动物的最高级中枢,在脑内以自上而下的方式控制行为的选择与执行[6],对机体的决策、工作记忆以及运动行为的调控起重要作用[5,7]。在脑内兴奋与抑制共同调节机体的行为,越来越多的证据发现皮层γ-氨基丁酸(γ-aminobutyric acid,GABA)能中间神经元可以抑制锥体神经元并调节其兴奋的输出,在皮层的小清蛋白(parvalbumin,PV)阳性神经元占GABA能中间神经元的绝大多数,参与了皮层环路的反馈和前馈抑制,对于网络振荡的产生起到很重要的作用;而网络振荡对感觉感知、认知、行为有重要意义[8,9]。PV阳性神经元的兴奋性输入受离子型谷氨酸能N-甲基-D-天门冬氨酸(N-methyl-D-aspartic acid,NMDA)受体的调节,研究已发现NMDAR2B型受体在GABA能中间神经元上有表达,并可以影响GABA能中间神经元的活动[10]。运动疲劳会引起皮层下基底神经节多个核团的放电变化[11,12],这必将受到上游皮层的影响,然而运动疲劳对前额叶皮层的影响研究相对较少。本研究采用PV阳性神经元作为标记物,观察力竭性运动对前额叶皮层神经调控的影响并分析NMDAR2B可能参与的调节机制。
1 材料与方法
1.1 实验对象与分组
健康雄性8周龄Wistar大鼠36只,体重250~280 g,由北京维通利华实验动物技术有限公司提供[许可证号:SCXK(京)2012-0001],大鼠购进后分笼饲养,每笼4只,在北京师范大学运动生理学实验室动物房饲养,温度24±2℃,相对湿度50%±5%,自由饮食,自然光照。适应性饲养3天后随机分为一次力竭运动组、重复力竭运动组和对照组,每组12只,其中6只用来做前额叶皮层PV阳性神经元及NMDAR2B的免疫荧光染色,另外6只用来做前额叶皮层NMDAR2B蛋白表达的免疫印迹检测。所有操作程序经北京师范大学动物伦理委员会批准。
1.2 运动方案
一次力竭运动组采用本实验室改进的Bedford渐增负荷动物运动方案:动物跑台采用杭州段氏(DSPT-202)大鼠跑台,坡度为0,I级:8.2 m/min,15 min;II级:15 m/min,15 min;III级:20 m/min,至力竭[13]。重复力竭运动组采用同样的运动方案,连续进行7天力竭性跑台运动。记录大鼠的运动持续时间、运动距离等指标。对照组不进行跑台运动。
1.3 测试方法
1.3.1 免疫荧光染色
1.3.1.1 灌注取脑
对照组、一次力竭运动组和重复力竭运动组各6只大鼠用于前额叶皮层PV阳性神经元及NMDAR2B的免疫荧光染色。对照组在安静状态下、一次力竭运动组在进行一次力竭运动后即刻、重复力竭运动组在进行7天力竭运动后即刻进行腹腔注射10%水合氯醛麻醉,经心脏首先快速灌注冷的生理盐水,然后先快后慢灌注4%多聚甲醛(PFA)。以大鼠四肢僵直为灌注成功,剥离全脑,入4%PFA的30%的蔗糖溶液固定,4℃保存。
1.3.1.2 冰冻切片与染色
待大鼠脑组织沉底后对其脑进行连续冠状冰冻切片,选取前额叶皮层、纹状体部位,切片厚度40微米,每6片选取一片进行组织免疫荧光染色。切片收集于0.1 M的PB中,置于4℃冰箱待用。免疫荧光染色:切片置于0.1 M的PB中洗一次,3%羊血清室温封闭30 min;加一抗PV(来源小鼠的单克隆抗体,Abcam,货号:ab64555)稀释浓度为1︰1000,一抗NMDAR2B(来源于兔的多克隆抗体,Abcam,货号:ab65783)稀释浓度为1︰500,一抗4℃孵育24 h,0.1 M的PB洗3次,每次5 min;二抗采用Alexa Fluor®594标记的羊抗小鼠IgG(Invitrogen,货号A-11005)和Alexa Fluor®488标记的羊抗兔IgG(Invitrogen货号:A-11034),二抗稀释浓度为1:500,室温孵育2 h(避光),0.1 M的PB洗3次,将切片在0.02 M的PB中贴于载玻片上,用中性甘油封片,然后在荧光显微镜、激光共聚焦显微镜下观察并拍片。
1.3.1.3 图像分析与数据处理
使用Olympus荧光显微镜(型号:DP-73)及激光共聚集显微镜对大鼠前额叶皮层进行图像的拍摄,每组大鼠的相同层面中选取6张脑片进行统计,记录20倍镜下每张片子的PV阳性细胞的个数。
1.3.2 免疫印迹(Western n B B l l o o t t)法检测N N M M D D A A R R22B B蛋白表达
对照组、一次力竭运动组和重复力竭运动组各6只大鼠用于前额叶皮层NMDAR2B蛋白表达的检测。对照组在安静状态下、一次力竭运动组在进行一次力竭运动后即刻、重复力竭运动组在进行7天力竭运动后即刻进行断头取脑,快速剥离脑组织后,在冰盘上分离前额叶皮层,骤冷后冻存。进一步测定前进行脑组织裂解,离心并取上清,冻存备用。采用二辛可宁酸法(Bicinchoninic Acid,BCA)法进行蛋白浓度检测(试剂盒由碧云天生物公司提供),取50微升样品与5倍的上样缓冲液(包含4%SDS,10%2-巯基乙醇,20%甘油,0.004%溴酚蓝和0.125 M Tris·HCl,pH 6.8)煮沸5 min,置于10%种聚丙烯酰胺凝胶上进行电泳,聚偏二氟乙烯(polyvinylidene fluoride,PVDF)转膜(恒流300 mA,90 min),用5%脱脂奶粉封闭,室温1 h,加一抗NMDAR2B(abcam,ab65783,1︰2000)孵育,4℃过夜,TBS-T洗3次,每次5 min;加辣根过氧化物酶(HRP)标记的山羊抗兔二抗(1︰10000)孵育1小时。使用ECL化学发光显色液(pierce),将显色后的底片扫描,并用IPP6软件对图像进行灰度分析。
1.4 统计方法
2 结果
2.1 P P V V阳性神经元在前额叶皮层的表达
免疫荧光染色结果显示,前额叶皮层PV阳性神经元的阳性表达在对照组较弱,一次力竭运动组有较明显的阳性神经元表达,而重复力竭运动组阳性神经元表达最强(图1a)。
图1b显示,一次力竭运动组及重复力竭运动组大鼠前额叶皮层PV阳性神经元个数较对照组显著增加(P<0.01)。
2.2 N N M M D D A A R R22B B阳性神经元在前额叶皮层的表达
免疫荧光染色结果显示,前额叶皮层NMDAR2B阳性神经元在对照组和重复力竭运动组无明显表达,一次力竭运动组可见阳性神经元表达(如图2b所示)。
图2a显示,与对照组相比,一次力竭运动组大鼠前额叶皮层NMDAR2B蛋白表达较高,而重复力竭运动组表达相对较低,但差异均无统计学意义(P>0.05)。
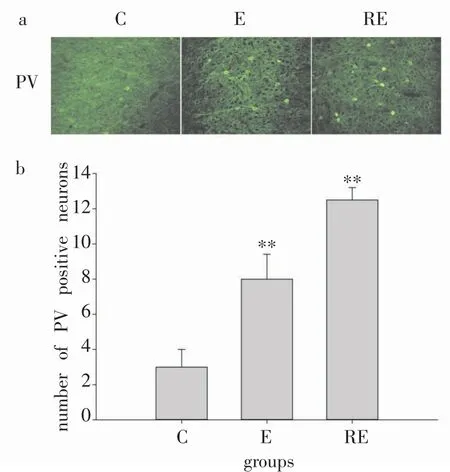
图1 前额叶皮层PV阳性神经元的表达

图2 大鼠前额叶皮层NMDAR2B的表达
2.3 运动距离和运动时间
如图3所示,一次力竭运动组大鼠平均运动距离较重复力竭运动组短,但差异无统计学意义(P>0.05);一次力竭运动组运动持续时间稍低于重复力竭运动组,但差异无统计学意义(P>0.05)。

图3 大鼠运动距离和运动时间
2.4 N N M M D D A A R R22B B及P P V V阳性神经元表达与运动距离的关系
如图4所示,大鼠的运动距离与其前额叶皮层NMDAR2B的表达量呈显著负相关(P<0.01,r=−0.936),而与大鼠前额叶皮层PV阳性神经元表达个数无显著相关(P=0.609,r=0.312)。
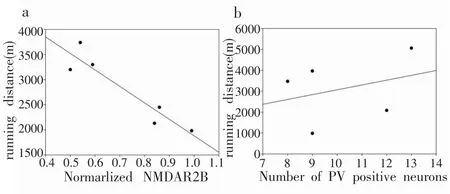
图4 NMDAR2B及PV阳性神经元表达与运动距离相关性
3 讨论
3.1 力竭性运动对大鼠前额叶皮层P P V V阳性神经元的影响
本研究发现,一次力竭运动及多次力竭运动后大鼠前额叶皮层PV阳性神经元表达均显著增多,这提示力竭运动使前额叶皮层神经调节微环路产生了可塑性改变,PV阳性神经元在前额叶皮层的分布具有活动依赖性,并且这种改变可能有利于在不同环境下的适应[14]。结果还说明,来自皮层锥体神经元对PV阳性神经元的兴奋性驱动增加,PV阳性神经元通过抑制周围的兴奋性神经元而控制兴奋性神经元的放电,进而通过反馈和前馈抑制等方式来调节机体的行为状态[16]。力竭运动是一个典型的应激,当机体暴露于应激状态时,一般会引起前额叶皮层功能的紊乱,从而使认知能力降低,这可能与PV阳性神经元的过度表达有关[15]。
运动疲劳是多系统共同作用的结果,最终引起运动不能持续,来自外周的感觉通过反馈传递到躯体感觉皮层,躯体感觉皮层将信息传递到前额叶皮层,前额叶皮层整合来自躯体感觉皮层、运动皮层的信息,通过与背内侧纹状体形成皮层纹状体环路,该环路主要参与了决策、行为灵活性转变、工作记忆等活动。本研究发现力竭运动引起前额叶皮层PV阳性神经元表达增多,提示力竭运动会影响机体在行为灵活性转变、决策等方面的表现。运动行为改变的灵活性与前额叶皮层突触和树突棘的重组有关,皮层抑制性中间神经元与皮层兴奋性锥体神经元通过NMDA受体产生广泛联系。采用在体双光子成像技术发现,在运动性技能学习中,皮层表达PV的神经元的树突棘会随着运动技能的获得而增加[17],表达PV的中间神经元通过抑制胞体及胞体周围兴奋性神经元,从而调节兴奋性神经元的放电,而力竭运动引起PV阳性神经元的增加可能与运动技能学习引起PV阳性神经元表达增加的调节机制不同。
3.2 力竭性运动对前额叶皮层N N M M D D A A R R22B B表达的影响
本研究发现,在一次性力竭运动中,大鼠前额叶皮层出现了NMDAR2B的表达,并且免疫印迹检测也证实了一次性力竭运动组NMDAR2B表达较高,这提示在一次性力竭运动中大鼠前额叶皮层选择性学习及灵活性行为转变加强。本研究对NMDAR2B的表达与大鼠的运动距离进行相关分析,结果进一步证实NM⁃DAR2B受体的高表达与行为选择密切相关,这同时也提示NMDAR2B受体可能是运动疲劳中枢调节机制的一个重要靶点。前额叶皮层锥体神经元之间的兴奋性传递是通过谷氨酸能突触,其中NMDA受体是非常重要的一种,它参与了经典的突触可塑性,NMDA受体对前额叶皮层的正常功能起非常重要的作用[18]。研究发现在前额叶皮层敲除NMDAR2B受体或使用NM⁃DAR2B受体的拮抗剂均可导致行为转换受损[19]。前额叶皮层NMDAR2B的高表达是前额叶皮层选择性学习和灵活性行为转换功能所必需的,然而过高的NM⁃DAR2B对神经元是有害的,这会增加谷氨酸毒性作用[20]。前额叶皮层NMDAR2B受体的高表达说明前额叶皮层来自其他皮层如躯体感觉皮层的兴奋性传入更加敏感,它可能通过激活与其相联系的皮层抑制性中间神经元通过局部微环路产生抑制。当机体处于应激状态或给予糖皮质激素时,脑内胞外谷氨酸的释放明显增加,例如在强迫游泳训练中采用在体微透析的方法对前额叶皮层胞外谷氨酸含量进行检测发现前额叶皮层谷氨酸的含量明显升高。前额叶皮层谷氨酸释放的增加依赖于糖皮质激素受体的激活[21]。也有研究指出,长期应激可引起NR2B亚型在前额叶皮层的降低,NR2B的拮抗剂Ro25-6981对强迫游泳以及学习无助感模型具有抗抑郁作用[22]。有证据显示,应激可以打破前额叶皮层突触可塑性的过程,甚至可以损害前额叶皮层的认知控制过程[23]。Li等[24]研究大鼠在应激刺激之后,表现出对糖水的偏好降低,而在给予ketamine之后这种行为可以得到较好的纠正。其进一步对应激刺激的大鼠给予了NMDAR2B的拮抗剂Ro-25-6981干预,结果发现其对糖水偏好降低的这种行为得到了纠正。他们也指出Ro25-6981对行为和突触的作用依赖于mTOR的信号转导。
本研究发现一次力竭运动后前额叶皮层PV表达增强,PV阳性神经元作为重要的输出神经元,对于前额叶皮层最终运动行为的决策起重要作用。然而重复力竭组大鼠前额叶皮层PV阳性神经元出现了明显表达,而NMDAR2B表达相对不高,这可能是前额叶皮层对跑台运动适应的一种表现。这也提示,在重复力竭后大鼠前额叶皮层可引起运动疲劳中枢调控环路的改变。在前额叶皮层与背内侧纹状体之间形成联络环路,对于决策及运动学习的初级阶段起重要调节作用,随着运动学习及运动技能的形成,躯体运动皮层-背外侧纹状体形成的运动环路在运动的调控中起重要作用[8]。从本研究中可以看出,重复力竭运动组前额叶皮层NMDAR2B的表达没有相对较低,由此推测重复力竭运动疲劳产生的中枢调控中躯体运动皮层-背外侧纹状体通路起重要作用。然而通过分析发现,NMDAR2B的表达量与运动距离呈非常显著性负相关,这也进一步证实了大鼠在运动力竭过程中,NMDAR2B更多地参与了行为的决策和转换。在前额叶皮层抑制NMDA受体可以单纯降低GABA能中间神经元的活动,增加主要锥体神经元的放电频率,因此NMDA受体优先作用于皮层的抑制性中间神经元,而NMDA受体的抑制通过对锥体神经元的去抑制而引起皮层的兴奋增强[25]。
4 小结
力竭运动通过对PV阳性神经元局部环路的调节影响了大鼠前额叶皮层神经网络的可塑性,这种前额叶皮层的神经网络可塑性参与了运动疲劳的中枢调节,NMDAR2B受体参与了运动疲劳中枢调节机制。
[1]Noakes TD.Fatigue is a Brain-Derived Emotion that Regulates the Exercise Behavior to Ensure the Protection of Whole Body Homeostasis[J].Front Physiol,2012,3:82.
[2]Robertson CV,Marino FE.A role for the prefrontal cor⁃tex in exercise tolerance and termination[J].J Appl Physi⁃ol,2016,120(4):464-466.
[3]Krebs RM,Boehler CN,Roberts KC,et al.The involve⁃ment of the dopaminergic midbrain and cortico-striatalthalamic circuits in the integration of reward prospect and attentional task demands[J].Cereb Cortex,2012,22(3):607-615.
[4]郭峰.指屈肌次最大随意等长收缩诱发疲劳过程中中枢神经电生理学机制研究[D].吉林大学博士学位论文,2014.
[5]Tanji J,Hoshi E.Role of the lateral prefrontal cortex in executive behavioral control[J].Physiol Rev,2008,88(1):37-57.
[6]Dembrow N,Johnston D.Subcircuit-specific neuromodula⁃tion in the prefrontal cortex[J].Front Neural Circuits,2014,8:1-9.
[7]Yarrow K,Brown P,Krakauer JW.Inside the brain of an elite athlete:the neural processes that support high achievement in sports[J].Nat Rev Neurosci,2009,10(8):585-596.
[8]Yin HH,Knowlton BJ.The role of the basal ganglia in habit formation[J].Nat Rev Neurosci,2006,7(6):464-476.
[9]Harris KD,Shepherd GM.The neocortical circuit:themes and variations[J].Nat Neurosci,2015,18(2):170-181.
[10]Lewis DA,Hashimoto T,Volk DW.Cortical inhibitory neurons and schizophrenia[J].Nat Rev Neurosci,2005,6(4):312-324.
[11]乔德才,李许贞,刘晓莉,等.力竭运动过程中大鼠纹状体神经元局部场电活动的动态研究[J].中国运动医学杂志,2012,31(10):855-860.
[12]乔德才,侯莉娟,何德富,等.运动疲劳对大鼠新纹状体神经元电活动的影响[J].中国运动医学杂志,2005,24(6):676-680.
[13]杨东升,乔德才,刘晓莉.力竭运动过程中大鼠纹状体葡萄糖/乳酸代谢的实时观察[J].中国运动医学杂志,2009,28(4):384-387.
[14]Dehorter N,Ciceri G,Bartolini G,et al.Tuning of fastspiking interneuron properties by an activity-dependent transcriptional switch[J].Science,2015,349(6253):1216-1220.
[15]Arnsten AF.Stress weakens prefrontal networks:molecu⁃lar insults to higher cognition[J].Nat Neurosci,2015,18(10):1376-1385.
[16]Hu H,Gan J,Jonas P.Interneurons.Fast-spiking,parval⁃bumin+GABAergic interneurons:from cellular design to microcircuit function[J].Science,2014,345(6196):1255263.
[17]Chen SX,Kim AN,Peters AJ,et al.Subtype-specific plas⁃ticity of inhibitory circuits in motor cortex during motor learning[J].Nat Neurosci,2015,18(8):1109.
[18]Wang H,Stradtman GG,Wang XJ,et al.A specialized NMDA receptor function in layer 5 recurrent microcircuit⁃ry of the adult rat prefrontal cortex[J].Proc Natl Acad Sci U S A,2008,105(43):16791-16796.
[19]Brigman JL,Daut RA,W right T,et al.GluN2B in cortico⁃striatal circuits governs choice learning and choice shift⁃ing[J].Nat Neurosci,2013,16(8):1101-1110.
[20]Hardingham GE,Bading H.The Yin and Yang of NMDA receptor signaling[J].Trends Neurosci,2003,26(2):81-89.
[21]Popoli M,Yan Z,McEwen BS,et al.The stressed syn⁃apse:the impact of stress and glucocorticoids on gluta⁃mate transmission[J].Nat Rev Neurosci,2011,13(1):22-37.
[22]Lima-Ojeda JM,Vogt MA,Pfeiffer N,et al.Pharmacologi⁃cal blockade of GluN2B-containing NMDA receptors in⁃duces antidepressant-like effects lacking psychotomimetic action and neurotoxicity in the perinatal and adult ro⁃dent brain[J].Prog Neuropsychopharmacol Biol Psychia⁃try,2013,45:28-33.
[23]Dias-Ferreira E,Sousa JC,Melo I,et al.Chronic stress causes frontostriatal reorganization and affects decisionmaking[J].Science,2009,325(5940):621-625.
[24]Li N,Liu RJ,Dwyer JM,et al.Glutamate N-methyl-D-as⁃partate receptor antagonists rapidly reverse behavioral and synaptic deficits caused by chronic stress exposure [J].Biol Psychiatry,2011,69(8):754-761.
[25]Carlén M,Meletis K,Siegle JH,et al.A critical role for NMDA receptors in parvalbumin interneurons for gamma rhythm induction and behavior[J].Molecular Psychiatry,2012,17(5):537-548.
Effectsof Exhausted Treadm illRunning on the Expression of Parvalbum in Positive Neuronsand GluN2B-containing NMDA Receptors in the PrefrontalCortex of Rats
CuiShuqiang1,2,Liu Xiaoli1,Qiao Decai1,Zheng Jian3
1College ofPhysical Education,Beijing NormalUniversity,Beijing 100875,China 2Beijing Research Institute ofSportsScience,Beijing 100075,China 3Guangzhou University ofChineseMedicine,Guangzhou 510006,China Corresponding Author:Qiao Decai,Email:decaiq@bnu.edu.cn
ObjectiveTo explore the effects of excise-induced fatigue on the microloop plasticity of prefrontal cortex through observing the expression of parvalbumin positive neurons in prefrontal cortexes of rats induced by exhaustive exercise,so as to find out the possible mechanism of the central regula⁃tion of exercise-induced fatigue by measuring the expression of NMDAR2B receptors.Methods Thirtysix Wistar rats were randomly divided into an exhausted group(E),a repeated exhaustion group(RE)and a control group(CG),each of 12.For group E,the adjusted Bedford incremental load of treadmill exercise program was employed:the initial treadmill speed was 8.2 m/min,lasting for 15 minutes,thenincreased to 15 m/min for another 15 minutes,and finally increased to 20 m/min till exhaustion.For RE group,they were given continuous treadmill exercises to exhaustion for consecutive 7 days.The im⁃munofluorescence technique was used to observe the expression of PV+interneurons after exhausted treadmill running.The Western blotting technique was used to determine the expression of NMDAR2B in the tissue of the prefrontal cortex.ResultsAfter the exhausted treadmill running,the expression of PV+interneurons in the prefrontal cortexes of both E and RE groups increased significantly compared with the control group(P<0.01).The immunofluorescence results indicated that NMDAR2B positive neu⁃rons were seen in group E,but not obviously in group CG and RE.The Western blotting showed that compared with CG group the protein expression of NMDAR2B in prefrontal cortexes of group E was rel⁃atively high,and that of group RE was relatively low,but without significant difference(P>0.05).The running distance and prefrontal cortex NMDAR2B expression were found negatively correlated(P<0.01).Conclusions Exhaustive exercises have an impact on the plasticity in rats’prefrontal cortex neural network through regulating the local loop of PV positive neurons.This plasticity of the prefron⁃tal cortex is involved in the regulation of central fatigue.The present study might provide morphologi⁃cal basis for the research of central mechanism of the exercise-induced fatigue.
exercise-induced fatigue,NMDAR2B parvalbumin,prefrontal cortex,central regulation
2016.11.15
国家自然科学基金资助项目(31571221);北京市自然科学基金资助项目(5142012)
乔德才,Email:decaiq@bnu.edu.cn
