负载纳米磁铁颗粒的PLGA微球的可控制备研究
2017-07-18陈红徐菊美赵世成岑莲
陈红 徐菊美 赵世成 岑莲
负载纳米磁铁颗粒的PLGA微球的可控制备研究
陈红 徐菊美 赵世成 岑莲
目的采用微流控法制备聚乳酸-羟基乙酸共聚物(PLGA)微球,并同时负载纳米磁铁颗粒,为利用PLGA复合微球实现靶向给药,以及应用MRI进行追踪提供实验基础。方法设计微流控三相装置,用微流控法制备得到PLGAFe3O4复合微球,并对所得微球的形貌及Fe3O4纳米磁铁颗粒在微球内部的分布情况进行分析测试。结果微流控法制备的PLGA-Fe3O4复合微球粒径均一,形貌和分散性好。元素分析结果证实了Fe元素的存在。TEM观察表明,Fe3O4纳米磁铁颗粒在微球内部以纳米尺径存在,且分散良好,未出现团聚现象。结论证实了利用微流控法制备负载纳米磁铁颗粒PLGA微球的可行性,为PLGA微球提供了进一步功能化以及靶向给药和MRI追踪的可能性。
聚乳酸-羟基乙酸共聚物微球纳米磁铁颗粒微流控法
近年来,生物可降解材料的研究备受重视,其中聚乳酸-羟基乙酸共聚物(PLGA)具有生物相容性好、可生物降解且降解产物安全无毒、降解速度可控等优点。PLGA载药微球因其载体材料PLGA自身的降解性能,最终可实现微球所包埋药物在体内的可控释放,且释放周期相对较长,释放缓慢,有效避免了频繁大剂量给药造成的高药物浓度对人体的毒副作用,减轻了患者的痛苦与不便,且明显减少了给药量,提高了药物的利用率[1-2]。另外,PLGA载药微球可通过在治疗部位局部给药,使得药物直接在治疗处局部控释,保持长期有效的药物浓度[3-4]。
根据释放的需要,选择合适的方法在PLGA微球上负载纳米磁性物质,可使PLGA微球具有一定的磁性功能,有利于载药微球的靶向治疗和治疗后MRI追踪。其中应用最多的是Fe3O4纳米磁铁颗粒,该颗粒具有特殊的磁性功能、良好的生物相容性和化学稳定性,是一种可广泛应用在靶向控释药物、细胞分离及磁热疗等领域的理想材料。本研究利用微流控法制备了负载Fe3O4纳米磁铁颗粒的PLGA微球,使制备过程可控,并对其性能进行了分析。
1 材料与方法
1.1 材料
PLGA(100 g PDLG 5010,荷兰Corbion Purac公司);聚乙烯醇(PVA,美国Sigma公司);二氯甲烷(分析纯试剂,国药集团);Fe3O4纳米磁铁颗粒溶液(5 mg/mL in H2O,美国Sigma公司)。
1.2 微流控法制备PLGA-Fe3O4微球
1.2.1微流控装置的设计及制备
采用玻璃毛细管制备微流控装置微通道。首先,将玻璃方形管(2~3 cm)固定到载玻片上;再将圆形玻璃毛细管用拉管仪制成两段,拉制结束的毛细管均有一端直径为10 μm的锥形口,然后用砂纸将其中一个锥形口磨成管口直径(Do)为100 μm左右,另一个磨成前一个管径大小的2~3倍。锥形管口确保磨平,并吹净。将磨好吹净的毛细管分别从已固定好的方形管左右两端插入,两管管口距离约为较小的管口直径的一半(约50 μm),各管水平中心线对齐后固定。将三个针头塑料端两侧均切出两个凹槽,使其恰好可以嵌入方形管和圆管的入口端,最后用胶水固定针头,凝固后即可得装置(图1)。

图1 微通道显微镜图及微流控三相装置图Fig.1Microscopic image of inner mircochannels and photographic image of the glass capillary device of three fluid channels
1.2.2PLGA-Fe3O4微球的制备
分别配制PVA和Fe3O4纳米磁铁颗粒混合水溶液(内水相,Qi),其中PVA浓度为1 wt%,Fe3O4纳米磁铁颗粒为1 mg/mL;2 wt%PVA水溶液(外水相,Qo)和0.6 wt%PLGA溶液(油相,Qm)分别用注射器吸取后,固定于3台微量注射泵上,并连接到相对应的装置上。其中,内水相和油相溶液同向流入微流控装置,而外水相溶液反方向流入通道内。设置微量注射泵参数,即Qi、Qm、Qo,分别为1 mL/h、2 mL/h、4 mL/h。排气后,启动微量注射泵,即可在通道内形成W/O/W型微球液滴,配制0.5 wt%PVA水溶液收集微球。收集完毕后,250 r/min磁力搅拌24 h,以挥发溶剂。然后通过反复离心(5 000 r/min)和蒸馏水清洗(3次),除去残留PVA后,冷冻干燥即得PLGA-Fe3O4微球。
1.3 检测方法
1.3.1 光学显微镜和扫描电镜
取少量微球于载玻片上,放在显微镜载物台上,用显微镜观察PLGA-Fe3O4微球的形貌及分散情况。将冷冻干燥所得的PLGA-Fe3O4微球样品适量固定于扫描电镜托的导电胶上,喷金处理后,SEM观察微球形貌。
1.3.2 能谱分析
用能谱仪(Energy dispersive spectrometer,EDS)配合SEM对微流控法制备的PLGA-Fe3O4微球进行元素定性分析。EDS主要是用来检测PLGA-Fe3O4微球中Fe元素存在及分布情况。
1.3.3 透射电镜
由于Fe3O4纳米磁铁颗粒在微球中的分散情况对其性能有很大的影响,因此进一步通过透射电镜(Transmission electron microscope,TEM)来观察微球内磁铁颗粒的分布。考虑到透射电镜的电子束穿透力有限,无法直接用于几十微米微球的观察。因此在TEM观察之前需要对微球进行超薄切片处理,微球用树脂包埋后用超薄切片机将已包埋的样品切成数十纳米厚的超薄切片,之后再进行TEM观察。
2 结果
2.1 PLGA-Fe3O4微球的形貌分析
首先通过光学显微镜观察所得微球的分散性,结果可见微流控法制备的PLGA-Fe3O4微球大小均匀,分散性好,颗粒间无黏连现象,球形圆整度极好(图2)。

图2 微流控法制备的PLGA微球光学显微镜观察Fig.2Optical microscopy images of PLGA microspheres prepared by microfluidics
SEM观察微流控法制备的PLGA-Fe3O4微球表面形貌,可见PLGA-Fe3O4微球粒径均一,分散性好,表面致密无孔,球形形貌好(图3)。

图3 微流控三相装置制备的PLGA-Fe3O4微球的SEM观察Fig.3SEM images of PLGA-Fe3O4microspheres prepared by microfluidics of three channels
通过对微球进行粒径统计分析可得,微球的平均粒径(Dp)为62.41 μm,粒径在51.16~69.77 μm范围内。其中,粒径在56.98~67.44 μm的微球占总数的98.2%,59.30~67.44 μm粒径的占94%,59.30~ 65.12 μm粒径的占89.4%。根据数据计算得到的PLGA微球的离散系数(CV)为1.93%,说明该方法制得的微球粒径的离散程度很小,粒径分布均匀。
2.2 元素分析
实验所用Fe3O4纳米磁铁颗粒为水性溶液,与内水相溶液混合后一起作为微流控装置的内水相,最终获得PLGA-Fe3O4微球。为了研究纳米磁铁颗粒的分布情况,实验通过EDS配合SEM对微球进行元素定性分析。首先,用EDS对复合微球中C元素、O元素及Fe元素进行分析,结果显示三种元素的计数点分布图(图4D-F)与微球扫描图(图4B)相对应,能较清楚地看到扫描范围内元素计数点构成的球形形状,可以初步判断出纳米磁铁颗粒在复合微球中分布比较均匀。通过比较C、O、Fe三种元素(图4D-F),可以观察到Fe元素在微球内部的集中分布区域略小于C元素和O元素,如图中圆形虚线区域;与C元素和O元素相比,Fe元素分布比C元素和O元素约小了厚度为5.13 μm的外层区域(图4D-F)。根据微流控装置的设置及三相流体的分布情况,我们推测存在此现象可能与微球结构有关,且此层厚度与微球外层PLGA结构的厚度相对应。此外,根据能量与计数的关系图(图4C),明确了纳米磁铁颗粒在PLGA微球中的存在。
2.3 Fe3O4纳米磁铁颗粒的分散性分析
确定微球中Fe元素的存在后,进一步用TEM来观察纳米磁铁颗粒在复合微球内的分布情况。因微球粒径较大,不利于TEM的电子束穿透,无法直接用TEM观察。因此,对微球进行树脂包埋后用超薄切片机将其切成几十纳米厚的薄片,行TEM观察,并以PLGA微球的超薄切片作为对照。TEM观察显示,在PLGA-Fe3O4微球的超薄切片中分散着许多几十纳米大小的黑色颗粒,而在对照组中则没有观察到上述黑色颗粒(图5 B1、B2中边界线为样品切片与包埋树脂的界面),由此可以判断该黑色颗粒为微球制备时加入的Fe3O4纳米磁铁颗粒。本实验采用平均直径为20 nm左右的纳米磁铁颗粒,从图中黑色部分的大小及分散情况可以看出,纳米磁铁颗粒仍为100 nm以内粒径分布,且分布情况良好,并未出现大块的颗粒团聚,可以认为包裹在PLGA微球内的纳米磁铁颗粒的性能和作用并未受制备过程影响,从而为今后功能化PLGA微球的制备,以及靶向给药和MRI追踪提供了可能。

图4 PLGA-Fe3O4微球的元素分析能谱图Fig.4Elemental analysis images of PLGA-Fe3O4microspheres by EDS
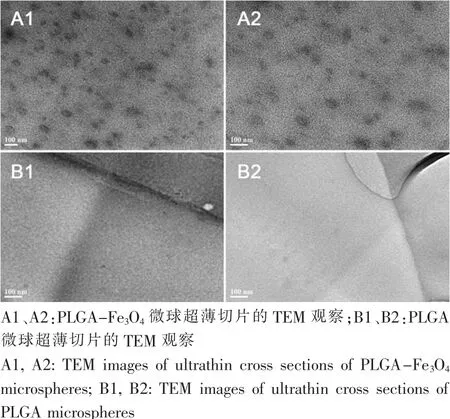
图5 PLGA-Fe3O4微球和PLGA微球超薄切片的TEM观察Fig.5TEM images of ultrathin cross sections of PLGAFe3O4and PLGA microspheres
3 讨论
PLGA微球生物性能良好,常被用作药物缓释载体材料,其性能与微球的形貌、粒径分布、分散性、结构等性能有密切关系。本研究利用微流控法制备了PLGA微球,对其形貌进行分析,结果显示微流控法制备的微球粒径均一,形貌特征良好,分散性极好。
PLGA微球的制备主要有乳化/溶剂挥发法、喷雾干燥法、超临界CO2法等,不同的方法会导致载药微球的性能差异,包括形貌、结构、载药性能和药物释放性能等,所以对微球制备方法的选择和优化至关重要。乳化/溶剂挥发法是最常用的制备方法,该方法制备的PLGA微球粒径分布广,微球粒径不均匀,偶然性大,且各微球间存在黏连现象。喷雾干燥法制备PLGA载药微球时,先将需要包埋的药物制备成乳浊液,再将其通入喷雾干燥器,利用雾化器将混合物雾化分散,形成小液滴,最后喷入热空气流,使液滴迅速干燥、硬化,而得到PLGA微球,但这种微球分散性差,颗粒间黏连明显。乳浊液雾化分散成液滴的过程不易控制,导致微球粒径分布广,微球不均匀。超临界CO2法是将超临界CO2作为抗溶剂,使其与PLGA溶液充分接触后,在溶液中迅速扩散,并吸收其中的有机溶剂,使得溶液迅速膨胀,而溶液中溶剂对溶质的溶解能力下降,继而溶液过饱和,溶质PLGA析出,从而得到PLGA微球,该方法过程不易控制,微球的形貌特征差,球形圆整度低,团聚现象严重,颗粒间存在黏连,且粒径分布广。微流控技术制备PLGA微球,并负载纳米磁铁颗粒,所得微球粒径均一,可实现微球尺寸上的高度单分散,无黏连现象,且可获得分散性极好的纳米磁铁颗粒的功能化。因此,本研究从方法学上克服了上述传统方法的缺点。微流控法是近年来发展的一种操控微体积液体的新技术[5],其基本原理是在微米尺度内的微通道里,互不相容的流体经过流动的剪切力和流体表面张力的相互作用,最终被分割成离散的微米级乳液液滴。微流控技术可以连续、可控地制备出高度单分散的微液滴,并能对微液滴结构进行精确调控,包括乳液液滴的尺寸、组分、内外液层的厚度等[6-8]。
Liu等[9]用乳化法制备了PLGA-Fe3O4纳米颗粒,结果表明此纳米颗粒在体内安全无毒,并能作为检测血栓的磁共振造影剂。Hajikarimi等[10]用PLGA负载纳米磁铁颗粒,证明负载在该纳米颗粒上的药物可以更为有效地将5-FU递送至细胞内。PLGA微球复合纳米磁铁颗粒后,不仅具有PLGA特性,还兼有纳米磁铁颗粒特性,即此时的PLGA在外加磁场下能表现出一定的磁响应性。所以,磁性PLGA微球在生物工程、医学及细胞学等领域中被广泛地用作酶、药物及细胞等的载体,其作用主要是利用纳米颗粒的性能,使PLGA微球具有磁靶向药物、医学检测诊断、基因治疗、细胞分离和免疫分析以及吸附和固定化蛋白酶等功能。PLGA微球作为药物控释载体材料已被广泛应用于化疗剂、多糖、抗生素等药物的控释方面,其中作为对治疗肿瘤、癌症的药物的包埋材料已成为研究热点。因此,本研究用微流控法制备了PLGA-Fe3O4微球,并对纳米磁铁颗粒在微球内部的分散情况进行了分析研究,可以确定Fe元素的存在,证实了用微流控法在内水相负载Fe3O4纳米磁铁颗粒的可能性。此外,TEM观察表明,Fe3O4纳米磁铁颗粒在微球内部的分散性良好,未出现大块的团聚现象,说明本方法对纳米磁铁颗粒的负载过程和磁铁颗粒的分散性质未产生影响,提供了PLGA微球进一步功能化以及靶向给药和MRI追踪的可能性。
[1]Freiberg S,Zhu XX.Polymer microspheres for controlled drug release[J].Int J Pharm,2004,282(1-2):1-18.
[2]Porjazoska A,Goracinova K,Mladenovska K,et al.Poly(lacticco-glycolide)microparticles as systems for controlled release of proteins-preparation and characterization[J].Acta Pharm,2004, 54(3):215-229.
[3]Mao S,Xu J,Cai C,et al.Oliver Germerters on morphology and burst release of FITC-dextran loaded PLGA microspheres[J].Int J Pharm,2007,334(1-2):137-148.
[4]Jiang W,Gupta RK,Deshpande MC,et al.Biodegradable poly (lactic-co-glycolic acid)microparticles for injectable delivery of vaccine antigens[J].Adv Drug Deliv Rev,2005,57(3):391-410.
[5]Whitesides GM.The origins and the future of microfluidics[J]. Nature.2006,442(7101):368-373.
[6]Wang W,Xie R,Ju XJ,et al.Controllable microfluidic production of multicomponent multiple emulsions[J].Lab Chip,2011,11(9): 1587-1592.
[7]Chu LY,Utada AS,Shah RK,et al.Controllable monodisperse multiple emulsions[J].Angew Chem Int Ed Engl,2007,46(47): 8970-8974.
[8]Utada AS,Lorenceau E,Link DR,et al.Monodisperse double emulsions generated from a microcapillary device[J].Science, 2005,308(5721):537-541.
[9]Liu J,Xu J,Zhou J,et al.Fe3O4-based PLGA nanoparticles as MR contrast agents for the detection of thrombosis[J].Int J Nanomedicine,2017,12:1113-1126.
[10]Hajikarimi Z,Khoei S,Khoee S,et al.Evaluation of the cytotoxic effects of PLGA coated iron oxide nanoparticles as a carrier of 5-fluorouracil and mega-voltage X-ray radiation in DU145 prostate cancer cell line[J].IEEE Trans Nanobioscience,2014,13(4):403-408.
Preparation and Characterization of Fe3O4Magnetic Nanopaticles Loaded PLGA Microspheres
CHEN Hong,XU Jumei,ZHAO Shicheng,CEN Lian.
School of Chemical Engineering,East China University of Science and Technology, Shanghai 200237,China.Corresponding author:CEN Lian(E-mail:cenlian@hotmail.com).
ObjectiveTo prepare Fe3O4magnetic nanopaticles loaded poly(lactic-co-glycolic acid)(PLGA)microspheres using microfluidics,and to characterize this microspheres for future possible applications as targeted drug delivery and MRI tracking.MethodsPLGA-Fe3O4microspheres were prepared by three-phase microfluidic devices.Morphology of microspheres and distribution of Fe3O4magnetic nanopaticles inside PLGA microspheres were analyzed.ResultsThe PLGA-Fe3O4microspheres prepared by microfluidic method had uniform particle size distribution and excellent dispersibility. The results of elemental analysis confirmed the presence of Fe,and the results of TEM observation showed that Fe3O4magnetic nanopaticles were well dispersed inside the microspheres without agglomeration.ConclusionThe feasibility of Fe3O4magnetic nanopaticles loaded PLGA microspheres prepared by microfluidic method is demonstrated.The current study thus provides possibility of using PLGA microspheres for targeted drug delivery and MRI tracking.
PLGA microspheres;Fe3O4magnetic nanopaticles;Microfluidics
R318.08
A
1673-0364(2017)03-0127-04
2017年3月7日;
2017年4月16日)
10.3969/j.issn.1673-0364.2017.03.003
200237上海市华东理工大学化工学院。
岑莲(E-mail:cenlian@hotmail.com)。
