芽孢杆菌NY3的鉴定及其对鸡毛菜的促生效果
2017-07-15邢芳芳高明夫胡兆平范玲超
邢芳芳+高明夫+胡兆平+范玲超


摘要:在形态分类的基础上,结合分子鉴定手段对芽孢杆菌NY3进行分类鉴定;并将芽孢杆菌NY3进行液体发酵培养,在温室条件下,研究NY3菌株对鸡毛菜(Brassica chinensis)的促生效果。依据NY3的培养性状、显微特征描述和系统发育分析,显示菌株NY3属于蜡样芽孢杆菌(Bacillus cereus);在温室盆栽试验中,添加NY3菌剂的各处理生物量、叶绿素均比CK增加,其中,添加1.0 mL(T3,有机无机复混肥+ NY3菌剂1.0 mL,含芽孢杆菌1.0×109 CFU)增产最高,鲜重、干重比对照组分别提高20.28%、14.34%。
关键词:形态特征;分子鉴定;促生效果;蜡样芽孢杆菌(Bacillus cereus)
中图分类号:S476 文献标识码:A 文章编号:0439-8114(2017)12-2239-04
DOI:10.14088/j.cnki.issn0439-8114.2017.12.011
Identification of Bacillus spp. NY3 and Its Growth Promoting
Effect on Brassica chinensis
XING Fang-fang, GAO Ming-fu, HU Zhao-ping, FAN Ling-chao
(Kingenta Ecological Engineering Group Co.,Ltd./State Key Laboratory of Nutrition Resources Integrated Utilization,Linyi 276700,Shandong,China)
Abstract: NY3 was classified and identified by combining morphological classification with molecular identification means. After fermentation of Bacillus spp. NY3, under the condition of the greenhouse,the growth promoting effect of NY3 on Brassica chinensis was researched. According to the description of culture characters and microscopic characteristics of NY3, combining molecular identification, the strain NY3 was identified as B. cereus. NY3 has obvious effect on promoting growth of B. chinensis, the adding of 1 mL(T3,Organic inorganic fertilizer+NY3 bacterial agent 1.0 mL) NY3 agents had the best effect on increasing the biological yield and SPAD significantly, which contained 1.0×109 CFU/mL spores of NY3. Compared with CK, fresh weight and dry weight of T3 was increased by 20.28% and 14.34%, respectively.
Key words: morphologic character; molecular identification; growth promoting effect; Bacillus cereus
芽孢杆菌是一类需氧或兼性厌氧的革兰氏阳性细菌(目前也发现有革兰氏阴性),因其抗逆性强、繁殖速度快、易于生产、定殖等特点,被广泛应用于生物肥料的研究与生产中。芽孢杆菌在自然界分布广泛,生理特性丰富多样,是土壤和植物微生态优势种群之一。它可以产生抗菌肽类物质,对根腐病、立枯丝核病等多种病原菌均能起到很好的抑制作用[1]。蜡样芽孢杆菌(Bacillus cereus)是芽孢杆菌的一种,其芽孢对高温、干旱、盐胁迫等极端环境有较强的抵抗能力,当环境条件适宜时,芽孢迅速萌发,在环境条件较恶劣时,芽孢快速形成,进入休眠状态。蜡样芽孢杆菌具有促进植物生长、提高作物产量、抑制作物病害的功能,部分蜡样芽孢杆菌还具有抑菌和杀虫作用。蜡样芽孢杆菌在繁殖、代谢过程中可以产生多种具有抑菌、杀菌活性的代谢产物,能够抑制有害微生物的繁殖,抑制镰刀菌、立枯丝核菌等病原真菌[2,3]。菌体代谢过程中还能分泌蛋白酶、脂肪酶、淀粉酶等多种活性酶类,能够降解土壤中的有机物,改善生态环境,促进作物生长。蜡样芽孢杆菌的芽孢具有较强的耐热、耐盐等抗逆性,在发酵工艺、剂型加工、货架期、定殖能力等方面与其他芽孢杆菌相比具有无可比拟的优势。蜡样芽孢杆菌因其独特的功能特性,已经被广泛应用于农业、医药、畜牧业等领域[4,5]。
本研究对实验室保藏的一株筛分自健康、高产番茄根际土壤的芽孢杆菌NY3进行了鉴定,并将菌株NY3进行液体发酵制备菌剂,通过盆栽试验研究活体菌剂对鸡毛菜生长季产量的影响,为该芽孢杆菌剂的进一步推广提供依据。
1 材料与方法
1.1 材料
1.1.1 供試菌株 芽孢杆菌NY3保藏于金正大生态工程集团股份有限公司菌种保藏室,筛分自山东省临沂市大棚健康、高产番茄根际土壤。
1.1.2 培养基 牛肉膏蛋白胨培养基:牛肉膏5.0 g,蛋白胨10.0 g,NaCl 5.0 g,琼脂18.0 g,去离子水1 000 mL,pH 7.0~7.2,105 Pa灭菌30 min;蜡样芽孢杆菌选择培养基:称取甘露醇卵黄多黏菌素琼脂基础(MYP,青岛海博生物技术有限公司)4.6 g,加热溶解于100 mL去离子水中,经121 ℃高压灭菌15 min,待培养基冷却至50 ℃时,每瓶加入50%卵黄乳液5 mL及多黏菌素B 10 000 IU,摇匀,倾入无菌平皿;种子培养基[6]:胰蛋白胨8.0 g,酵母提取物5.0 g,葡萄糖10.0 g,NaCl 5.0 g,去离子水1 000 mL,pH 7.0,分装于300 mL三角烧瓶,每瓶50 mL,105 Pa灭菌15 min;菌株发酵培养基[6]:玉米淀粉2.0 g,黄豆饼粉5.0 g,酵母粉0.55 g、K2HPO4 0.03 g,MgSO4·7H2O 0.02 g,CaCO3 0.05 g,ZnSO4 0.02 g,去离子水100 mL,pH 7.2,装入500 mL三角烧瓶中,105 Pa灭菌20 min。
1.2 方法
1.2.1 芽孢杆菌NY3形态观察 将斜面上保藏的NY3接种到MYP培养基平板上,37 ℃培养24 h,用于观察菌落和菌体的形态特征。
1.2.2 菌株NY3的活化 取冰箱保存的试管斜面,划线活化于牛肉膏蛋白胨培养基平板,置于37 ℃生化培养箱中倒置培养,连续传代两次即得到活化菌株。
1.2.3 菌株NY3制剂的制备 挑取活化后的健壮NY3菌落接种于种子培养基中,35 ℃、200 r/min条件下摇床培养18 h后,按照10%接种量接种于发酵培养基中,每瓶发酵培养基接种10 mL,200 r/min摇床培养32 h,即得NY3发酵液。离心发酵液得上清液和菌体沉淀,将菌体沉淀用去离子水配成含有109 CFU/mL的NY3菌剂[7]。
1.2.4 NY3分子生物学鉴定 NY3 16S rDNA PCR扩增参考谢永丽等[8]的方法。将NY3活化菌株接入种子培养基中,装瓶量为70 mL/300 mL,于37 ℃、200 r/min培养24 h,离心收集菌体,并用灭菌滤纸吸干多余水分,利用Ezup柱式细菌基因组DNA抽提试剂盒(生工生物工程(上海)股份有限公司),提取NY3基因组,扩增引物分别为16S rDNA通用引物27F:5′-AGTTTGATCMTGGCTCAG-3′,1492R:5′-GGTTACCTTGTTACGACTT-3′,引物由生工生物工程(上海)股份有限公司合成,PCR反应体系:10×Buffer 2.5 μL,dNTP 1.0 μL,引物27F 0.5 μL,1492R 0.5 μL,Taq酶0.2 μL,G1基因组0.5 μL,加无菌水至25 μL。PCR反应条件:95 ℃预变性3 min,95 ℃变性35 s,55 ℃退火45 s,72 ℃延伸90 min,共25个循环,72 ℃延伸10 min,4 ℃终止反应。由生工生物工程(上海)股份有限公司对PCR产物测序。将测得的16S rDNA序列与GenBank数据库中相似性高的相关菌株的16S rDNA序列进行比对[9]。
1.2.5 鸡毛菜盆栽试验 于2016年1月9日至2月18日在金正大生态工程集团股份有限公司的智能玻璃温室中进行。
供试鸡毛菜(Brassica chinensis),在本地种子站购得,为本地常用品种;供试底肥为山东泉林嘉有肥料有限责任公司生产的黄腐酸有机无机复混肥(13-13-5),有机质≥150 g/kg,黄腐酸≥80 g/kg。NY3芽孢杆菌剂为芽孢杆菌数为1.0×109 CFU/mL的活菌制剂;供试土壤为棕壤,有机质含量为12.6 g/kg。
设4个处理,每个处理4个重复,每盆装土2 kg,有机无机复混肥的施用量为750 kg/hm2,全部肥料作为基肥一次性施入。CK为对照,不施用菌剂;处理组为使用不同用量的菌剂,处理1(T1)添加NY3菌剂0.1 mL(含芽孢杆菌1.0×108 CFU);处理2(T2)添加NY3菌剂0.5 mL(含芽孢杆菌5.0×108 CFU),处理3(T3)添加NY3菌剂1.0 mL(含芽孢杆菌1.0×109 CFU),每盆播种10株以上的鸡毛菜种子。待鸡毛菜长出2片真叶后间苗定植,每盆1株,于收获时测定鲜重、叶绿素和叶片数,烘干后称干重。
1.2.6 叶片数、生理指标测定 叶片数只选择绿色可食用部分;叶绿素含量测定采用SPAD-502Plus型叶绿素测定仪进行;干重测定按常规方法进行[10,11]。
1.2.7 数据分析 试验数据采用Excel进行处理,利用SPSS 16.0软件进行数据统计及差异显著性分析。
2 结果与分析
2.1 NY3菌株的形态观察
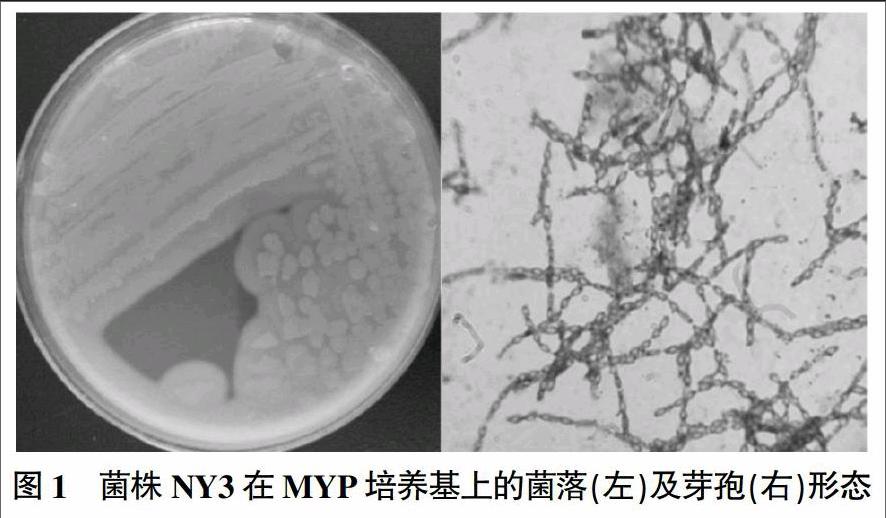
NY3菌落在MYP培养基上生长良好,菌落为粉红色,周围有粉红色晕圈,表面粗糙似融蜡状,不透明(图1,左);通过光学显微镜观察芽孢形态,芽孢呈链状排列,圆形或椭圆形,直径1.0~1.5 μm,革兰氏染色呈阳性(图1,右)。
2.2 菌株16S rDNA基因序列扩增与测序
PCR扩增片段电泳结果如图2所示,芽孢杆菌NY3 16S rDNA基因序列扩增后片段长度为1 449 bp。
由图3可知,芽孢杆菌NY3与蜡样芽孢杆菌ATCC 14579同源性最高,匹配程度可达到100%,结合菌株形态及显微镜观察,确定NY3为蜡样芽孢杆菌。
2.3 芽孢杆菌NY3对叶绿素含量、鸡毛菜叶片数的影响
由图4可知,与CK相比,施用菌剂的各处理均提高了鸡毛菜叶片中叶绿素含量,差异均不显著。其中,添加NY3菌剂0.1 mL(T1)的鸡毛菜叶片叶绿素含量提高1.93%,添加NY3菌剂0.5 mL(T2)叶绿素含量提高3.18%,添加NY3菌剂1.0 mL(T3)叶绿素含量提高3.66%。就葉片数而言,与CK相比,各处理均提高了鸡毛菜叶片数。其中,T1较CK叶片数增加2.78%,T2较CK叶片数增加5.56%,T3较CK叶片数增加6.94%,T2、T3与CK相比差异显著。表明在施加有机无机复混肥为底肥的情况下每盆施用0.1×108~1.0×109 CFU的蜡样芽孢杆菌NY3活体可以提高叶绿素含量,增加叶片数,其中,T2、T3与CK相比对叶片数有显著增加作用。
2.4 芽孢杆菌NY3对鸡毛菜鲜重、干重的影响
由表1可知,与CK相比,添加NY3菌剂的处理鲜重增加3.51~7.78 g,干重增加0.05~0.44 g。其中,添加NY3菌剂0.1 mL(T1)较对照(CK)鲜重增加9.15%,干重增加1.64%,添加NY3菌剂0.5 mL(T2)较CK鲜重增加15.66%,干重增加11.15%,添加NY3菌剂1.0 mL(T3)增产最高,较CK鲜重增加20.28%,干重增加14.43%。表明在施加有机无机复混肥的基础上增施蜡样芽孢杆菌NY3菌剂,可增加鸡毛菜的鲜重和干重,且每盆增施蜡样芽孢杆菌0.5×109~1.0×109 CFU NY3活体芽孢,可极显著增加鸡毛菜的鲜重和干重。
3 小结与讨论
通过分子生物学鉴定,结合形态观察,确定NY3菌株为蜡样芽孢杆菌。
对蜡样芽孢杆菌NY3进行促生效果评价,施加NY3菌剂0.1、0.5、1.0 mL,对鸡毛菜的生长均起到了促进作用,提高了其对水分的吸收、干物质的积累以及叶片叶绿素含量。其中,添加NY3菌剂1.0 mL(T3)较CK鲜重提高20.28%,干重提高14.43%。表明蜡样芽孢杆菌NY3对鸡毛菜的生长有明显的促进作用,有效活菌数越高对鸡毛菜的促生效果越明显。但在提高叶绿素含量方面差异不明显,而添加NY3菌剂0.5~1.0 mL能显著增加鸡毛菜叶片数。
芽孢杆菌作为一种资源丰富的微生物类群,具有广谱的植物病害防治、促进作物生长、诱导植物抗性等作用,已发现有芽孢杆菌菌株能有效促进植物的生长和发育,提高植物产量。芽孢杆菌能赋予宿主植物耐受非生物胁迫的能力,并在缓解强胁迫的环境压力,如干旱、盐碱、低温以及重金属污染等发面发挥重要作用。目前,微生物菌剂作用的稳定性常受到外界环境的影响,尤其是田间降水、温度、土壤pH以及土壤微环境等,均会对微生物菌剂作用的发挥带来影响。因此,后续试验还需在不同土壤环境和不同气候的条件下,对蜡样芽孢杆菌NY3的促生效果进行研究和验证,为其开发成良好的农用微生物菌剂奠定基础。
参考文献:
[1] 张艳群,来航线,韦小敏,等.生物肥料多功能芽孢杆菌的筛选及其作用机理研究[J].植物营养与肥料学報,2013,19(2):489-497.
[2] 管 珺,杨文革,王瑞荣,等.蜡样芽孢杆菌CMCC63305的促生·抑菌及杀虫作用研究[J].安徽农业科学,2010,38(1):228-230.
[3] 傅 莹,黄益燕,肖爱萍,等.蜡状芽孢杆菌菌株255诱导香蕉产生抗性相关酶初步研究[J].广东农业科学,2011(9):75-77.
[4] 陈 冲,王程亮,张潞生,等.蜡状芽孢杆菌TS-02防治草莓白粉病研究[J].安徽农业科学,2007,35(11):3298-3300.
[5] 朱玥妍,刘 姣,杜春梅.芽孢杆菌生物防治植物病害研究进展[J].安徽农业科学,2012,40(34):16635-16658.
[6] SAMBROOK J,RUSSELL D W. Molecular Cloning:A Laboratory manual[M].3rd ed. NewYork:Cold Spring Harbor Laboratory Press,2001.
[7] 秦 艳,李卫芬,余东游.蜡样芽孢杆菌发酵条件的优化[J].饲料工业,2008,29(2):34-37.
[8] 谢永丽,王自章,刘 强,等.草坪草狗牙根中抗逆基因BeDREB的克隆及功能鉴定[J].中国生物化学与分子生物学报,2005, 21(4):521-527.
[9] 郭芳芳,谢 镇,卢 鹏,等.一株多粘类芽孢杆菌的鉴定及其生防促生效果初步测定[J].中国生物防治学报,2014,30(4):489-496.
[10] 鲁如坤.土壤农业化学分析方法[M].北京:中国农业科学技术出版社,2000.
[11] 鲍士旦.土壤农化分析[M].北京:中国农业出版社,1999.
