艾司奥美拉唑钠对重症急性胰腺炎患者肠黏膜屏障功能及炎性反应的影响
2017-07-14马忠伟王秋玲黄东力
马忠伟* 王秋玲黄东力
(1 山东省昌邑市人民医院集中采购办公室,山东 昌邑 261300;2 山东省昌邑市人民医院 普外一科,山东 昌邑 261300;3 山东省昌邑市人民医院普外二科,山东 昌邑 261300)
艾司奥美拉唑钠对重症急性胰腺炎患者肠黏膜屏障功能及炎性反应的影响
马忠伟1* 王秋玲2黄东力3
(1 山东省昌邑市人民医院集中采购办公室,山东 昌邑 261300;2 山东省昌邑市人民医院 普外一科,山东 昌邑 261300;3 山东省昌邑市人民医院普外二科,山东 昌邑 261300)
目的 探讨艾司奥美拉唑钠对重症急性胰腺炎(severe acute pancreatitis,SAP)的临床疗效。方法 采用回顾性分析法,将本院收治的102例SAP患者根据治疗方法进行分组:A组(肠外营养组)、B组(肠内营养组)、C组(艾司奥美拉唑钠+肠内营养组)。各组入院后均进行基础治疗,在此基础上A组给予肠外营养治疗,B组给予早期肠内营养治疗,C组在B组治疗基础上加用质子泵抑制剂艾司奥美拉唑钠。疗程均为14 d。各组治疗前、治疗后7 d时采用比浊法检测血浆内毒素水平,采用酶学分光光度法检测血浆D-乳酸、二胺氧化酶水平。采用酶联免疫吸附法(ELISA法)检测血清白细胞介素-6(IL-6)、白细胞介素-8(IL-8)、肿瘤坏死因子-α(TNF-α)、高敏C反应蛋白(hs-CRP)水平。比较各组治疗前后APACHE Ⅱ评分,观察并比较各组患者继发感染率、手术率、病死率、住院时间、住院费用。结果 B、C组治疗后血浆内毒素、D-乳酸、二胺氧化酶、IL-6、IL-8、TNF-α、hs-CRP水平、APACHE Ⅱ评分明显低于A组,经比较差异有统计学意义(P<0.01)。C组治疗后血浆内毒素、D-乳酸、二胺氧化酶、IL-6、IL-8、TNF-α、hs-CRP水平、APACHE Ⅱ评分明显低于B组,经比较差异有统计学意义(P<0.01)。C组继发感染率、手术率、病死率均明显低于A、B组,平均住院时间与平均住院费用均明显少于A、B组,经比较差异有统计学意义(P<0.01)。结论 艾司奥美拉唑钠联合早期肠内营养治疗能明显改善患者肠道黏膜屏障功能,下调机体炎症水平,对SAP的疗效更显著、更稳定。
艾司奥美拉唑钠;重症急性胰腺炎;炎症;肠黏膜
重症急性胰腺炎(severe acute pancreatitis,SAP)常继发感染、全身炎性反应,究其根源,与肠道黏膜屏障受损、细菌和内毒素易位密切相关[1]。在SAP的临床治疗中,保护肠黏膜屏障功能、减轻全身炎性反应为治疗的主要目的。目前,临床上对SAP提倡非手术为主的综合治疗方法,抑酸剂的应用不仅能够显著减少胃酸对胰液分泌的刺激,还可有效预防应激性溃疡的发生发展[2]。艾司奥美拉唑钠为质子泵抑制剂,近年来是临床学者关注的重点与研究的热点。本研究探讨了艾司奥美拉唑钠对SAP的治疗效果与作用机制。为临床相关研究提供客观依据。
1 资料与方法
1.1 一般资料:选取本院2013年12月至2015年12月收治的SAP患者共102例,其中男70例,女32例,年龄35~75岁,平均年龄(49.5±5.0)岁。
纳入标准:首次诊治,临床诊断、实验室检查、影像学检查符合中华医学会外科学分会胰腺外科学组制定的《急性胰腺炎诊治指南(2014版)》中对SAP的诊断标准[3]。排除标准:既往有急性/慢性胰腺炎病史;恶性肿瘤患者;肠道功能障碍患者;发病至入院超过48 h的患者;妊娠妇女。本研究经本院伦理委员会批准并取得患者知情同意,由患者及家属书面签订知情同意书。
1.2 分组:本研究采用回顾性分析法,根据治疗方法将纳入的102例SAP患者进行分组:A组(肠外营养组)、B组(肠内营养组)、C组(艾司奥美拉唑钠+肠内营养组)。各组基线资料差异无统计学意义(P>0.05)。见表1。
1.3 方法
1.3.1 治疗方法。基础治疗:各组入院后均进行胃肠减压、抑制胰酶分泌、抗感染、维持水电解质及酸碱平衡等基础治疗。同时给予科学护理,密切观察患者生命体征等。
表1 各组一般资料比较()
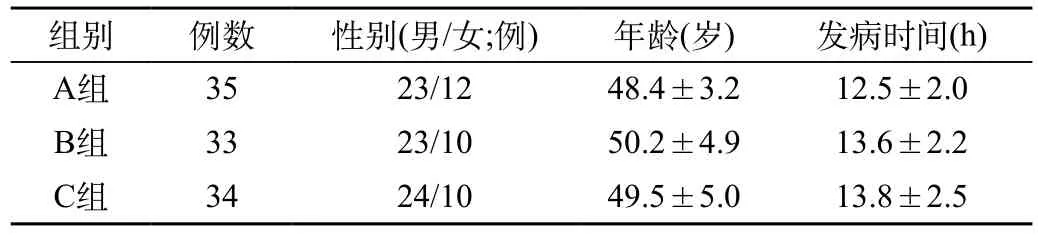
表1 各组一般资料比较()
组别例数性别(男/女;例)年龄(岁)发病时间(h) A组3523/1248.4±3.212.5±2.0 B组3323/1050.2±4.913.6±2.2 C组3424/1049.5±5.013.8±2.5
表2 各组治疗前后血浆内毒素、D-乳酸、二胺氧化酶水平比较()
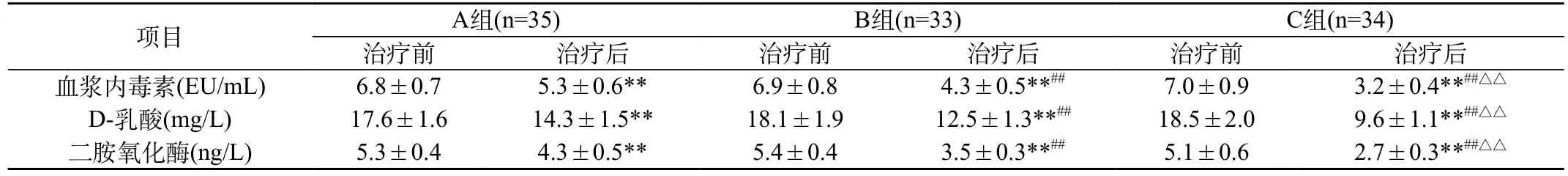
表2 各组治疗前后血浆内毒素、D-乳酸、二胺氧化酶水平比较()
注:与本组治疗前比较,**P<0.01;与A组治疗后比较,##P<0.01;与B组治疗后比较△△P<0.01
项目A组(n=35)B组(n=33)C组(n=34)治疗前治疗后治疗前治疗后治疗前治疗后血浆内毒素(EU/mL)6.8±0.75.3±0.6**6.9±0.84.3±0.5**##7.0±0.93.2±0.4**##△△D-乳酸(mg/L)17.6±1.614.3±1.5**18.1±1.912.5±1.3**##18.5±2.09.6±1.1**##△△二胺氧化酶(ng/L)5.3±0.44.3±0.5**5.4±0.43.5±0.3**##5.1±0.62.7±0.3**##△△
表3 各组治疗前后血清IL-6、IL-8、TNF-α、hs-CRP水平比较()
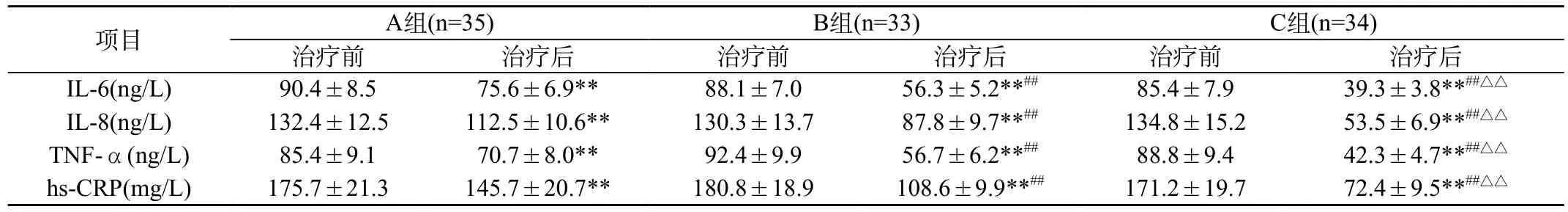
表3 各组治疗前后血清IL-6、IL-8、TNF-α、hs-CRP水平比较()
注:与本组治疗前比较,**P<0.01;与A组治疗后比较,##P<0.01;与B组治疗后比较△△P<0.01
项目A组(n=35)B组(n=33)C组(n=34)治疗前治疗后治疗前治疗后治疗前治疗后IL-6(ng/L)90.4±8.575.6±6.9**88.1±7.056.3±5.2**##85.4±7.939.3±3.8**##△△IL-8(ng/L)132.4±12.5112.5±10.6**130.3±13.787.8±9.7**##134.8±15.253.5±6.9**##△△TNF-α(ng/L)85.4±9.170.7±8.0**92.4±9.956.7±6.2**##88.8±9.442.3±4.7**##△△hs-CRP(mg/L)175.7±21.3145.7±20.7**180.8±18.9108.6±9.9**##171.2±19.772.4±9.5**##△△
营养方法:患者入院后,在生命体征较平稳情况下(发病48 h内)计算所需总热量(按照Harris-Benedict公式),各组分别配制等热量的肠内或肠外营养液。A组采用肠外营养输注泵,通过中心静脉置管持续输入营养液。注意检测血糖、保持氮平衡、维生素及微量元素的充足。B组患者经鼻胃镜放置肠内营养管,经肠内营养输注泵输注营养液。C组在B组治疗基础上加用质子泵抑制剂艾司奥美拉唑钠(商品名:艾速平,正大天晴药业集团股份有限公司生产)40 mg+0.9%氯化钠溶液100 mL,静脉滴注,1次/12小时。
以上治疗疗程均为14 d。
1.3.2 观察指标及检测方法:各组治疗前、治疗后7 d时清晨分别空腹抽取静脉血5 mL。采用比浊法检测血浆内毒素水平,采用酶学分光光度法检测血浆D-乳酸、二胺氧化酶水平。采用酶联免疫吸附法(ELISA法)检测血清白细胞介素-6(IL-6)、白细胞介素-8(IL-8)、肿瘤坏死因子-α(TNF-α)、高敏C反应蛋白(hs-CRP)水平。
比较各组治疗前后APACHE Ⅱ评分,观察并比较各组患者继发感染率、手术率、病死率、住院时间、住院费用。
1.4 统计学方法:实验数据应用SAS9.0软件分析,计量资料用 表示,行方差齐性分析,方差齐者两样本均数比较采用t检验,方差不齐者采用秩和检验;四格表资料采用卡方检验,P<0.05为差异有统计学意义。
2 结 果
2.1 各组治疗前后血浆内毒素、D-乳酸、二胺氧化酶水平比较:各组治疗前血浆内毒素、D-乳酸、二胺氧化酶水平无统计学差异(P>0.05),治疗后水平均明显低于治疗前,经比较差异有统计学意义(P<0.01)。B、C组治疗后血浆内毒素、D-乳酸、二胺氧化酶水平明显低于A组,经比较差异有统计学意义(P<0.01)。C组治疗后血浆内毒素、D-乳酸、二胺氧化酶水平明显低于B组,经比较差异有统计学意义(P<0.01)。见表2。
2.2 各组治疗前后血清IL-6、IL-8、TNF-α、hs-CRP水平比较:各组治疗前血清IL-6、IL-8、TNF-α、hs-CRP水平无明显差异(P>
0.05),治疗后水平均明显低于治疗前,经比较差异有统计学意义(P<0.01)。B组、C组治疗后血清IL-6、IL-8、TNF-α、hs-CRP水平明显低于A组,经比较差异有统计学意义(P<0.01)。C组治疗后血清IL-6、IL-8、TNF-α、hs-CRP水平明显低于B组,经比较差异有统计学意义(P<0.01)。见表3。
2.3 各组治疗前后APACHE Ⅱ评分比较:A、B、C组治疗前APACHEⅡ评分分别为(12.5±1.5)分、(13.4±1.6)分、(13.0±1.4)分;治疗后APACHE Ⅱ评分分别为(10.3±1.1)分、(6.3±0.7)分、(3.8±0.5)分。各组治疗后APACHE Ⅱ评分均较治疗前明显降低,经比较差异有统计学意义(P<0.05);B、C组治疗后APACHE Ⅱ评分明显低于A组治疗后,C组治疗后APACHE Ⅱ评分明显低于B组治疗后,经比较差异有统计学意义(P<0.05)。
2.4 各组继发感染率、手术率、病死率、住院时间、住院费用比较:由表4可见,B、C组继发感染率、手术率、病死率均明显低于A组,平均住院时间与平均住院费用均明显少于A组,经比较差异有统计学意义(P<0.01)。C组继发感染率、手术率、病死率均明显低于B组,平均住院时间与平均住院费用均明显少于B组,经比较差异有统计学意义(P<0.01)。
表4 各组继发感染率、手术率、病死率、住院时间、住院费用比较()
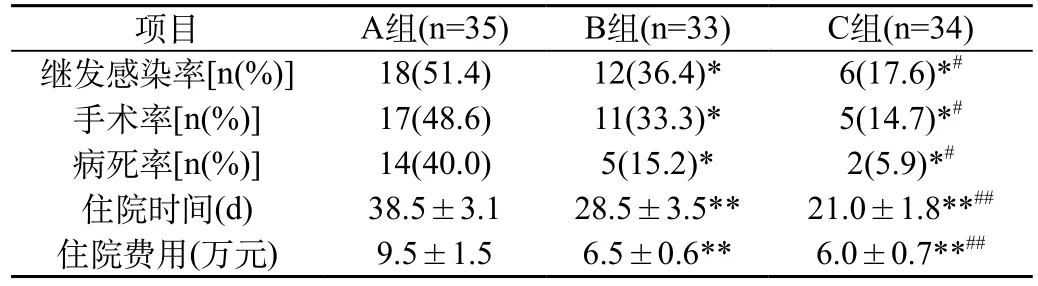
表4 各组继发感染率、手术率、病死率、住院时间、住院费用比较()
注:与A组比较,*P<0.05,**P<0.01;与B组比较,#P<0.05,##P<0.01
项目A组(n=35)B组(n=33)C组(n=34)继发感染率[n(%)]18(51.4)12(36.4)*6(17.6)*#手术率[n(%)]17(48.6)11(33.3)*5(14.7)*#病死率[n(%)]14(40.0)5(15.2)*2(5.9)*#住院时间(d)38.5±3.128.5±3.5**21.0±1.8**##住院费用(万元)9.5±1.56.5±0.6**6.0±0.7**##
3 讨 论
研究[4]表明,重症急性胰腺炎(SAP)常继发感染、全身炎性反应,甚至多脏器功能衰竭,病死率高达36%~50%。究其根源,与肠道黏膜屏障受损、细菌和内毒素易位密切相关。因此,在SAP的临床治疗中,保护肠黏膜屏障功能、减轻全身炎性反应为治疗的主要目的,以期最终达到减少多脏器功能衰竭发生的治疗效果[5]。目前,SAP的营养模式正在发生变化,与肠外营养相比较,早期肠内营养更能够增加肠道血流,防治肠道黏膜萎缩,在保护肠道黏膜代谢及免疫功能方面发挥更佳的作用。因此,临床上提倡非手术为主的综合治疗方法,在综合治疗中抑酸剂的应用至关重要,不仅能够显著减少胃酸对胰液分泌的刺激,还可有效预防应激性溃疡的发生发展。
艾司奥美拉唑钠为质子泵抑制剂,是具有强效、持久、快速抑酸等优势的临床抑酸治疗一线药物,已获得临床路径及多个指南/共识的一致推荐。近年来,国内外关于艾司奥美拉唑与SAP的相关研究较少,但却是临床学者关注的重点与研究的热点。本研究以SAP患者的肠黏膜屏障功能相关指标、炎症指标、临床疗效、安全性等为观察靶点,探讨艾司奥美拉唑钠对SAP的治疗效果与作用机制。为临床相关研究提供客观依据。
SAP病程早期,单核巨噬细胞系统释放大量促炎介质,可加重胰腺损伤。释放大量的IL-6可诱导机体急性反应蛋白合成,在免疫应答、急性期反应等多方面发挥重要作用[6]。某[7]的研究表明,血清中IL-6的浓度变化可作为早期识别急性胰腺炎的有效指标。IL-8与急性胰腺炎患者病情向重症化发展密切相关,研究[8]显示,在SAP患者中普遍存在血清IL-8水平明显升高的现象,提示IL-8与SAP病情发展密切相关。TNF-α为评价机体炎症活动度的敏感指标,可造成细胞因子及炎性介质的大量释放,间接加重SAP病情。相关报道[9]称,在SAP早期即存在血清TNF-α水平明显升高的现象。CRP与机体严重程度、范围存在一定平行性,SAP患者的整个病程中均存在血清CRP水平明显升高的现象[10],提示CRP可作为评价急性胰腺炎严重程度的指标。本研究显示,各组治疗后血清IL-6、IL-8、TNF-α、hs-CRP水平均明显低于治疗前,提示经过治疗SAP患者机体炎症水平有下降趋势。C组治疗后血清IL-6、IL-8、TNF-α、hs-CRP水平明显低于A、B组,提示艾司奥美拉唑钠在下调SAP患者血清炎症方面疗效更显著。
肠道是SAP急性应激反应的中心器官,肠道黏膜屏障的完整性对抵抗肠源性细菌具有重要作用。SAP早期即有肠黏膜屏障完整性破坏的现象,血浆内毒素水平升高,表明肠黏膜屏障破坏时导致严重革兰阴性菌感染,大量内毒素释放入血。D-乳酸由肠道细菌产生,当肠黏膜通透性增加时可进入血液循环[11]。当肠黏膜脱落时,小肠黏膜和纤毛上皮细胞中的二胺氧化酶可进入血液。因此,当血中内毒素、D-乳酸、二胺氧化酶水平升高时,表明肠黏膜屏障受到破坏,升高的水平越大,说明肠黏膜受损越重。本研究显示,各组治疗后血浆内毒素、D-乳酸、二胺氧化酶水平均明显低于治疗前。C组治疗后血浆内毒素、D-乳酸、二胺氧化酶水平明显低于A、B组,提示艾司奥美拉唑钠能明显改善SAP患者的肠黏膜屏障功能。我们研究还发现,在APACHE Ⅱ评分、继发感染率、手术率、病死率、住院时间、住院费用等方面,联合艾司奥美拉唑钠的C组较A、B组具有明显优势。
综上所述,艾司奥美拉唑钠联合早期肠内营养治疗能明显改善患者肠道黏膜屏障功能,下调机体炎症水平,对SAP的疗效更显著、更稳定。
[1] 普小开.重症急性胰腺炎早期器官损害的特征及防治对策[J].中外医学研究,2016,14(20): 152-153.
[2] 许爱平,李淑德.重症急性胰腺炎治疗研究进展[J].世界华人消化杂志,2010,18(3):213-216.
[3] 中华医学会外科学分会胰腺外科学组.急性胰腺炎诊治指南(2014版) [J].中华消化外科杂志,2015,14(1): 1-5.
[4] Cc P,Dc B,Oc R,et al.Mortality prognostic factors in acute pancreatitis[J].J Med Life,2016,9(4):413-418.
[5] Hostinská E,Huml K,Pilka R.Acute pancreatitis in pregnancy, complicated by rupture of aneurysm of artery lienalis[J].Ceska Gynekol,2016,81(3):208-211.
[6] 李红光,周总光,雷松,等.人急性胰腺炎早期外周血单核细胞Toll样受体4及CD14表达变化[J].中华肝胆外科杂志,2006,12(11): 767-770.
[7] Novotny D,Malina P,Krumpholcova P,et al.Total Adiponectin, Adipocyte Fatty Acid Binding Protein,Fibroblast Growth Factor 21 and Proinflammatory Marker Levels During the Early Stage of Acute Pancreatitis-A Pilot Study[J].Clin Lab,2015,61(9):1119-1128.
[8] 梁春虹,谭恰,熊伟.HBP联合IL-8 PCT检测在急性重症胰腺炎继发感染中的诊断价值[J].浙江临床医学,2016,18(7): 1327-1328.
[9] 施建设,杜振双,郑佳隆,等.高容量血液滤过下液体平衡对急性重症胰腺炎早期腹内压力的影响[J].肝胆外科杂志,2016,24(2): 130-132.
[10] Kyhälä L,Lindström O,Kylänpää L,et al.Activated protein C retards recovery from coagulopathy in severe acute pancreatitis[J].Scand J Clin Lab Invest,2016,76(1):10-16.
[11] 张乐,韩娟,范震.ERCP治疗ABP细胞因子及小肠黏膜COX-2蛋白研究[J].浙江临床医学,2016,18(1): 23-25.
Effects of Estradiol Sodium on Intestinal Mucosal Barrier Function and Inflammatory Response in Patients with Severe Acute Pancreatitis
MA Zhong-wei1, WANG Qiu-ling2, HUANG Dong-li3
(1 Department of Centralized Of fi ce, Changyi People’s Hospital, Changyi 261300, China; 2 No.1 Department of General Surgery, Changyi People’s Hospital, Changyi 261300, China; 3 No.2 Department of General Surgery, Changyi People’s Hospital, Changyi 261300, China)
Objective To explore the influence of Esomeprazole Sodium on severe acute pancreatitis. Methods Using retrospective analysis method, 102 patients with SAP were divided into group A (parenteral nutrition) and group B (enteral nutrition), group C (enteral nutrition+Esomeprazole Sodium). Before and after treatment, using turbidimetric method to detect the plasma endotoxin level, enzymatic spectrophotometry to detect the plasma D-lactic acid, diamine oxidase level. Using ELISA method to detect the serum IL-6, IL-8, TNF-α, hs-CRP levels. Comparison the APACHE Ⅱ score, secondary infection, operation rate, mortality, length of hospital stay, hospital expenses Results After treatment, C group of plasma endotoxin, D-lactic acid, diamine oxidase, IL-6, IL-8, TNF-α, hs-CRP level, the APACHE Ⅱ score was lower than that group A and B (P<0.01). Secondary infection rate, operation rate, mortality rate was lower in group C than group A, B. In group C The average hospitalization time and average hospitalization expenses were signifcantly less than group A, B (P<0.01). Conclusion Esomeprazole Sodium with early enteral nutrition therapy can obviously improve the intestinal mucosal barrier function, cut the body infammation levels, curative effect is more signifcant and more stable for SAP.
Esomeprazole sodium; Severe acute pancreatitis; Infammation; Intestinal mucosa
R576
B
1671-8194(2017)17-0012-03
*通讯作者:E-mail:Cymzw@163.com
