Sulfolobus acidocaldarius ATCC 33909麦芽寡糖基海藻糖合成酶在Bacillus subtilis中的重组表达和发酵优化
2017-07-12韩唱宿玲恰吴敬
韩唱 宿玲恰 吴敬
(江南大学生物工程学院 工业生物技术教育部重点实验室 江南大学食品科学与技术国家重点实验室,无锡 214122)
Sulfolobus acidocaldarius ATCC 33909麦芽寡糖基海藻糖合成酶在Bacillus subtilis中的重组表达和发酵优化
韩唱 宿玲恰 吴敬
(江南大学生物工程学院 工业生物技术教育部重点实验室 江南大学食品科学与技术国家重点实验室,无锡 214122)
为实现Sulfolobus acidocaldarius ATCC 33909来源的麦芽寡糖基海藻糖合成酶(MTSase)基因treY在 枯草芽孢杆菌(Bacillus subtilis)中的重组表达,以质粒pET-24a(+)-treY为模板PCR扩增得到目的基因,并与表达载体pHY300PLK连接,转入表达宿主Bacillus subtilis CCTCC M 2016536中,重组菌在TB培养基中培养48 h后MTSase酶活达到17.5 U/mL;在此基础上对重组菌发酵条件进行优化,通过单因素实验(氮源种类、氮源复配、氮源浓度、碳源种类、葡萄糖浓度、初始pH、诱导温度)和正交实验(氮源浓度、葡萄糖浓度、初始pH、诱导温度)确定其摇瓶发酵产酶的最适培养基和培养条件为:氮源(工业蛋白胨∶棉籽粉=3∶1)48.0 g/L、葡萄糖为10.0 g/L、培养基初始pH为7.0,最适培养温度为30℃;在此条件下,MTSase的酶活可达41.5 U/ mL,是优化前的2.4倍。
麦芽寡糖基海藻糖合成酶;枯草芽孢杆菌;重组表达;发酵优化
海藻糖(α-D-吡喃葡糖基-α-D-吡喃葡糖苷)是自然界中独一无二的非还原性糖,是由两个吡喃型葡萄糖单体以α,α-1,1-糖苷键连接而成的双糖,有保护生物大分子抵抗不利环境的功能,它无色、无味并且性质稳定,在自然中广泛分布[1-3];大量研究表明,海藻糖的生物学功能多种多样,海藻糖既能作为储存碳源和提供能量的物质,也能在极端环境下对生物体起到重要的保护作用,海藻糖特殊的性质使其在各个领域均有应用,如食品、医药和化妆品等[4-6]。
工业上生产海藻糖主要包括微生物提取法、单酶法与双酶法,其中双酶法因为能够以较为便宜的淀粉为底物生产海藻糖而具有较高的应用价值[7];双酶法包括麦芽寡糖基海藻糖合成酶(MTSase,EC 5.4.99.15)与麦芽寡糖基海藻糖水解酶 (MTHase,EC 3.2.1.141)。MTSase能够催化麦芽寡糖(n)还原性末端的α-1,4糖苷键变成α-1,1糖苷键,生成麦芽寡糖基海藻糖;MTHase 能够水解麦芽寡糖基海藻糖中与α-1,1糖苷键相邻的α-1,4糖苷键从而得到海藻糖和麦芽寡糖(n-2),而麦芽寡糖(n-2)能够继续进行下一轮反应,因此将MTSase与MTHase复配能够以淀粉为底物生产海藻糖[8-10]。
自从日本林原生化研究所从节杆菌Arthrobacter sp. Q36中发现MTSase和MTHase[11],多种能够合成MTSase和MTHase的菌株陆续被发现,如分支节杆菌(Arthrobacter ramosus S34),嗜热硫矿硫化叶菌(Sulfolobus solfataricus ATCC 35092),嗜热硫矿硫化叶菌(Sulfolobus solfataricus KM1),嗜热硫矿硫化叶菌(Sulfolobus solfataricus MT4),根瘤菌(Rhizobium sp. M-11)等[12-15]。
目前已有多篇文章报道了不同来源MTSase的异源表达,Masaru将来源于Sulfolobus solfataricus KM1的MTSase和MTHase基因在大肠杆菌中表达并用纯化后的MTSase和MTHase作用于淀粉生产海藻糖,转化率达到81.5%[16];吴襟等[17]将Sulfolobus acidocaldarius ATCC 49426来源的MTSase基因在大肠杆菌中进行克隆与表达,最高酶活达到21.1 U/g(wet cell);张文德等[18]从谷氨酸棒杆菌(Corynebacterium glutamicum)中克隆出MTSase基因并在E.coli BL21(DE3)中表达,可溶性蛋白占细胞总蛋白的45.3%;到目前为止,还没有相关文献提到MTSase在枯草芽孢杆菌中的异源表达。枯草芽孢杆菌(Bacillus subtilis)是一种原核表达宿主,是微生物研究的模式菌株,因其较强的分泌蛋白质的能力和非致病性而广泛应用于工业生产[19,20],已被美国食品药物管理局和中国相关部门认定为食品安全级菌株。本研究首次将 Sulfolobus acidocaldariusATCC 33909来源的麦芽寡糖基海藻糖合成酶基因在枯草芽孢杆菌中进行克隆表达,并对制备重组MTSase的发酵培养基进行优化。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒 菌株Escherichia coli JM109和Bacillus subtilis CCTCC M 2016536由本实验室保藏;质粒pHY300PLK、pET-24a(+)-treY由本实验室保藏。
1.1.2 酶与主要试剂 Hind III限制性内切酶,Primer Star Taq DNA 聚合酶,dNTPs,氨苄抗生素,四环素,In-Fusion HD Cloning Plus kit均购自宝生物;DNA 纯化试剂盒购自上海生工;蛋白胨、酵母粉购自英国Oxiod公司;其他试剂如蔗糖、葡萄糖等购自国药集团。
1.1.3 培养基 Luria-Bertani(LB)培养基(g/L):蛋白胨10.0,酵母粉5.0,NaCl 10.0,pH 7.0(使用2 mol/L盐酸2 mol/L NaOH调节pH,与固体培养基加1.5%-2.0%的琼脂粉)。
Terrific Broth(TB)培养基(g/L):蛋白胨12.0,酵母粉24.0,甘油4.0,KH2PO42.3,K2HPO4·3H2O 16.4;pH7.0(使用2 mol/L盐酸2 mol/L NaOH调节pH)
1.2 方法
1.2.1 引物设计 以质粒pET-24a(+)-treY为模板,按照同源臂设计原则设计如下引物:F1:5'-AG GAGAGGGTAAAGAATGATTAGCGCGACCTATCG-3' ;R1:5'-TCTTTACCCTCTCCTTTTAAAAAAAT-3'。
以质粒pHY300PLK为模板,按照同源臂设计原则设计如下引物:F2:5'-AAGCTTGGTAATAAAA AAACACCTCC-3';R2:5'-TCTTTACCCTCTCCTTTTA AAAAAAT-3'。
1.2.2 PCR获得目的基因与表达载体 以质粒pET-24a(+)-treY为模板,F1/R1为正反向引物扩增treY基因片段;PCR参数:94℃预变性5 min;98℃变性10 s,55℃退火5 s,72℃延伸2.5 min,30个循环;最后72℃保存10 min,4℃保温。
以质粒pHY300PLK为模板,F2/R2为正反向引物扩增表达载体片段。PCR参数:94℃预变性10 min;98℃变性10 s,55℃退火10 s,72℃延伸5 min 55 s,30个循环;最后72℃保存10 min,4℃保温。1.2.3 连接与鉴定 将1.2.2步骤PCR得到的目的基因与表达载体用In-Fusion连接酶连接后转入E.coli JM109,涂布LB固体培养基(含100 μg/mL氨苄抗生素),37℃培养箱过夜培养,挑取单菌落至LB液体培养基中培养8 h后收集菌体并提取质粒,用Hind III酶切正确后送测序公司测序。测序正确的质粒转化至表达宿主B. subtilis中,涂布LB固体培养基(含20 μg/mL四环素抗性),37℃培养箱过夜培养,挑取单菌落至LB液体培养基中(含20 μg/mL四环素抗性),37℃培养10 h后保甘油菌并收集菌体提取质粒,用Hind III酶切正确后即可确定转入表达宿主中。
1.2.4 摇瓶发酵及重组蛋白的检测 将保存菌种以2%的接种量接种至LB液体培养基(含100 μg/mL四环素抗性),37℃、200 r/min培养10 h后,以5%接种量接种至TB培养基,37℃、200 r/min培养至2 h后转移至33℃培养46 h。发酵结束后12 000 r/min离心收集菌体。将菌体重悬至20 mmol/L Tris-HCl(pH8.0)溶液中,用高压匀浆机对菌体进行破壁,4℃,12 000 r/min离心25 min,收集上清即为目标酶液;使用SDS-PAGE对重组蛋白酶进行检测。
1.2.5 重组蛋白酶活力测定 将麦芽六糖溶解于20 mmol/L pH5.5的醋酸-醋酸钠缓冲液中,配成1%的麦芽六糖溶液,取190 μL该溶液,加入10 μL MTSase酶液,60℃反应10 min,100℃沸水中煮10 min终止反应,DNS法测酶活[21],具体方法为取100 μL反应液与900 μL水和1 mL DNS混合后煮沸7 min,冷却后向其中加入8 mL水混匀,在540 nm处测量吸光度。MTSase的酶活单位定义为每1 min转化1 μmol麦芽六糖生成麦芽四糖基海藻糖所需的酶量[22]。
1.2.6 菌浓(OD600)的测定 将发酵液稀释适当倍数后,使用分光光度计在600 nm处测定吸光值,菌浓(OD600)=稀释倍数×分光光度计在600 nm处读数。
1.2.7 摇瓶发酵培养基对重组菌产酶的影响 通过单因素实验考察氮源种类(工业酵母粉、工业蛋白胨、鱼粉蛋白胨、大豆蛋白胨、牛肉浸膏、酪蛋白、棉籽粉、多聚蛋白胨、胰蛋白胨和牛肉粉)、氮源复配(工业蛋白胨与棉籽粉)、氮源浓度(12.0、24.0、36.0、48.0和60.0 g/L)、碳源种类(葡萄糖、果糖、蔗糖、淀粉、糊精和甘油)、碳源浓度(1.0、5.0、10.0、20.0和30.0 g/L)、初始pH(6.0、6.5、7.0、7.5和8.0)、温度(25、30、33和37℃)对产酶的影响。
1.2.8 摇瓶发酵培养基正交试验设计 选取4个因素分别为氮源(工业蛋白胨:棉籽粉=3:1),碳源(葡萄糖),初始pH和温度,各取3个水平,进行L9(34)正交实验,研究重组菌最优产酶条件。
2 结果
2.1 重组菌的构建与摇瓶发酵
以pET-24a(+)-treY为模板,扩增treY基因片段,以质粒pHY300PLK为模板,扩增表达载体片段;PCR 产物用1.0%琼脂糖凝胶电泳检测,扩增片段大小分别约为2 200 bp和5 900 bp,与理论值一致。用In-Fusion连接酶将目的基因与表达载体连接后转入E.coli JM109,涂布LB固体平板后挑选单菌落,在LB液体培养基中培养后提取质粒,酶切验证正确后送测序公司测序,测序正确后转入表达宿主B. subtilis中,涂布LB固体平板后挑选单菌落至LB液体培养基中培养,提取质粒酶切验证正确,可确定转入表达载体。
重组菌按照1.2.4进行摇瓶发酵,发酵结束后用高压匀浆破碎菌体,上清液进行 SDS-PAGE 分析,结果(图1)显示,在MTSase理论分子量附近出现明显的可溶性蛋白条带。酶活测定结果显示,重组菌MTSase酶活力为17.5 U/mL。

图1 重组MTSase蛋白电泳分析
2.2 摇瓶发酵优化
2.2.1 氮源种类对重组菌生长和MTSase产量的影响 以TB培养基为起始培养基,固定氮源浓度为36.0 g/L,分别以工业酵母粉、工业蛋白胨、鱼粉蛋白胨、大豆蛋白胨、牛肉浸膏、酪蛋白、棉籽粉、多聚蛋白胨、胰蛋白胨、牛肉粉替代TB培养基中的氮源,其他条件不变,在33℃条件下进行发酵产酶。如图2所示,采用棉籽粉作为氮源时菌体浓度最高,OD600达到20左右,酶活达到最高的17.8 U/mL;采用工业蛋白胨作为氮源酶活为12.1 U/mL,但OD600较低,只有8.0左右,因此使用工业蛋白胨获得的单位菌体的酶活较高。可以看出棉籽粉能够促进菌体生长,而工业蛋白胨则有利于目的蛋白的表达,故采用工业蛋白胨和棉籽粉为氮源复配进行下一步的研究。
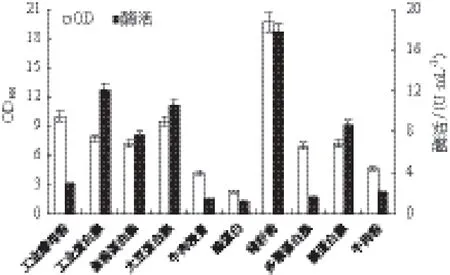
图2 不同氮源对菌体浓度和产酶的影响
2.2.2 氮源配比对重组菌生长和MTSase产量的影响 总氮源浓度为36.0 g/L,将工业蛋白胨和棉籽粉以不同的配比配置摇瓶发酵培养基(工业蛋白胨∶棉籽粉=1∶1,1∶2,1∶3,1∶4,4∶1,3∶1,2∶1)。图3显示,当工业蛋白胨:棉籽粉=3∶1时产酶能力最强,酶活达到23.6 U/mL,是只以棉籽粉为氮源时的1.3倍。因此,以工业蛋白胨:棉籽粉=3∶1为氮源比例做进一步优化氮源浓度的研究。
2.2.3 氮源浓度对重组菌生长和MTSase产量的影响 将工业蛋白胨:棉籽粉=3∶1为氮源比例,研究总氮源浓度(12.0、24.0、36.0、48.0和60.0 g/L)对MTSase产量的影响(图4)。随着总氮源浓度的增加,菌体浓度也在提高,但从36.0 g/L开始虽然菌体浓度增加但是MTSase酶活并没有随着增加,而是固定在24.2 U/mL左右。因此选择氮源浓度36.0 g/L,蛋白胨∶棉籽粉=3∶1为氮源比例进行下一步的研究。
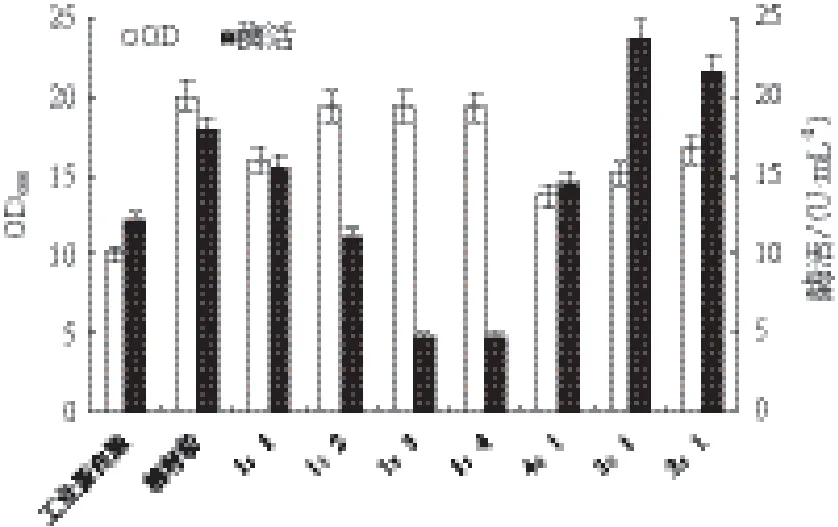
图3 氮源配比对重组菌生长和MTSase产量的影响
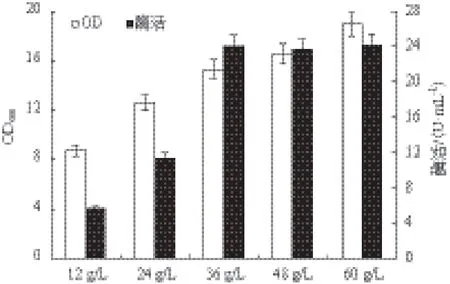
图4 氮源浓度对重组菌生长和MTSase产量的影响
2.2.4 碳源种类对重组菌生长和MTSase产量的影响 选择上述优化好的36.0 g/L的蛋白胨∶棉籽粉=3∶1的复合氮源作为唯一氮源,分别使用10.0 g/L的葡萄糖、果糖、蔗糖、糊精和甘油作为唯一碳源,其他条件不变,在33℃条件下进行发酵产酶。结果(图5)显示以葡萄糖为碳源时MTSase酶活最高达到31.9 U/mL,以甘油为唯一碳源时的菌体浓度与以葡萄糖为唯一碳源时的菌体浓度并无较大差距,但酶活相差较大。查阅资料显示这种分别以葡萄糖和甘油为唯一碳源,菌体浓度相差不大的情况普遍出现,包括大肠杆菌[23,24],因此推测葡萄糖与甘油均是适合枯草芽孢杆菌生长的碳源种类,故菌体浓度相差不大,并且葡萄糖的价格低于甘油价格,因此二者并没有复配优化的价值,因此选取葡萄糖为碳源种类继续优化其浓度。
2.2.5 葡萄糖浓度对重组菌生长和MTSase产量的影响 以优化好的复合氮源为唯一氮源,研究葡萄糖浓度(1.0、5.0、10.0、20.0和30.0 g/L)对MTSase产量的影响。如图6所示,葡萄糖浓度为5.0 g/L时与10.0 g/L时的菌体浓度和MTSase酶活相差较小,考虑到实际应用中的经济因素,选取5.0 g/L的葡萄糖浓度为最终浓度。同时当葡萄糖浓度超过20 g/L时菌体浓度下降较快,应该是过高的糖浓度使渗透压较大,因此抑制了重组菌的生长。
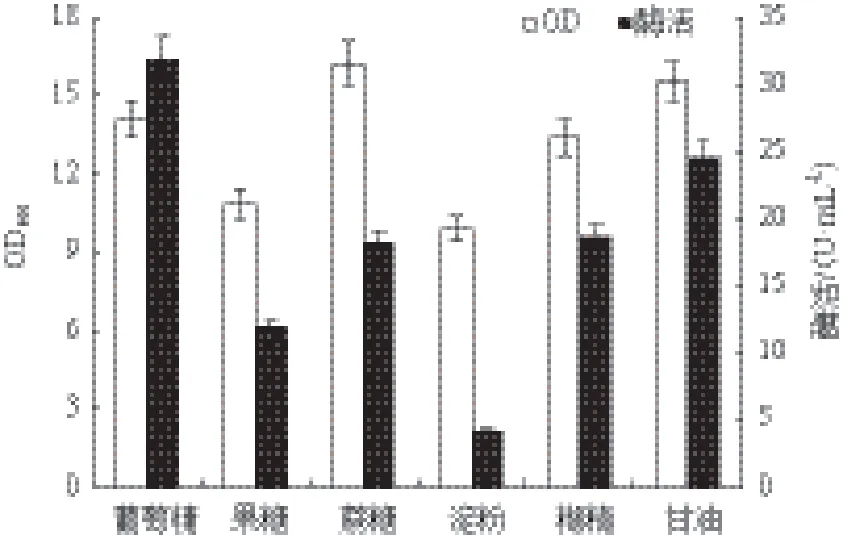
图5 碳源种类对重组菌生长和MTSase产量的影响
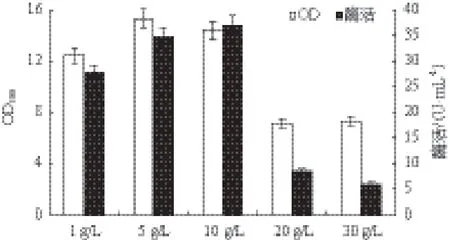
图6 葡萄糖浓度对重组菌生长和MTSase产量的影响
2.2.6 初始pH对重组菌生长和MTSase产量的影响 在确定了最优氮源、碳源后,为进一步确定初始pH对重组菌生长和MTSase产量的影响,使用2 mol/L的盐酸与氢氧化钠调节摇瓶培养基的初始pH并在33℃条件下进行发酵产酶。如图7所示,在初始pH为7.0时菌体浓度和MTSase酶活最高,确定最适初始pH为7.0。
2.2.7 诱导温度对重组菌生长和MTSase产量的影响 培养温度对微生物的代谢过程有一定影响,适宜的温度范围对微生物的产酶有促进作用,以上述优化好的氮源、碳源和初始pH为摇瓶培养基配方,研究温度(25、30、33和37℃)对微生物的生长和产酶的影响。图8显示。在温度范围25-33℃时菌体浓度随温度增加而上升,酶活也随之增加,最高酶活为33℃所得33.9 U/mL,因此选择33℃为最适发酵温度。
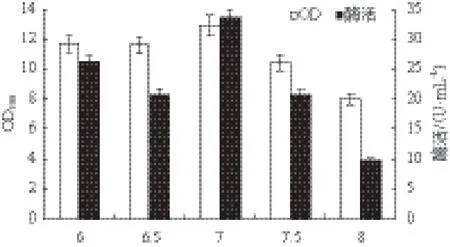
图7 初始pH对重组菌生长和MTSase产量的影响

图8 诱导温度对重组菌生长和MTSase产量的影响
2.3 正交实验
根据上述实验结果,选取对B.brevis产MTSase影响较大的4个因素:氮源(工业蛋白胨∶棉籽粉=3∶1),葡萄糖,初始pH和温度,各取3个水平,进行L9(34)正交实验,实验设计如表1,得出的实验结果如表2。

表1 正交试验因素水平设计
由表2中正交实验结果中极差R值得出:4个因素对枯草芽孢杆菌产MTSase的影响大小依次是B(葡萄糖浓度)>C(初始pH)>A(氮源浓度)>D(温度),根据正交实验得到的最优组合为A3B3C2D1。即氮源总浓度为48.0 g/L,葡萄糖浓度为10.0 g/L,初始pH为7.0,温度为30℃,在此条件下酶活可达41.5 U/mL。
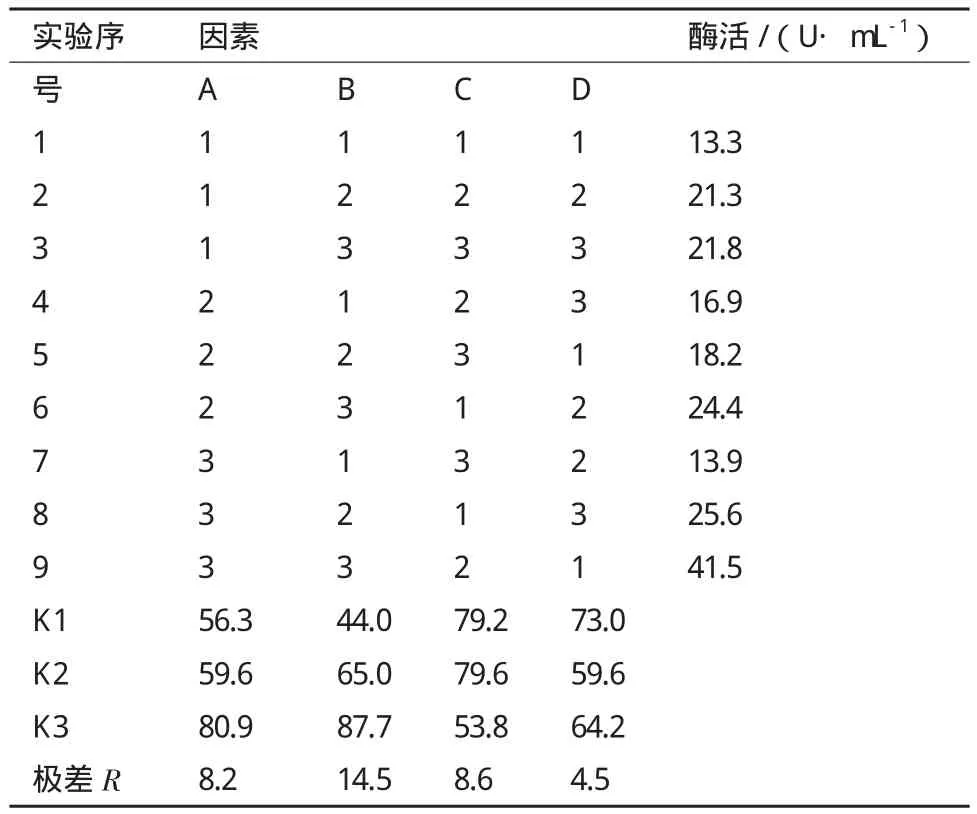
表2 正交实验结果与分析
3 讨论
海藻糖在各个领域的广泛应用使其需求量与日俱增,目前工业生产中主要采用酶法制取海藻糖,其中双酶法以淀粉为底物的生产方式在工业应用方面极具价值。根据双酶法中MTSase在不同菌种中的来源,可将其划分为中温酶和高温酶两种类型,中温来源的MTSase大多具有表达量高,酶转化温度较低的特点;高温来源的MTSase则具有较高的酶转化温度,大多数转化温度在60℃左右,但其表达量普遍不高,较高的酶转化温度有利于加快反应的进行且能有效地避免酶转化过程中的菌体感染,因此从工业应用的角度,高温酶更加有利。
E. coli表达系统具有蛋白表达量高和菌株生长较快等优点,但使用此系统表达的外源蛋白常常形成无活性的包涵体,特别是胞内表达的蛋白,从已报道的文献来看,不同来源MTSase在大肠杆菌系统的异源表达中,包涵体普遍存在。例如,陆阳[25]从玫瑰微球菌(Micrococcus roesus QS412)中克隆MTSase基因并在大肠杆菌E.coli DH5α与E.coli BL(DE3)中表达,但在大肠杆菌中的表达产物均以包涵体的形式存在;de Pascale等[12]将来源于Sulfolobus solfataricus MT4的MTSase和MTHase编码基因在大肠杆菌中进行融合表达并发现包涵体;本实验室前期将高温来源的S. acidocaldarius ATCC 33909 MTSase基因treY在大肠杆菌E. coli BL21(DE3)中进行表达,摇瓶酶活为24.2 U/mL,但表达的同时伴有大量包涵体的形成[26]。相对E.coli表达系统,枯草芽孢杆菌大多是非致病微生物,具有较强的分泌蛋白能力,但其对于表达胞内蛋白仍有较大的发展潜力,从本研究的结果来看,在枯草芽孢杆菌中的表达仍有MTSase包涵体存在,但相比于之前在大肠杆菌中表达的包涵体,枯草芽孢杆菌中的包涵体水平已经显著下降。
本研究从实际应用的角度出发,选取高温来源的S. acidocaldarius ATCC 33909 MTSase基因treY在枯草芽孢杆菌中进行表达,通过优化重组菌的发酵条件确定最适合MTSase表达的培养基和培养温度,最终获得能够高表达耐高温MTSase的菌株,为双酶法的工业应用奠定基础。虽然优化了枯草芽孢杆菌重组菌的摇瓶发酵条件,但没有对重组菌在发酵罐中的上罐条件进行优化,这是以后进一步提高MTSase表达量可以进行的工作。
4 结论
本研究首次将Sulfolobus acidocaldarius ATCC 33909来源的麦芽寡糖基海藻糖合成酶在枯草芽孢杆菌中进行了克隆表达,重组菌在TB培养基中发酵48 h,MTSase酶活力为17.5 U/mL;在此基础上对重组菌产MTSase的发酵条件进行优化,确定其摇瓶发酵产酶的最适培养基为:氮源(工业蛋白胨:棉籽粉=3∶1)为48.0 g/L、葡萄糖为10.0 g/L、初始pH为7.0,培养温度为30℃。在最优条件下发酵培养,MTSase的酶活可达41.5 U/mL,在工业生产上具有较高的应用价值。
[1]Elbein AD, Pan Y, Pastuszak I, et al. New insights on trehalose:a multifunctional molecule[J]. Glycobiology, 2003, 13(4):17R-27R.
[2]Richards A, Krakowka S, Dexter L, et al. Trehalose:a review of properties, history of use and human tolerance, and results of multiple safety studies[J]. Food and Chemical Toxicology, 2002, 40(7):871-898.
[3] Mandels G, Vitols R, Parrish FW. Trehalose as an endogenous reserve in spores of the fungus Myrothecium verrucaria[J]. Journal of Bacteriology, 1965, 90(6):1589-1598.
[4] Retzinger G, Meredith S, Takayama K, et al. The role of surface in the biological activities of trehalose 6, 6’-dimycolate. Surface properties and development of a model system[J]. Journal of Biological Chemistry, 1981, 256(15):8208-8216.
[5]阚洪玲, 孙洪涛, 董建军. 海藻糖在化妆品中的应用[J]. 食品与药品, 2005, 7(9):48-50.
[6] Inoue H, Shimoda C. Changes in trehalose content and trehalase activity during spore germination in fission yeast, Schizosaccharomyces pombe[J]. Archives of Microbiology, 1981, 129(1):19-22.
[7]Schiraldi C, Di Lernia I, De Rosa M. Trehalose production:exploiting novel approaches[J]. TRENDS in Biotechnology, 2002, 20(10):420-425.
[8]Kato M, Takehara K, Kettoku M, et al. Subsite structure and catalytic mechanism of a new glycosyltrehalose-producing enzyme isolated from the hyperthermophilic archaeum, Sulfolobus solfataricus KM1[J]. Biosci Biotechnol Biochem, 2000, 64(2):319-326.
[9] Lama L, Nicolaus B, Trincone A, et al. Starch conversion with immobilized thermophilic archaebacterium Sulfolobus solfataricus[J]. Biotechnology Letters, 1990, 12(6):431-432.
[10] Mukai K, Tabuchi A, Nakada T, et al. Production of trehalose from starch by thermostable enzymes from Sulfolobus acidocaldarius[J]. Starch-Starke, 1997, 49(1):26-30.
[11]Nakada T, Maruta K, Tsusaki K, et al. Purification and properties of a novel enzyme, maltooligosyl trehalose synthase, from Arthrobacter sp. Q36[J]. Biosci Biotech Bioch, 1995, 59(12):2210-2214.
[12]de Pasale D, Di Lernia I, Sasso MP, et al. A novel thermophilic fusion enzyme for trehalose production[J]. Extremophiles, 2002, 6(6):463-468.
[13]Fang TY, Hung XG, Shih TY, et al. Characterization of the trehalosyl dextrin-forming enzyme from the thermophilic archaeon Sulfolobus solfataricus ATCC 35092[J]. Extremophiles, 2004, 8(4):335-343.
[14] Kato M, Miura Y, Kettoku M, et al. Purification and characterization of new trehalose-producing enzymes isolated from the hyperthermophilic archae, Sulfolobus solfataricus KM1[J]. Biosci Biotech Bioch, 1996, 60(3):546-550.
[15] Yamamoto T, Maruta K, Watanabe H, et al. Trehalose-producing operon treYZ from Arthrobacter ramosus S34*[J]. Bioscience, Biotechnology, and Biochemistry, 2001, 65(6):1419-1423.
[16]Kato M. Trehalose production with a new enzymatic system from Sulfolobus solfataricus KM11[J]. Journal of Molecular Catalysis B Enzymatic, 1999, 6(3):223-233.
[17]吴襟, 于炜婷, 王辉, 等. 耐热古菌芝田硫化叶菌海藻糖生成相关酶的基因克隆、表达和序列分析[J]. 生物化学与生物物理进展, 2003, 30(5):798-802.
[18]张文德, 乔宇, 丁宏标. 谷氨酸棒杆菌麦芽寡糖基海藻糖合成酶基因的克隆与表达[J]. 中国农业科技导报, 2009, 11(1):68-72.
[19]王晓阁. 枯草芽孢杆菌研究进展与展望[J]. 中山大学研究生学刊:自然科学与医学版, 2012,(3):14-23.
[20]Kang Z, Duan X, Jing W. Multigene disruption in undomesticated Bacillus subtilis ATCC 6051a using the CRISPR/Cas9 system[J]. Scientific Reports, 2016, 2016(6):27943-27943.
[21] Miller GL. Use of dinitrosalicylic acid reagent for determination of reducing sugar[J]. Anal Chem, 1959, 31(3):426.
[22] Nakada T, Ikegami S, Chaen H, et al. Purification and characterization of thermostable maltooligosyl trehalose trehalohydrolase from the thermoacidophilic archaebacterium[J]. Biosci Biotechnol Biochem, 1996, 60(2):263-266.
[23]胡爽, 蔡海波, 蒋加庆, 等. 碳源对重组大肠杆菌发酵生产GLP-1融合蛋白的影响[J]. 工业微生物, 2010, 40(4):57-62.
[24]杨海麟, 王长城, 张玲, 等. 产胆固醇氧化酶重组大肠杆菌的发酵培养基和诱导条件的优化[J]. 食品与生物技术学报, 2009, 28(5):670-674.
[25]陆阳. 玫瑰微球菌海藻糖合成相关酶基因的克隆以及基因工程菌的构建表达[D]. 北京:北京化工大学, 2005.
[26]吴世雄. 嗜酸热硫化叶菌MTSase和MTHase的异源表达及应用[D]. 无锡:江南大学, 2016.
(责任编辑 李楠)
Recombinant Expression and Fermentation Optimization of Sulfolobus acidocaldarius ATCC 33909 Maltooligosyltrehalose Synthase in Bacillus subtilis
HAN Chang SU Ling-qia WU Jing
(State Key Laboratory of Food Science and Technology,Jiangnan University,School of Biotechnology and Key Laboratory of Industrial Biotechnology Ministry of Education,Jiangnan University,Wuxi 214122)
To obtain the recombinant expression of gene treY for maltooligosyltrehalose synthase(MTSase)from Sulfolobus acidocaldarius ATCC 33909 in Bacillus subtilis,the target gene was PCR-amplified using plasmid pET-24a(+)-treY as template,and ligated with the expression vector pHY300PLK,then transformed into the expression host Bacillus subtilis CCTCC M 2016536. The activity of MTSasereached 17.5 U/mL after cultivated in TB culture for 48 h. By single factor test(nitrogen source,nitrogen proportion,nitrogen concentration,carbon source,glucose concentration,initial pH,and induction temperature)and orthogonal test(nitrogen concentration,glucose concentration,initial pH,and induction temperature),the optimal fermentation condition was determined as:48.0 g/L of nitrogen source(industrial peptone∶cottonseed powder=3∶1),10.0 g/L of glucose,initial pH of medium=7.0,and the optimal temperature was 30℃. Under optimal conditions,the production of MTSase reached 41.5 U/mL,which was 2.4 times of that before optimization.
maltooligosyltrehalose synthase;Bacillus subtilis;recombinant expression;fermentation optimization
10.13560/J.cnki.biotech.bull.1985.2017-0086
2017-02-14
国家自然科学基金杰出青年基金项目(31425020),江苏高校优秀科技创新团队项目(吴敬)
韩唱,女,硕士,研究方向:工业微生物与酶技术;E-mail:lilyhanc@qq.com
吴敬,女,博士生导师,研究方向:食品与发酵;E-mail:jingwu@jiangnan.edu.cn
