一种根癌农杆菌介导的耐盐椒样薄荷含芽茎段转化系统
2017-07-12赵忠娟魏艳丽李纪顺王贻莲杨合同
赵忠娟 魏艳丽 李纪顺 王贻莲 杨合同
(山东省科学院生态研究所,济南 250014)
一种根癌农杆菌介导的耐盐椒样薄荷含芽茎段转化系统
赵忠娟 魏艳丽 李纪顺 王贻莲 杨合同
(山东省科学院生态研究所,济南 250014)
椒样薄荷的转基因技术是提高精油产量和品质的重要手段,为解决耐盐椒样薄荷叶片不定芽诱导过程中易褐化,难分化,不适合作为转基因外植体的问题,利用含芽的椒样薄荷茎段作为外植体建立了一种根癌农杆菌介导的外源基因转化体系。利用正交试验对转化所用的根癌农杆菌菌液浓度、转化时间和共培养时间进行优化,结果显示:3个因素对转化效果的影响作用表现为转化时间(B)>菌液浓度(A)>共培养时间(C),筛选出的最优转化条件为菌液浓度为OD600=0.8,转化时间为15 min,共培养时间为3 d。对不同转化液组分进行优化筛选,结果获得最适的转化液组分为:1/5MS+ 0.5 g/L MES(2-(N-吗啡啉)乙磺酸)+1%葡萄糖+2%蔗糖,PH5.4。利用不同植物表达载体进行转化,并通过基因组PCR和GUS染色进行转化植株的阳性检测,结果表明该转化体系适用于多种植物表达载体的转化,容易获得再生植株,为耐盐椒样薄荷的基因转化提供新的方法与体系。
椒样薄荷;茎段;根癌农杆菌;植物表达载体;基因组PCR;GUS染色
椒样薄荷(Mentha piperita L.)是唇形科薄荷属多年生草本植物,别名欧洲薄荷、胡椒薄荷、黑薄荷,系水薄荷(Mentha aquatica)和绿薄荷(Mentha spicata)杂交而成的六倍体不育系,至今已有250年[1]。椒样薄荷的主要产品薄荷精油含薄荷酮、薄荷醇、乙酸薄荷酯等118 种有效成分,香气纯正,清爽宜人,具有清凉特性和镇痛作用,被广泛应用于食品、医药和日用化妆品行业[2-4]。“科院1号”是本研究室筛选出,可在黄河三角洲地区大规模推广种植的耐盐椒样薄荷,该椒样薄荷对NaCl胁迫具有较强的耐受性,并具有较好的脱盐效果[5-7]。
农杆菌(Agrobacterium)是一类生活在植物根的表面,依靠根组织渗透出来的营养物质生存的,普遍存在于土壤中的革兰氏阴性细菌。农杆菌具有天然感染植物细胞的能力,可以诱发植物冠瘿瘤。农杆菌中存在一种巨大质粒,称为Ti质粒。Ti质粒可作为外源基因的载体,介导外源基因的转化[8,9]。目前农杆菌介导的遗传转化已经广泛应用于双子叶植物和单子叶植物中,应用的农杆菌主要为根癌农杆菌(Agrobacterium tumefaciens)和发根农杆菌(Agrobacterium rhizogenes)2种。
根癌农杆菌介导的转化方法主要有整体植株接种共感染法[10]和叶盘转化法[11]。叶盘转化法是由Horsch等发展起来的一种转化方法,其操作过程中利用打孔器从消毒叶片上取得叶圆片,亦称之叶盘[11]。后来这一共培养系统被广泛用于幼胚[12]、叶片[13]、茎切段[14]、子叶切段[13,15]、下胚轴切段[15,16]、萌动胚[17]、愈伤组织[18]、悬浮培养细胞[19]等离体材料的转化。目前,根癌农杆菌介导的椒样薄荷转化多采用叶盘法,外植体主要为叶片[20-22]。本研究室前期研究发现,以叶片作为外植体建立耐盐椒样薄荷再生体系比较困难,叶片容易褐化且分化效率较低。相比而言,含有腋芽的茎段分化和获得再生植株较容易,可以用来作为根癌农杆菌介导转化的外植体。本研究利用含芽的椒样薄荷茎段作为外植体,对转化所需的根癌农杆菌菌液的浓度、转化时间、共培养时间和转化液组分等条件进行优化筛选,建立一种利用耐盐椒样薄荷茎段作为外植体的根癌农杆菌介导外源基因转化体系,且该转化体系适用于多种植物表达载体的转化。
1 材料与方法
1.1 材料
1.1.1 实验材料 本实验所用椒样薄荷为本研究室前期筛选的耐盐椒样薄荷“科院1号”的无菌苗,所用根癌农杆菌菌株为GV3101,所用转化载体为植物表达载体pCAMBIA1304和pB2GW7。
1.1.2 培养基与转化液 本实验所用的培养基见表1。所用转化液主要成分为MS基础培养基、MES、葡萄糖和蔗糖,各成分含量如表2所示。
1.2 方法
1.2.1 椒样薄荷茎段预培养 将耐盐椒样薄荷无菌苗去掉茎部叶片,用无菌剪刀剪成长度大约为1-2 cm的含腋芽的茎段,用无菌刀片在腋芽处轻轻划几刀,暴露损伤部位,然后将茎段放入预培养的培养基中,用铝箔纸包裹避光,(25±3)℃黑暗条件下预培养3 d。
1.2.2 根癌农杆菌介导的外源基因转化 将-80℃保存的含有植物表达载体pCAMBIA1304和pB2GW7的根癌农杆菌GV3101按1∶100接种到含有50 mg/L利福平和50 mg/L卡那霉素(pCAMBIA1304)或100 mg/L 壮观霉素(pB2GW7)的10 mL YEP液体培养基中,30℃,200 r/min过夜震荡培养,将活化的菌液再按照1∶50重新接种到含有50 mg/L利福平和50 mg/L卡那霉素或100 mg/L 壮观霉素的50 mL YEP液体培养基中,30℃,200 r/min震荡培养16-18 h。将活化的菌液置于灭菌的50 mL离心管中,5 000 r/min离心5 min,收集菌体,用转化液重悬菌体,5 000 r/min离心5 min,洗涤菌体,然后再次用转化液重悬菌体,调整OD600为0.6-1.0,加入30 mg/L AS(乙酰丁香酮),备用。将预培养3 d的耐盐椒样薄荷茎段置于重悬的根癌农杆菌菌液中,抽真空8-15 min,黑暗条件下,30℃,200 r/min震荡培养30 min。

表1 实验所用培养基配方
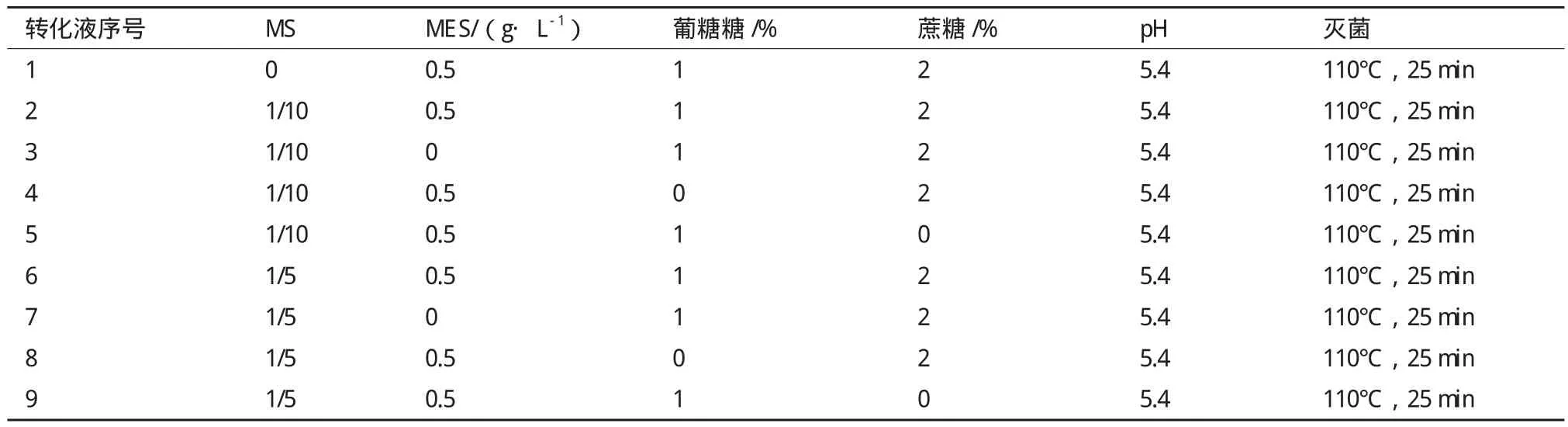
表2 转化液组成成分与含量
1.2.3 转化材料共培养并诱导再生植株产生 将抽真空转化的耐盐椒样薄荷茎段从根癌农杆菌菌液中取出,用无菌滤纸吸去表面残留的菌液,置于共培养培养基上,(25±3)℃ 暗培养3-7 d。然后将耐盐椒样薄荷茎段用含有100 mg/mL头孢霉素的无菌水清洗3-4次,用无菌滤纸吸干多余水,转至不定芽诱导培养基上,(25±3)℃,16 h光照/8 h黑暗条件下对椒样薄荷茎段进行抗生素筛选和不定芽的诱导。抗生素筛选后未发黄颜色仍为绿色的不定芽转移至生根诱导培养基上诱导生根,产生再生植株。统计不定芽在抗生素筛选培养基中的存活率。
存活率(%)=存活的不定芽数目/茎段诱导产生不定芽数目×100% 1.2.4 转化条件优化 本研究利用L9(34)正交试验对菌液浓度(OD600=0.6、0.8、1.0)、抽真空时间(8、10、15 min)和共培养时间(3、5、7 d)进行优化,筛选出最合适的菌液浓度、抽真空时间和共培养时间的组合(表3)。在筛选出最适组合的基础上,利用不同转化液重悬菌体,筛选最适的转化液组分。每种转化液转化椒样薄荷茎段30个,抗生素筛选后计算不定芽存活率,选择最适的转化液,实验重复3次。
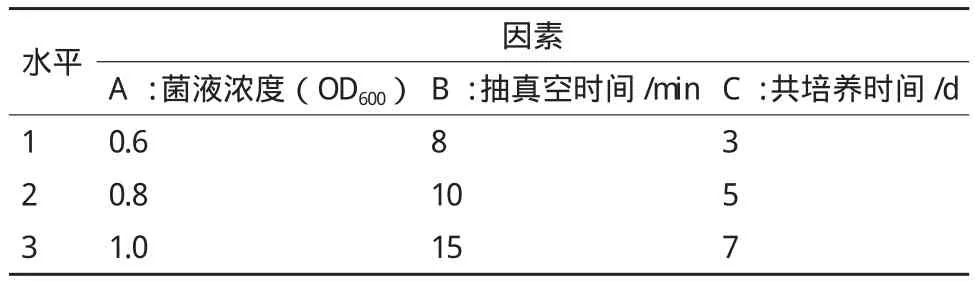
表3 L9(34)正交试验因素水平表
1.2.5 基因组PCR验证植株阳性 两种表达载体pCAMBIA1304和pB2GW7利用转化液2和转化液6进行转化,经抗生素筛选获得的阳性植株,生长至7-8个叶时,从植株上剪取2-3片叶片,用CTAB法提取耐盐椒样薄荷基因组DNA。以基因组DNA为模板,利用35S引物(35S-F:TGTAGAGAGAGACTGGTGATTTCAG,35S-R:TATTGGCTAGAGCAGCTTGCCA)进行PCR验证。并利用载体质粒作为阳性对照,未转化的耐盐椒样薄荷基因组DNA作为阴性对照。
1.2.6 阳性植株GUS染色检测 植物表达载体pCAMBIA1304含有GUS报告基因,可以利用GUS染色技术检测含植物表达载体pCAMBIA1304的根癌农杆菌转化椒样薄荷后的阳性植株。GUS染色方法为:(1)取材,固定:剪取转基因耐盐椒样薄荷植株的茎段,加-20℃保存的90%丙酮,没过材料即可,冰浴20 min。(2)漂洗:用漂洗液(0.1 mol/L磷酸钠缓冲液,2.5 mmol/L K3Fe(CN)6,2.5 mmol/L K4Fe(CN)6)漂洗3次。(3)染色:加入X-Gluc染色液(100 mg X-Gluc用9.58 mLDMSO溶解,溶解液200 μL加入5 mL漂洗液即为染色液),抽真空5min,37℃染色2 h以上。(4)观察:用70%酒精清洗染色后茎段,用体视显微镜观察GUS染色结果并拍照。
2 结果
2.1 农杆菌介导的椒样薄荷茎段转化
根癌农杆菌介导的椒样薄荷转化如图1所示,椒样薄荷含芽茎段较易生成不定芽,且生成的不定芽生长迅速,容易生根获得阳性植株。转化周期大约3个月,转化效率最高可以达到8.14%。

图1 椒样薄荷茎段转化系统
2.2 农杆菌转化条件优化
利用L(934)正交试验对转化条件进行优化筛选,结果(表4)表明,正交优选转化条件为A2B3C1,即使用OD600=0.8的根癌农杆菌菌液,抽真空转化15 min,共培养3 d时转化效果最好,不定芽存活率为21.9%。同时由正交试验结果的R值分析发现,菌液浓度(A)、转化时间(B)和共培养时间(C)3个因素对转化效果的影响作用表现为(B)>(A)>(C)。
2.3 转化液组分的优化
所用转化液的主要组分为MS培养基、MES、蔗糖和葡萄糖,对各组分的配比进行优化,共使用9种不同配方的转化液对椒样薄荷茎段进行转化,结果(表5)显示:4种组分都含有的转化液2和6转化后抗生素筛选的存活率分别为16.6±1.86%和19.9±2.20%,转化效果明显优于缺少任何一种组分的转化液。转化液2和6的差别在于MS基本培养基的浓度,二者相比转化液6的转化效果优于转化液2的转化效果,说明所用的9种转化液中,最适的转化液组分为1/5MS+ 0.5 g/L MES+1%葡萄糖+2%蔗糖,pH 5.4。
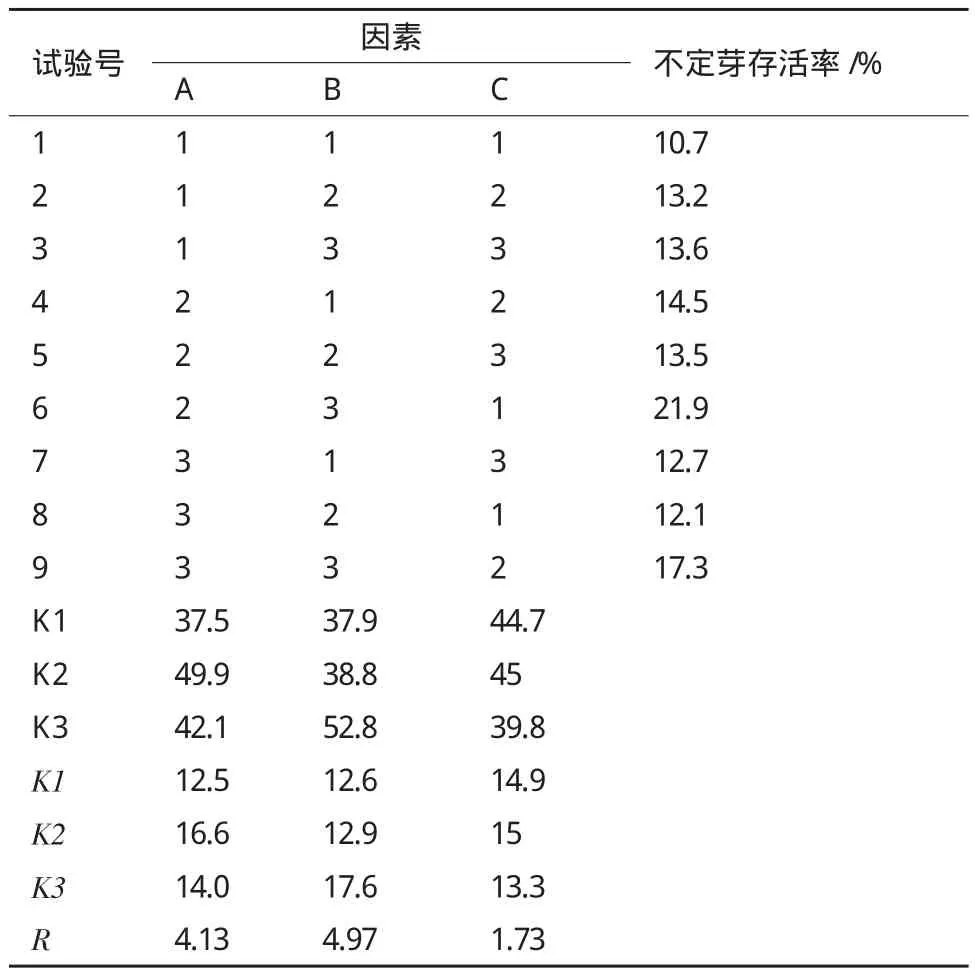
表4 L9(34)正交试验结果
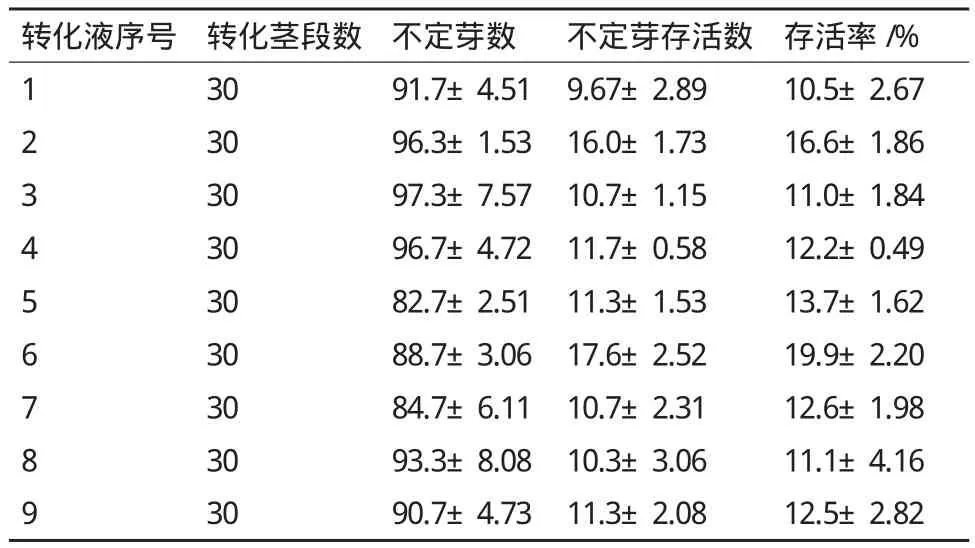
表5 不同转化液对转化效果的影响
2.4 转基因植株的阳性检测
两种表达载体pCAMBIA1304和pB2GW7,利用不同转化液进行转化,植株利用基因组PCR进行检测分析,结果如图2,阳性植株和阳性对照(质粒)PCR扩增得到一条约900 bp的条带,说明外源载体已经转入椒样薄荷基因组中,扩增结果未获得条带的株系为抗生素筛选时出现的假阳性。
pCAMBIA1304载体转化的椒样薄荷茎段,用转化液2转化的茎段分化不定芽数为198,用抗生素筛选获得植株数目为16,利用基因组PCR检测阳性植株为7株,转化率为3.54%;用转化液6转化的茎段分化不定芽数目为236,用抗生素筛选获得植株24株,PCR检测阳性植株为16株,转化率为6.78%(图2-A、2-B,表6)。
pB2GW7载体转化的椒样薄荷茎段,用转化液PCR验证获得的阳性转基因幼苗进行GUS染色鉴定,结果(图3)显示,PCR验证获得的阳性植株GUS染色为蓝色,能够检测到GUS表达,进一步验证了基因组PCR检测的正确性。
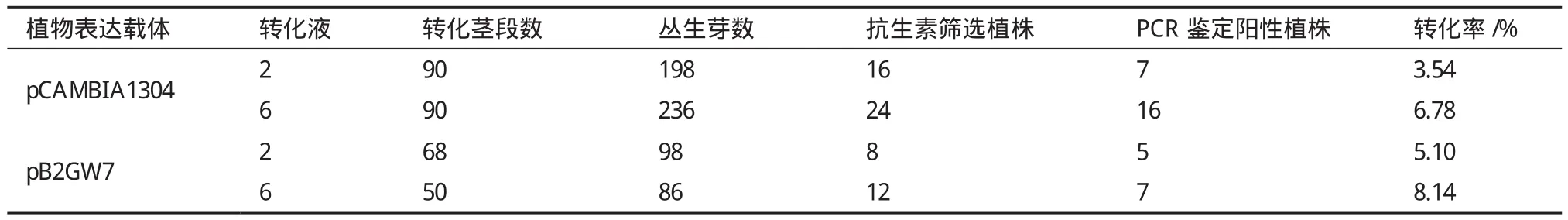
表6 不同植物表达载体转化后PCR鉴定获得的转化率
3 讨论
椒样薄荷作为重要的油料作物,薄荷精油为其最主要产品。利用基因工程和代谢工程提高薄荷精油的含量与品质一直是研究的热点。有研究人员通过将薄荷醇合成途径中基因进行超表达来提高精油含量的方法进行了评价和分析[23],该研究中利用椒样薄荷叶片作为外植体进行薄荷醇合成途径中各基因的转化,将整个叶片浸泡在根癌农杆菌菌液中,渗透转化后切除叶片基部包含叶柄的部分在不定芽诱导培养基上诱导产生愈伤组织和不定芽[20,22]。本实验室筛选获得的耐盐椒样薄荷,因为叶片含有大量的多糖,在体外不定芽诱导过程中很容易褐化,再生频率低,利用叶片作为外植体进行外源基因转化难以实现。因为腋芽分生组织细胞全能性较强,易诱导不定芽的产生,本研究选用含芽的茎段作为外植体,通过根癌农杆菌介导的外源基因转化,建2转化茎段数为68,获得的不定芽数为98,用抗生素筛选获得植株数目为8,利用基因组PCR检测阳性植株为5株,转化率为5.10%;用转化液6转化的茎段数为50,分化不定芽数目为86,用抗生素筛选获得植株12株,PCR检测阳性植株为7株,转化率为8.14%(图2-C、2-D,表6)。
两种载体转化获得的转化率存在一定差异,pB2GW7载体转化率略高于pCAMBIA1304载体,但两者相差不大,都有较高的转化率。两种转化液介导的转化效果也存在差异,转化液6的转化率高于转化液2,与上述转化液组分优化结果相符(表6)。
pCAMBIA1304载体中含有GUS报告基因,对立了一种新的椒样薄荷转化体系。该转化体系的转化效率最高可达到8.14%,明显高于利用叶片作为外植体的转化效率(1.0%)[20]。
根癌农杆菌介导的外源基因转化体系中,影响转化效率的因素有很多,其中菌液浓度、转化时间和共培养时间是大量外源基因转化的研究中关注的重要因素[18,24]。本研究也对这几个因素进行了优化,同时通过正交试验对3个因素对转化效果的影响大小进行了分析,结果表明:3个因素对转化效果的影响作用表现为转化时间(B)>菌液浓度(A)>共培养时间(C)。
转化液也是影响转化效率的重要因素,但目前对转化液组分的研究较少,仅有少量添加的AS浓度对转化效率影响的研究,研究表明,AS作为信号分析可以诱导根癌农杆菌的vir基因活化及高效表达,从而促进外源基因整合到植物基因组中[24]。本研究对含有不同组分的转化液的转化效率进行比较分析,结果表明外源基因转化耐盐椒样薄荷的体系中,MS、MES、蔗糖和葡萄糖4种组分俱全的转化液能够获得最高的转化效率。其中MS为外植体提供营养,是转化液中重要的组分,其浓度也能影响椒样薄荷茎段的转化效率。MES作为一种生物缓冲剂,能调节氢离子浓度的变化,维持转化液的pH[25],转化液中缺失MES会降低转化效率,说明转化液的PH对转化效率有重要影响。转化液中的蔗糖和葡萄糖通过不同比例的搭配为转化提供合适的渗透环境。
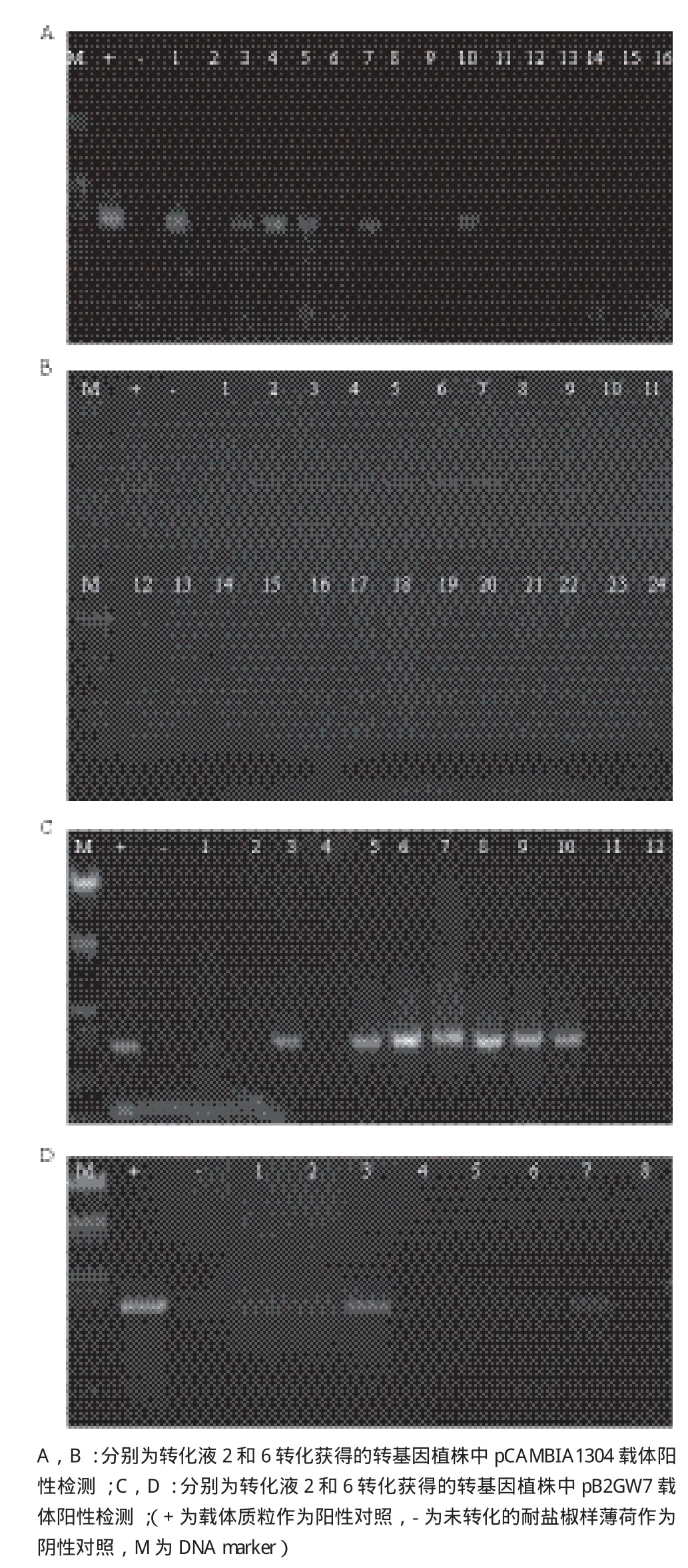
图2 利用基因组PCR对pCAMBIA1304和pB2GW7载体转基因植株进行阳性检测

图3 利用GUS染色对含pCAMBIA1304载体的转基因植株阳性进行检测
4 结论
利用椒样薄荷茎段作为外植体,通过对菌液浓度、转化时间、共培养时间和转化液组分的优化,建立了一种根癌农杆菌介导的耐盐椒样薄荷茎段转化体系。该转化体系最优转化条件为:菌液浓度为OD600=0.8,抽真空时间为15 min,共培养时间为3 d;最适的转化液为:1/5MS+ 0.5 g/L MES+1%葡萄糖+2%蔗糖,pH 5.4。该体系适用于多种植物表达载体的转化,容易获得再生植株,可以运用于椒样薄荷基因转化,为利用基因工程提高椒样薄荷精油含量与品质提供一种新的转化方法。
[1]Murray MJ, Lincoln DE, Marble PM. Oil composition of Mentha aquatica×M. spicata F1 hybrids in relation to the origin of M.× piperita[J]. Canadian Journal of Genetics and Cytology, 1972, 14:13-29.
[2]Brody AL, Mukhin AG, La Charite J, et al. Up-regulation of nicotinic acetylcholine receptors in menthol cigarette smokers[J]. Int J Neuropsychopharmacol, 2012, 21:1-10.
[3]Pan R, Tian Y, Gao R, et al. Central mechanisms of menthol-induced analgesia[J]. J Pharmacol Exp Ther, 2012, 343:661-672.
[4]Patel R, Gonçalves L, Leveridge M, et al. Anti-hyperalgesic effectsof a novel TRPM8 agonist in neuropathic rats:A comparison with topical menthol[J]. Pain, 2014, 155(10):2097-2107.
[5]Li Z, Yang HT, Wu XQ, et al. Some aspects of salinity responses in peppermint(Mentha piperita L.)to NaCl treatment[J]. Protoplasma, 2015, 252(3):885-899.
[6]李哲, 吴晓青, 魏艳丽, 等. NaCl 胁迫对椒样薄荷生长剂抗氧化系统的影响[J]. 广东农业科学, 2014, 41(3):46-51.
[7]李哲, 吴晓青, 赵晓燕, 等. NaCl 胁迫对椒样薄荷光合作用和PSII光化学活性的影响[J]. 山东科学, 2014, 27(1):27-33.
[8]Barton KA, Binns AN, Matzke AJM, et al. Regeneration of intact tobacco plants containing full length copies of genetically engineered T-DNA, and transmission of T-DNA to R1 progeny[J]. Cell, 1983, 32(4):1033-1043.
[9]柴志坚, 张芳, 黄园园, 等. 根瘤农杆菌基因工程[J]. 分子植物育种, 2016, 14(1):92-97.
[10] 许红梅, 张立军, 刘淳. 农杆菌蘸花法侵染拟南芥的研究[J].北方园艺, 2010, 14:143-146.
[11]Horsch RB, Fry JE, Hoffmann NL, et al. A simple and general method for transferring genes into plants[J]. Science, 1985, 227:1229-1231.
[12] Girijashankar V, Swathisree V. Genetic transformation of Sorghum bicolor[J]. Physiology and Molecular Biology of Plants, 2009, 15(4):287-302.
[13]Yasmeen A. An improved protocol for the regeneration and transformation of tomato(cv Rio Grande)[J]. Acta Physiologiae Plantarum, 2009, 31:1271-1277.
[14]陆玉建, 张韩杰, 韩文瑜, 等. 农杆菌介导rd29A启动子驱动otsB基因转化紫茉莉的研究[J]. 植物研究, 2016, 3:401-408.
[15]Ajenifujah-Solebo SOA, Ingelbrecht I, Isu NR, et al. Reproducible Agrobacterium-mediated transformation of nigerian cultivars of tomato(Solanum lycopersicum L.)[J]. American Journal of Experimental Agriculture, 2014, 4(7):797-808.
[16] Sujatha M, Sailaja M. Stable genetic transformation of castor(Ricinus communis L.)via Agrobacterium tumefaciens-mediated gene transfer using embryo axes from mature seeds[J]. Plant Cell Reports, 2005, 23(12):803-810.
[17]Sailaja M, Tarakeswari M, Sujatha M. Stable genetic transformation of castor(Ricinus communis L.)via particle gun-mediated gene transfer using embryo axes from mature seeds[J]. Plant Cell Reports, 2008, 27(9):1509-1519.
[18]徐丹丹, 王丕武, 赵邯郸, 等. 农杆菌介导phyA 基因转化玉米愈伤组织培养体系的优化[J]. 湖北农业科学, 2015, 54(2):465-467.
[19]方星, 胡倩倩, 王建国, 等. 大豆悬浮细胞培养及作为外源基因转化受体的研究[J]. 大豆科学, 2015, 34(1):36-41.
[20]Niu X, Hasegawa PM, Bressan RA, et al. Transgenic peppermint(Mentha×piperita L.)plants obtained by cocultivation with Agrobacterium tumefaciens[J]. Plant Cell Reports, 1998, 17(3):165-171.
[21]Diemer F, Jullien F, Faure O, et al. High efficiency transformation of peppermint(Mentha×piperita L.)with Agrobacterium tumefaciens[J]. Plant Science, 1998, 136(1):101-108.
[22]Niu X, Li X, Veronese P, et al. Factors affecting Agrobacterium tumefaciens -mediated transformation of peppermint[J]. Plant Cell Reports, 2000, 19(3):304-310.
[23]Lange BM, Mahmoud SS, Wildung MR, et al. Improving peppermint essential oil yield and composition by metabolic engineering[J]. Proc Natl Acad Sci USA, 2011, 108(41):16944-16949.
[24]陈磊, 郭政宏, 程海丽, 等. 农杆菌介导的花魔芋遗传转化体系的优化[J]. 安徽农业科学, 2015, 43(5):21-24.
[25] Bugbee BG, Salisbury FB. An evaluation of MES(2(N-Morpholino)ethanesulfonic acid)and Amberlite IRC-50 as pH buffers for nutrient solution studies[J]. Journal of Plant Nutrition, 1985, 8(7):567-583 .
(责任编辑 朱琳峰)
An Efficient Transformation of Salinity-resistant Peppermint Stem Mediated with Agrobacterium tumefaciens
ZHAO Zhong-juan WEI Yan-li LI Ji-shun WANG Yi-lian YANG He-tong
(Ecology Institute of Shandong Academy of Sciences,Jinan 250014)
Transgenic technology is an important means to improve the essential yield and quality of peppermint(Mentha piperita L.)oil. An Agrobacterium tumefaciens-mediated transformation using bud peppermint stem was established,in order to solve the problems in adventitious bud induction of salinity-resistant peppermint leave,such as easy browning and difficult differentiation. The orthogonal test was carried out to screen the optimal concentration of A. tumefaciens,transformation time and co-culture time. The results showed that the effect of the three factors on transformation displayed as the transformation time(B)> bacterial concentration(A)> co-culture time(C). The bacterial concentration OD600= 0.8,the transformation time 15 min and the co-culture time 3 d proved to be the optimal transformation conditions. The optimal composition of transformants was screened to be 1/5MS + 0.5 g/L MES(2-(N-morpholino)ethanesulfonic acid)+ 1% glucose + 2% sucrose and PH 5.4. The transformation was conducted using different plant expression vectors,and the positive plants were detected by genomic PCR and GUS staining. And the results revealed that this transformation system was suitable for the transformation of many plant expression vectors,and the regenerated plants were easily obtained. This provides a new method and system for gene transformation of salinity-resistant peppermint.
peppermint;stem;Agrobacterium tumefaciens;plant expression vector;genomic PCR;GUS staining
10.13560/j.cnki.biotech.bull.1985.2016-1199
2017-01-07
山东省科技重大专项(重大关键技术)项目(2015ZDJS03002),山东省重点研发项目(2015GNC111015),杨合同黄河三角洲学者项目,山东省农业良种工程项目
赵忠娟,女,博士,研究方向:耐盐植物选育;E-mial:zzjfrances@aliyun.com
杨合同,男,博士,研究员,研究方向:耐盐植物与应用微生物;E-mial:yanght@sdas.org
