2016年某医院住院患者抗菌药物使用情况分析
2017-07-12饶志威龚亚红梅同荷夏松柏
饶志威,龚亚红,梅同荷,夏松柏
(咸宁市中心医院/湖北科技学院附属第一医院 药学部,湖北 咸宁 437100)
2016年某医院住院患者抗菌药物使用情况分析
饶志威,龚亚红,梅同荷,夏松柏
(咸宁市中心医院/湖北科技学院附属第一医院 药学部,湖北 咸宁 437100)
目的 分析某医院2016年住院患者抗菌药物使用情况,为进一步规范抗菌药物的使用提供参考。方法 运用回顾性分析方法,结合随机抽取的480份出院病历,对住院患者抗菌药物使用频度(DDDs)、使用强度(AUD)、使用金额等相关数据进行系统分析。结果 该院2016年住院患者抗菌药物AUD为49.9 DDDs/(100人·d)。头孢类、喹诺酮类、硝基咪唑类的使用依次排在前三位;其中,头孢呋辛钠AUD所占比例最高。结论 该医院2016年住院患者抗菌药物使用情况基本合理,但选药级别过高,用药时间长,少数品种使用过于集中,联合用药不合理的问题仍然存在,需要加强管理。
抗菌药物;用药频度;使用强度;合理用药
抗菌药物是目前国内医院使用最为普遍,用量最多的药物,其使用的合理性是衡量医疗机构医疗质量的一个重要标准。从2011年4月《卫生部办公厅关于做好全国抗菌药物临床应用专项整治活动的通知》发布以来,建立分级管理制度,抗菌药物干预力度得到很大加强。但抗菌药物使用强度过高的问题依然存在。为全面了解抗菌药物应用情况,笔者对2016年某医院住院患者抗菌药物使用强度情况进行回顾性分析,旨在为抗菌药物管理及合理使用提供参考。
1 资料与方法
1.1 一般资料 通过该院HIS系统收集2016年抗菌药物使用情况,包括药品销售金额、使用数量、使用强度等,并随机抽取该院480份出院病历。
1.2 评价标准与统计学方法 用药评价标准依据2016年颁布的《抗菌药物临床应用指导原则》。采用世界卫生组织WTO推行的限定日剂量DDD分析方法,参考2015版《中华人民共和国药典》、第17版《新编药物学》和药品说明书中的成人剂量计算用药频度(DDDs),DDDs=该药物年消耗量/其DDD值,比值越大说明该药物的使用频率越高。抗菌药物使用强度(AUD)=累计DDD数/(同期收治患者住院天数×100)。
2 结 果
2.1 抗菌药物使用品种及使用量 文中的医院是一所三级甲等综合性医院,可供临床使用的抗菌药物品种有48个,品规75个,涉及14大类抗菌药物。其中非限制使用级品种24个,限制级品种13个,特限制级品种11个,符合卫生部规定。
排名前10的品种总销售额为2229万元,占全年药品销售总金额的12%,销量排名第一的是头孢噻肟钠舒巴坦钠,销售额为327万,其次为第二代头孢孟多酯。具体数据见表1。
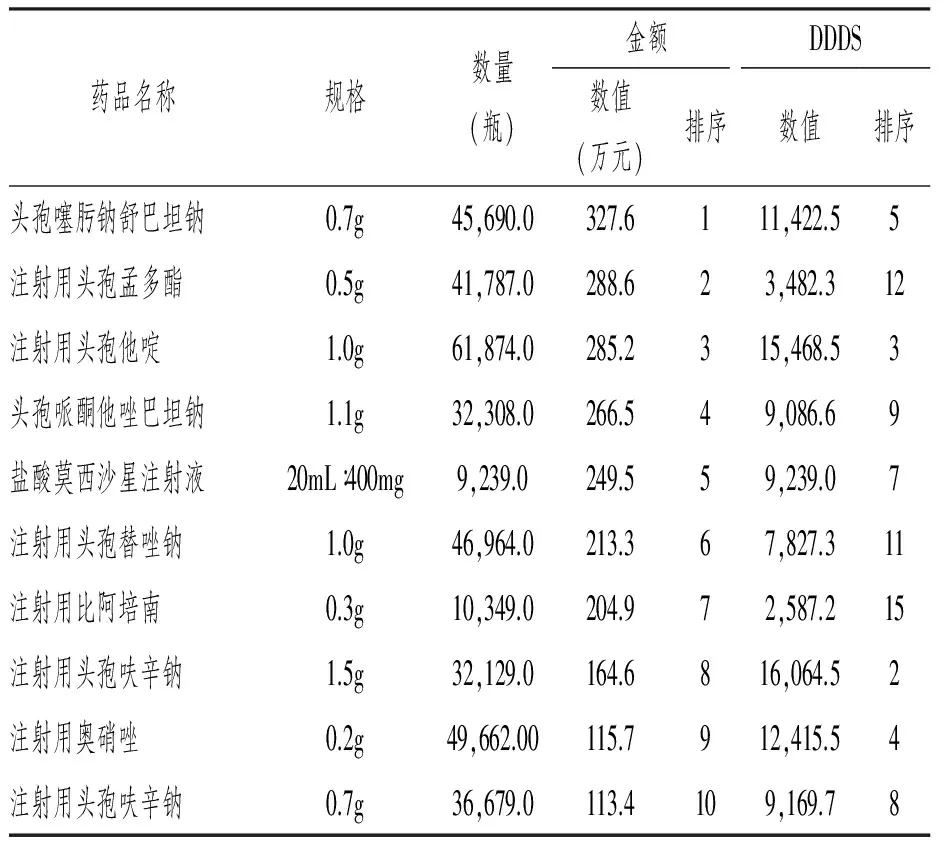
表1 2016年某医院销售金额排序前10位抗菌药物的销售金额和DDDs统计
2.2 抗菌药物使用强度 该院2016年出院患者总人数为35,782人,患者住院总天数为392,833d,平均住院天数为11d。总DDDs为192,836.46,AUD计算出来为49.09DDDs/(100人·d)。其中,头孢类AUD为18.8 DDDs/(100人·d),占本年度全部抗菌药物37.67%;其次是喹诺酮类、硝基咪唑类、头孢菌素复合制剂,AUD构成比分别为15.37%、12.39%和12.32%。AUD排序抗菌药物类别统计表与具体数据见表2。
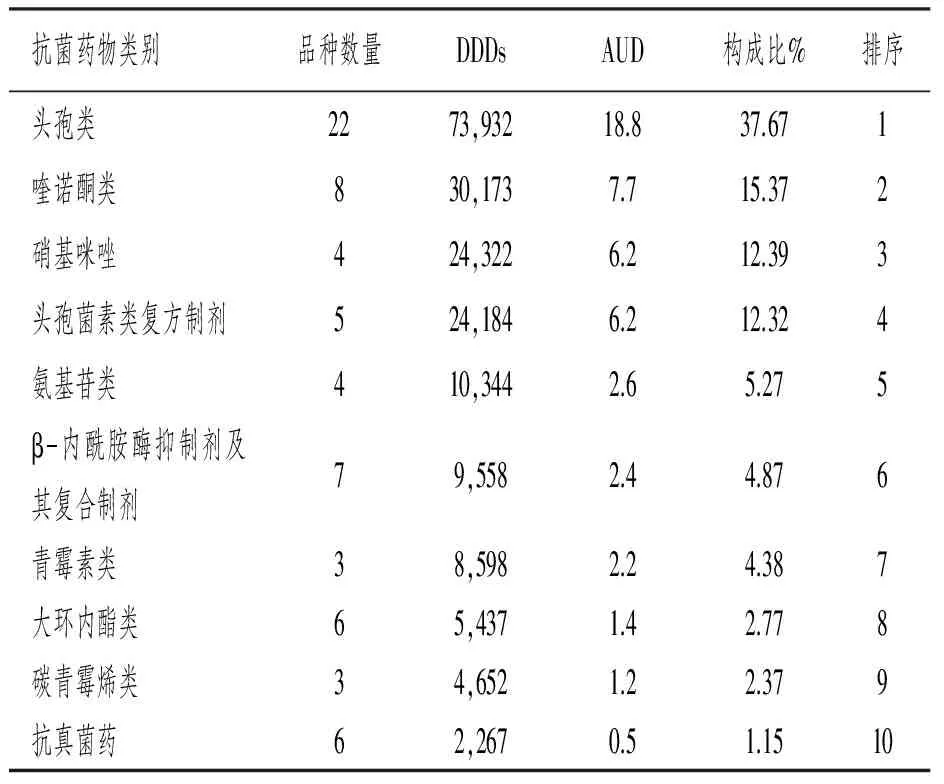
表2 AUD排序前10 位的抗菌药物类别统计
2.3 具体品种抗菌药物使用强度 从表1中可以看出,该院2016年抗菌药物金额排序前10都为针剂,占总DDD数的75.8%。主要包括头孢菌素类、喹诺酮类、硝基咪唑类、头孢菌素复合制剂。其中,头孢呋辛以6.4 DDDs/(100人·d)排名第一,其次为左氧氟沙星,见表3。
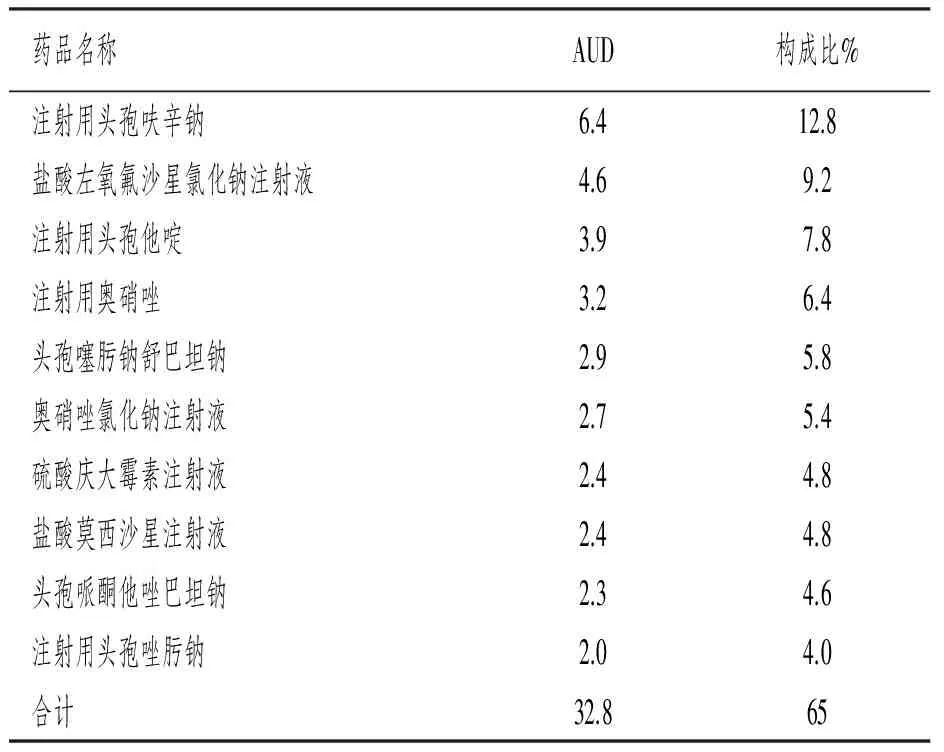
表3 AUD排序前10 位的抗菌药物统计
从全院科室AUD排名看,抗菌药物使用强度较高的主要为重症监护室,外科、呼吸内科等科室排在其后,具体数据见表4。
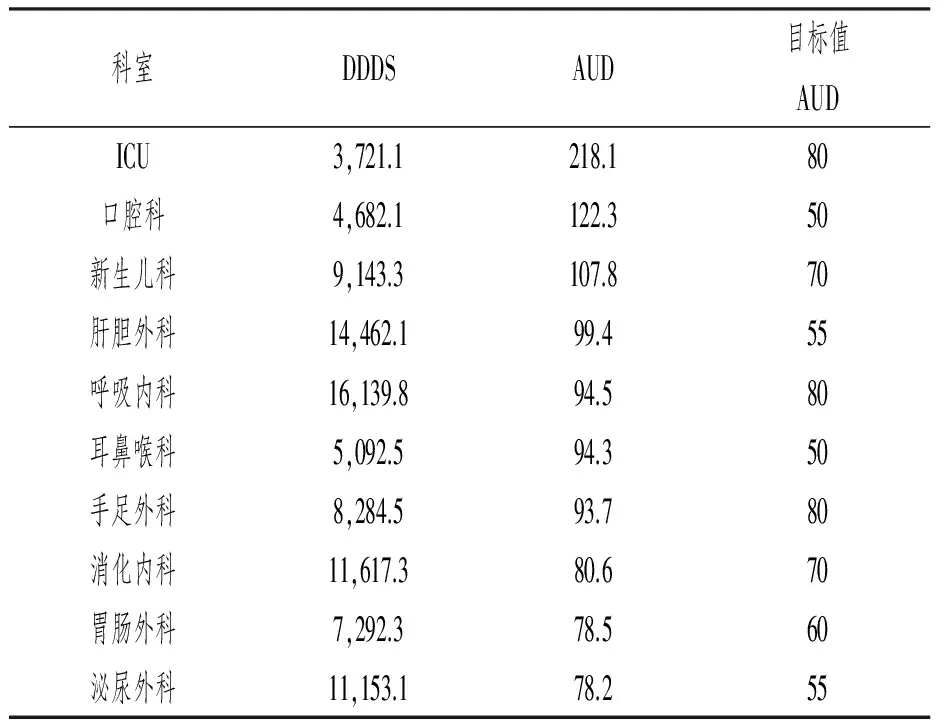
表4 临床科室抗菌药物使用强度前10位
3 讨 论
3.1 抗菌药物AUD分析 从表2和表3可以看出,头孢类在抗菌治疗中起着主导地位,位居抗菌药物类别中AUD的首位,这与其他文献报道一致[1]。头孢呋辛安全性与疗效可靠,常作为手术预防用药中首选。但该院总体抗菌药物使用强度为49.9 DDDs/(100人·d),与全国抗菌药物临床应用专项整治活动方案中所要求的AUD控制在40 DDDs/(100人·d)以下还是有很大差距,近2/3科室AUD超过了规定值,这些数据客观反映抗菌药物的使用还是欠缺合理,需要进一步持续改进。相关研究显示[2],降低住院患者抗菌药物的使用率、人均使用抗菌药物的品种数、平均住院时间与人均使用累积时间等均有助于降低AUD。
3.2 部分品种使用偏集中 从抗菌药物类别和具体品种AUD排序看,喹诺酮的AUD居于第二位,喹诺酮类抗菌药物注射用品有4个,喹诺酮类的AUD为7.7 DDDs/(100人·d),而盐酸左氧氟沙星一个品种的AUD就达到了4.6 DDDs/(100人·d),占喹诺酮类抗菌药物的60%。同为第三代喹诺酮的抗菌药物环丙沙星DDDs仅为237,只占喹诺酮类AUD的1.1%。而在钟旭江[3]与沈黎明等人[4]的莫西沙星、左氧氟沙星、环丙沙星三者在泌尿道感染、下呼吸道感染的治疗成本与效果研究中显示,选用环丙沙星进行治疗更经济、更符合成本与效果药物经济学方案。除此之外,环丙沙星在治疗革兰氏阴性杆菌感染,特别是在绿脓杆菌感染方面,也具有很好的疗效。可见,环丙沙星在抗感染过程中也具有不容忽视的地位。
3.3 选药不合理 被点评的病历中,喹诺酮类药物的选用问题较多,如泌尿外科在尿道感染中常采用左氧氟沙星或莫西沙星治疗,根据最近全国耐药监测网分析报告[5],尿道感染多为大肠埃希菌,该菌对喹诺酮类药物耐药率高,一般不宜首选喹诺酮类作为该类细菌的治疗。除此之外,耳鼻喉科在扁桃体炎与急性细菌性咽炎治疗中也常选用喹诺酮类药物或第二代头孢,该类疾病多为化脓性链球菌或A组溶血性链球菌,这类细菌对青霉素目前保持着高度敏感,除患者对青霉素过敏外,应考虑首选青霉素治疗。
3.4 围手术期用药欠规范 从围手术期用药情况看,术后用药时间偏长,平均达到4d,个别用药时间超过1~2周。用药时间过长,是AUD偏高的一个重要因素。抗菌药物疗程根据感染程度而定,一般结合临床用到患者体温正常、症状消失后3~4d,对于局部感染需用到感染灶控制或消散为止。再如一般手术感染的高危期不会超过24h,在有效血药浓度下,细菌生存是很难超过48h,所以对于一般手术过后超过48h没有发生感染患者,再继续使用抗菌药物是没有必要的。
《2015版抗菌药物临床应用指导原则》[6]明确指出,手术预防用药需在切口切开前0.5h到1h给药较佳,术后预防使用抗菌药物没有任何价值。I类切口预防用药过多,如耳鼻喉科的咽部良性肿瘤、肝胆外科酒精肝硬化、手足外科的后天性指畸形等I类切口手术均预防使用抗菌药物,这也是影响AUD的一个因素。
3.5 联用欠缺合理 从表1、表2、表3中可以看出,硝基咪唑类抗菌药物排名第三,而奥硝唑的AUD达到3.2 DDDs/(100人·d),排名第四,销售金额排名也靠前,这说明医生对抗厌氧菌药物的使用也较为偏好。从抽取的病历分析看,很大一部分医生在治疗复杂性腹腔感染时,选用碳青霉烯类、酶抑制剂类抗菌药物以及头霉素类药物习惯联用奥硝唑,这是没有必要的,因为碳青霉烯类、酶抑制剂以及头霉素对厌氧菌也是非常敏感的,无需再联合硝基咪唑类。2010 年,美国感染病学会(IDSA)和外科感染学会(SISA)更新发布了复杂腹腔内感染(CIAI)诊治指南[7]中也未提及此类联用方案。
总而言之,抗菌药物专项整治以来,抗菌药物的使用取得长足的进步,但其使用强度与卫生部规定指标还存在很大差距,不合理使用抗菌药物的现象依然存在。加强抗菌药物管理,进一步学习《2015版抗菌药物临床应用指导原则》,做好临床合理用药宣教还很有必要。
[1]李静,孙秀英.我院2013年住院患者抗菌药物使用强度分析[J].中国药房,2015,26(5):582
[2]毛静怡,柳丽丽.医院抗菌药物使用强度及其影响指标研究[J].中国药房,2014,25(18):1641
[3]钟旭江.3种喹诺酮类药物治疗泌尿道感染的疗效及成本-效果分析[J].海峡药学,2011,23(9):206
[4]沈黎明,马国才,张峥,等.左氧氟沙星与环丙沙星治疗泌尿系感染的成本-效果分析[J].西部医学,2012,24(9):1790
[5]杨青,陈晓,孔海深,等.Mohnarin 2010年度报告:尿标本细菌耐药监测[J].中华医院感染学杂志,2012,22(3):476
[6]THORNLEY P,EVANIEW N,RIEDIGER M,et al.Postoperative antibiotic prophylaxis in total hip and knee arthroplasty:a systematic review and meta-analysis of randomized controlled trials[J].Cmaj Open,2015,3(3):E338
[7]SOLOMKIN J S,MAZUSKI J E,BRADLEY J S,et al.Diagnosis and management of complicated intra-abdominal infection in adults and children:guidelines by the surgical Infection society and the infectious diseases society of america[J].Clinical Infectious Diseases,2010,50(2):133
R195.1
B
2095-4646(2017)03-0258-03
10.16751/j.cnki.2095-4646.2017.03.0258
2017-01-09)
