解磷菌株M-3-01发酵工艺优化
2017-07-12柯春亮李淑娟段雅婕
柯春亮,李淑娟,段雅婕
(1.广东石油化工学院,广东茂名525000;2.茂名市第十七中学,广东茂名525000;3.中国热带农业科学院南亚热带作物研究所,广东湛江524091)
解磷菌株M-3-01发酵工艺优化
柯春亮1,李淑娟2,段雅婕3
(1.广东石油化工学院,广东茂名525000;2.茂名市第十七中学,广东茂名525000;3.中国热带农业科学院南亚热带作物研究所,广东湛江524091)
采用单因素试验研究碳、氮、磷矿粉3组主要影响因子类别和质量浓度对解磷菌M-3-01(Serratia nematodiphila)菌株解磷效果的影响,再运用正交试验进行L(934)优化,以探究M-3-01的解磷发酵配方工艺.结果表明:菌株M-3-01的高效解磷最终优化发酵配方中,葡萄糖、草酸铵、磷矿粉、无机盐的质量浓度分别为15 g/L、1.5g/L、2.5 g/L、1.92 g/L,接种量为2%,pH为6.0,150 r/min,37℃.解磷菌发酵配方经过优化后,优化组有效磷含量达88.64mg/L,是CK有效磷含量的2.34倍,效果显著,为优化后的解磷菌发酵配方投入到微生物菌肥产业化生产提供了有力的数据支持.
解磷菌株;正交试验;培养基优化
磷素以多种形式参与植物体内的生理生化代谢过程,对植物的生长发育起着重要的作用[1-2].许多研究表明,利用解磷细菌制成的菌肥施入土壤后,不仅能够提高土壤有效磷含量,而且能够加强土壤其他有益微生物的活动,改善植物根部营养,提高作物产量[3-6].微生物产品的质量及成本都与培养的成本密切相关.此外,培养基中碳源、氮源和无机盐等也会影响解磷菌生长或改变其生理代谢途径,从而影响其解磷效果[7-8].为了降低成本,提高产量,有必要进行培养基优化,提高解磷效率.本项目利用实验室筛选获得的溶磷效果较好的细菌菌株M-3-01(Serratia nematodiphila),通过单因素试验及正交试验,调整碳、氮、磷矿粉及培养条件,探究解磷菌株解磷效果最佳时的培养基及培养条件,以期为M-3-01菌株投入高效微生物菌肥的生产提供一定的理论支持.
1 材料与方法
1.1 试验材料
1.1.1 供试菌株从香蕉根际土壤中筛选到对磷矿粉具有良好溶解效果的细菌虫内生沙雷氏菌M-3-01(Serratia nematodiphila),由中国热带农业科学院生物技术研究所提供.
1.1.2 试剂和仪器碳源:葡萄糖,果糖,蔗糖,麦芽糖,乳糖,淀粉,甘油,甘露醇;氮源:硫酸铵,草酸铵,乙酸铵,氯化铵,硝酸铵,硝酸钾,尿素,黄豆粉,酵母粉,蛋白胨;磷矿粉(有效磷含量为2.3 g/kg,全磷含量为237.5 g/kg),产地江苏锦屏.FE20K型pH计(梅特勒-托利多仪器(上海)有限公司),ZEISSAxioScope A1激光共聚焦荧光显微镜(德国卡尔蔡司公司).
1.1.3 主要培养基
无机磷基础培养基:葡萄糖10 g,硫酸铵0.5 g,MgSO4·7H2O 0.3 g,NaCl0.3 g,KCl0.3 g,MnSO4·H2O 0.03 g,FeSO4·7H2O 0.03 g,磷矿粉5 g,蒸馏水定容至1 000mL,pH 7.0~7.2.磷矿粉与其他药品分开灭菌后混和.
细菌基础培养基:胰蛋白胨10 g,酵母粉5 g,NaCl10 g,pH 7.0,蒸馏水1 000mL.
上述两种主要培养基加入琼脂(体积分数为2%)灭菌即配成固态培养基.
1.2 试验方法
1.2.1 菌液的制备挑取菌株M-3-01划线接菌于细菌基础培养基固体平板上37℃培养24 h.再挑取单菌落接菌于液态细菌基础培养基中,37℃、250 r/min摇床培养24 h,用移液枪吸取一定量的菌液于光学显微镜下观察有效活菌数,用无菌水稀释至活菌数为108cfu/mL量级的菌液.
1.2.2 发酵液有效磷含量测定
磷标准曲线的绘制:取数支50mL具塞比色管,分别加入质量浓度为2mg/L的磷标准溶液0、0.5、1.0、3.0、5.0、10.0、15.0mL,加水至50mL,然后向比色管中加入1mL质量分数为10%的抗坏血酸溶液混匀,30 s后加入2mL钼锑抗显色剂,摇匀放置15min,以零浓度溶液为参照,于700 nm波长处测定吸光度.此时各管中磷质量浓度分别为0、0.02、0.04、0.12、0.20、0.40、0.60mg/L.以磷质量浓度为横坐标,以吸光度为纵坐标,绘制磷标准曲线.
发酵液有效磷测定方法:吸取108cfu/mL量级的菌液1mL接于无机磷基础培养基上,37℃、200 r/min摇床培养3 d,取发酵液在12 000 r/min离心机中离心7min,去除菌体.取上清液用0.45μm无菌滤膜过滤,观察菌株的解磷能力.本试验均采用钼锑抗比色法显色测定发酵液吸光值.具体方法为:取2.5mL滤液加入25mL比色管中,用纯净水定容至刻度线,其余步骤同上.分光光度值以不接菌培养基为空白对照,进行有效性磷含量测定,各处理均设3次重复.解磷率计算公式如下:
式中:处理有效磷质量浓度和对照有效磷质量浓度的单位为mg/L,磷矿粉质量浓度的单位为g/L,全磷含量的单位为%.
1.2.3 培养基单因素试验
碳、氮源种类对发酵液有效磷含量的影响:采用基础培养基配方,分别将经乙醚灭菌处理的质量分数为1.0%的碳源加入到已高温灭菌的液态培养基中,同时将菌液分别接入,250mL三角瓶装液100mL,于恒温摇床中37℃、200 r/min振荡培养发酵3 d,对发酵液进行可溶性磷含量测定,方法见1.2.2.确定最佳碳源种类后,与碳源试验一样,只改变氮源种类,分别将代表菌株接入质量分数为0.5%的氮源,加入到液体培养基中培养.均以不接菌作对照.
碳、氮源质量浓度对有效磷含量的影响:在最优碳、氮源种类已知的前提下,分别改变氮源质量浓度(0、0.25、0.5、1.0、1.5、2.0 g/L)、碳源质量浓度(0、5、10、15、20、30 g/L),加入到液体基础培养基中,其余配方根据基础培养基配方不变,超菌台接待测菌株,摇床培养3 d,取上清滤液测有效磷含量.
磷矿粉质量浓度对有效磷含量的影响:确定代表菌株生长的最佳碳、氮源及质量浓度后,进一步探讨磷矿粉质量浓度对有效磷含量的影响.磷矿粉质量浓度设置为2.5、5、10、15、20 g/L.
1.2.4 培养基正交试验将筛选出的最优葡萄糖、草酸铵、磷矿粉、无机盐4个主要因子,分别用A、B、C、D表示,选用L9(34)正交表设计试验,对代表菌株M-3-01进行主要因子的最优组合搭配筛选试验.试验设3次重复,以平均值作为试验结果.
1.2.5 培养条件单因素试验在确定最优培养组合配方基础上,对影响功能菌生长代谢的培养转速、接种量和培养基pH值等培养条件进行逐一优化.转速设置为0、100、150、200、250 r/min;接种量设置为0.5%、1.0%、1.5%、2.0%、4.0%、7.0%、10.0%;初始pH值设置为3.0、4.0、5.0、6.0、7.0、8.0、9.0.
1.2.6 验证实验通过单因素试验、正交试验筛选出最优的碳源、氮源及其质量浓度,磷矿粉质量浓度等主要影响因子,配制发酵培养基.接上M-3-01菌液,在试验最优的培养条件与原培养条件下分别进行培养,进行验证实验.试验设3次重复,以平均值作为实验结果.
2 结果与分析
2.1 碳源种类对解磷菌M-3-01解磷能力的影响
不同碳源培养基的pH值及解磷菌M-3-01的解磷值见表1.

表1 碳源种类对解磷菌M-3-01解磷能力的影响Tab.1 Effectsofcarbons sourceson the phosphate-solubilizingability ofstrain M-3-01
由表1可知,菌株M-3-01在不同碳源培养基上振荡培育3 d后,培养基的pH值及M-3-01的解磷能力表现出明显差异.解磷菌M-3-01在以葡萄糖为碳源时解磷活性最高,解磷量为16.99±0.43mg/L;其次是以果糖为碳源,其解磷量为13.78±0.79mg/L.以葡萄糖为碳源时具有较高的解磷活性,这与赵小蓉的研究一致[9],同时培养基pH值也大幅度降低至4.5以下.虽然培养液pH值在以甘油、甘露醇、麦芽糖和蔗糖为碳源时有所增加,但M-3-01菌株溶解磷矿粉的能力却明显低于葡萄糖,特别是以甘露醇和甘油为碳源时,菌株M-3-01基本不表现出解磷活性.由表1可确定株菌M-3-01溶解磷矿粉的最佳碳源为葡萄糖.
2.2 氮源种类对解磷菌M-3-01解磷能力的影响
不同氮源培养基的pH值及解磷菌M-3-01的解磷值见表2.
由表2可知,菌株M-3-01在不同氮源培养基上振荡培育3 d后,培养基的pH值及M-3-01的解磷能力表现出明显差异.解磷菌M-3-01在以草酸铵为氮源时解磷活性最高,解磷量为46.14±0.20mg/L,分别是尿素、乙酸铵处理的19.72、6.83倍.说明M-3-01菌株能够很好地利用草酸铵,改变菌体自身代谢,提高解磷能力.以(NH4)2SO4为氮源时菌株M-3-01的解磷能力仅次于草酸铵,解磷量为39.48±0.67mg/L,分别是尿素、乙酸铵处理的16.87、5.84倍.解磷菌菌株M-3-01在不同氮源时表现的解磷能力不同可能与自身产生的有机酸类别有关.由表2中不同处理的pH值可以看出,与其他氮源相比,草酸铵作为氮源培养菌体时,在培养滤液的pH值方面差异不显著,但它显著提高了M-3-01的解磷量.而尿素、蛋白胨等作为氮源时,代表菌株M-3-01却不能很好地利用,这可能是与此类氮源不易被菌体吸收从而限制了生长,或代表菌株利用不同氮源会引起代谢途径改变进而影响菌体解磷能力有关,也有可能是某些离子过多时会抑制活性物质代谢.由表2可确定草酸铵为菌株M-3-01溶解磷矿粉的最佳氮源.
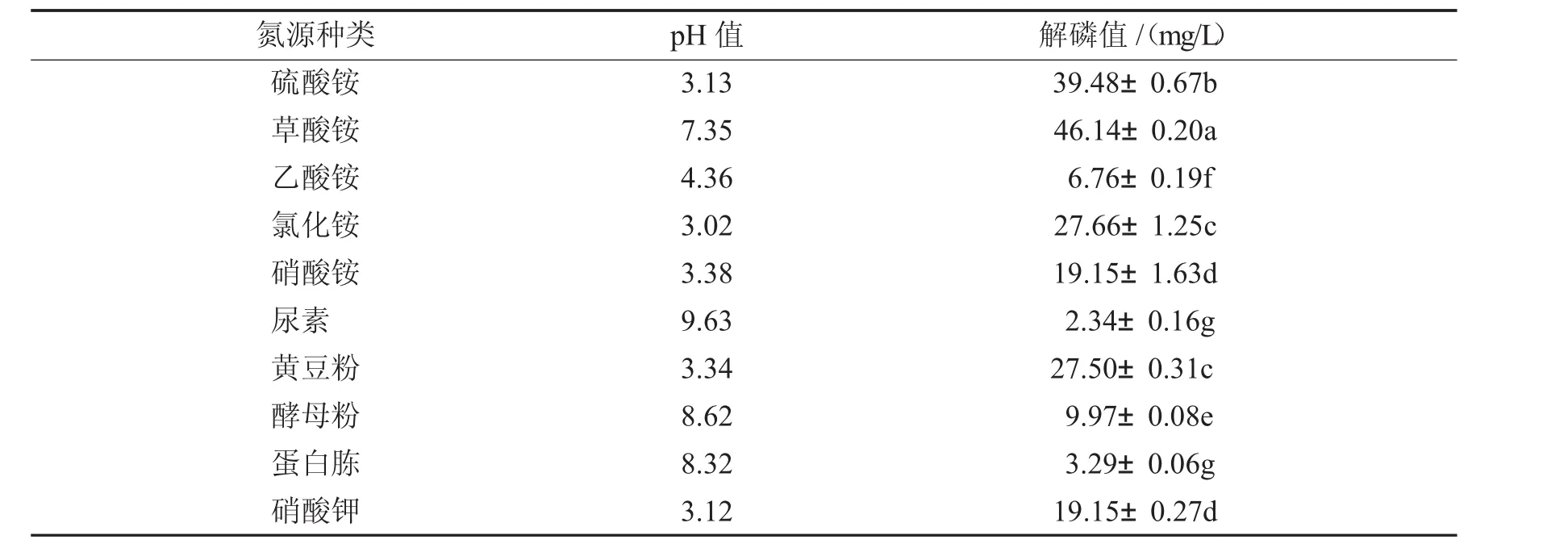
表2 氮源种类对解磷菌M-3-01解磷能力的影响Tab.2 Effectsofnitrogen sourceson the phosphate-solubilizing ability ofstrain M-3-01
2.3 最佳碳、氮源及磷矿粉质量浓度对菌株M-3-01解磷能力的影响
2.3.1 最佳碳源质量浓度对菌株M-3-01解磷能力的影响最佳碳源葡萄糖质量浓度对菌株M-3-01解磷能力的影响见图1.

图1 最佳碳源质量浓度对解磷细菌解磷能力的影响Fig.1 Theeffectofconcentration ofcarbon sourceson phosphate-solubilizing ability ofphosphorus solution bacteriaM-3-01
由图1可知,随着最佳碳源葡萄糖质量浓度的增加,M-3-01菌株的解磷能力呈现先增后减的趋势.当葡萄糖质量浓度为0 g/L时,解磷能力几乎没有,验证了碳源是菌株生长的必需元素[10].碳源质量浓度控制在合适的范围内时,提高其在培养基中质量浓度,有助于菌株的生长.当碳源葡萄糖质量浓度升高到5 g/L后,M-3-01菌株溶解磷矿粉的能力显著增强;继续增加葡萄糖质量浓度至15 g/L时,M-3-01菌株的解磷能力最强,解磷量为30.21mg/L;当碳源葡萄糖质量浓度大于15 g/L后,解磷能力显著降低.因此选择15 g/L为最佳碳源葡萄糖的质量浓度.
2.3.2 最佳氮源质量浓度对菌株M-3-01解磷能力的影响最佳氮源草酸铵质量浓度对菌株M-3-01解磷能力的影响见图2.

图2 最佳氮源质量浓度对磷细菌解磷能力的影响Fig.2 Theeffectofconcentration ofnitrogen sourceson phosphate-solubilizingabilityofphosphorussolution bacteriaM-3-01
由图2可知,随着最优氮源草酸铵质量浓度的增加,M-3-01菌株的解磷能力呈现先增后减的趋势.草酸铵质量浓度为1 g/L时,M-3-01菌株的解磷能力最强,解磷值达到61.02mg/L,显著高于其余各质量浓度.其后,随着草酸铵质量浓度的进一步升高,M-3-01菌株的解磷能力开始下降.因此最佳氮源草酸铵的质量浓度选择1 g/L为最佳.
2.3.3 磷矿粉质量浓度对菌株M-3-01解磷能力的影响磷矿粉质量浓度对菌株M-3-01解磷能力的影响见图3.

图3 磷矿粉质量浓度对M-3-01菌株解磷能力的影响Fig.3 The effectsofconcentration ofphosphate rock on the phosphate-solubilizingability ofphosphorussolution bacteriaM-3-01
由图3可知:磷矿粉质量浓度为2.5 g/L时,发酵上清液中可溶性磷量最高,解磷值达28.19mg/L;磷矿粉质量浓度为5 g/L时,已经超过了最合适的磷矿粉质量浓度,再增加磷矿粉的质量浓度,解磷菌的解磷量就显著减少,甚至完全表现不出任何解磷能力.说明当磷矿粉质量浓度达到一定值时,磷矿粉质量浓度与解磷菌菌株的解磷能力呈负相关关系,与已有研究[10]结论一致.
2.4 培养基主要影响因子正交试验
由上述结果及文献[10]可知,葡萄糖、草酸铵、磷矿粉、无机盐是解磷菌株M-3-01培养过程中最重要的因素.将这4种因素作为处理因子,采用L9(34)正交表进行试验,研究不同质量浓度处理组合对M-3-01菌株解磷能力的影响,选出最佳培养基配方.正交试验设计及结果见表3,正交试验影响因素直观图见图4.

表3 正交试验设计及结果Tab.3 The design and resultsoforthogonal test
由表3中的R值可知菌株解磷能力影响因素主次排序为A>C>B>D,即最佳碳源质量浓度影响最大,接下来依次是磷矿粉质量浓度、最佳氮源草酸铵质量浓度和无机盐质量浓度.综合而言,A2B3C1D2组合最好,即葡萄糖、草酸铵、磷矿粉和无机盐的质量浓度分别为15 g/L、1.5 g/L、2.5 g/L和1.92 g/L,此时M-3-01菌株的解磷能力最好,解磷吸光值达最大值,为3.468.

图4 正交试验影响因素直观图Fig.4 Factors influenced orthogonal test
由因素直观图可知,葡萄糖、草酸铵、磷矿粉和无机盐的质量浓度对M-3-01菌株的解磷能力有较大影响.葡萄糖质量浓度为5 g/L、15 g/L时,M-3-01菌株的解磷能力显著提高;质量浓度大于15 g/L时, M-3-01菌株的解磷能力开始下降.草酸铵质量浓度为1 g/L时,M-3-01菌株的解磷能力最低,质量浓度大于或小于1 g/L时,M-3-01菌株的解磷能力均增强,说明草酸铵质量浓度约为1 g/L时,是M-3-01菌株解磷能力的阀值.在试验设置的3个磷矿粉质量浓度下,随着磷矿粉质量浓度的增加,M-3-01菌株的解磷能力呈递减趋势,说明磷矿粉质量浓度太大会限制解磷菌的解磷能力.在试验设置的3个无机盐质量浓度中,质量浓度为1.92 g/L时M-3-01菌株的解磷能力最高.
2.5 培养条件对M-3-01菌株解磷能力影响试验
2.5.1 起始pH值对M-3-01菌株解磷能力的影响在正交试验确定了最优培养基组合的基础上,通过调节最优组合培养基的初始pH值,研究起始pH值对解磷菌M-3-01的解磷能力的变化情况.不同初始pH值对M-3-01菌株解磷能力的影响见图5.

图5 初始pH值对M-3-01菌株解磷能力的影响Fig.5 Effectsof initialpH ofmedium on the phosphate-solubilizingabilityofstrain M-3-01
由图5可知,不同的初始pH值对M-3-01菌株解磷能力的影响比较明显.在整个培养过程中,初始pH值为3.0~6.0时的解磷效果变化较小,一直处于稳步上升状态,说明M-3-01菌株在强酸的条件下也能旺盛生长;在初始pH值为6.0时,M-3-01菌株表现出较强的解磷活性,解磷量最大,溶解磷量达54.04mg/L;当pH值高于6.0时,M-3-01菌株的解磷能力开始下降.因此,初始pH值在5.0~6.0较为适合.培养基的pH值会影响培养基中某些营养物和中间代谢产物的解离,还会影响酶分子和底物分子的带电状况,从而影响营养物质的吸收与利用、酶的合成和代谢产物的分泌.因此,培养基的pH值太高或太低都不适于菌体的生长和有利于代谢产物的产生.针对这一情况,可以在培养基中加入较高质量浓度的缓冲液,以避免培养过程中摇瓶内培养基pH值产生剧烈变化.从图5可以看出,解磷菌M-3-01菌株的最适初始pH值为6.0. 2.5.2转速对M-3-01菌株解磷能力的影响在最适初始pH值为6.0的条件下,将供试菌株M-3-01分别接种于优化的基础培养基中,于不同转速恒温(37℃)摇床中培养3 d.不同转速对M-3-01菌株解磷能力的影响见图6.

图6 转速对M-3-01菌株解磷能力的影响Fig.6 Effectsofspeed on the phosphate-solubilizingability ofstrain M-3-01
由图6可知,转速会明显影响解磷菌M-3-01菌株对难溶性磷的溶解效果.在培养条件的摇床转速设置为150 r/min时,M-3-01菌株表现出较强的解磷活力,解磷量达59.84 mg/L;在培养转速设置为0 r/min时,M-3-01菌株的解磷能力最差.这充分说明转速条件会直接影响解磷菌M-3-01菌株的生长.解磷菌M-3-01菌株在一定的转速范围值内培养,表现出的解磷活性与转速成正比,当转速超过一定值时,会限制解磷菌代谢产物的产生,反而抑制了M-3-01菌株溶解磷矿粉的能力.
2.5.3 接种量对M-3-01菌株解磷能力影响根据方法1.2.3,在其他条件相同的情况下,接种量分别为0.5%、1.0%、1.5%、2.0%、4.0%、7.0%、10.0%,培养3 d后测定培养基上清滤液可溶性磷,探讨不同接种量对M-3-01菌株解磷能力的影响.结果见图7.

图7 接种量对M-3-01菌株解磷能力的影响Fig.7 Effectsof inoculation quantity on the phosphate-solubilizingability ofstrain M-3-01
由图7可知,接菌量对M-3-01菌株的解磷活性能力影响显著.接种量为0.5%、1.0%、1.5%时,培养3 d后,发酵液上清液可溶性磷量在增长,但可溶性磷量差别不大;接种量为2.0%时,M-3-01菌株解磷活性最强,解磷值为55.68mg/L;当接种量大于2%时,M-3-01菌株解磷能力反而有所下降.一般接入较大量的菌液可以缩短菌体的生长峰值期,明显缩短发酵时间,但过量接菌反而会因菌体过多产生较多的代谢废物,抑制菌株的生长或活性产物代谢.因此考虑到实际需要,解磷菌M-3-01菌株发酵的适合接种量确定为2.0%.
2.5 验证实验
综合参考前面优化培养基单因素试验及正交试验的结果,最终确定以葡萄糖质量浓度为15 g/L,草酸铵质量浓度为1.5 g/L,磷矿粉质量浓度为2.5 g/L,无机盐质量浓度为1.92 g/L,起始pH值为6.0,转速为150 r/min,接种量为2.0%作为M-3-01菌的优化培养基,标记为T.以无机磷基础培养基作为对照(CK),进行验证试验,37℃培养3 d,测其上清液有效磷含量.培养基发酵液及钼锑显色效果见图8,验证实验结果见表4.

图8 培养基发酵液及钼锑显色效果图Fig.8 The pictureofvalidation test
由图8可知,优化培养基比对照培养基的发酵效果明显要好.优化培养基发酵液颜色发白,稠度比对照高;对照培养基发酵液颜色清,磷矿粉可见.发酵液进行可溶性磷含量测定,钼锑显色结果表明,优化培养基发酵液显色后颜色明显较对照培养基发酵液颜色深.

表4 验证实验结果Tab.4 The test resultsofverification
由表4的验证实验结果可知,优化培养基发酵液中有效磷质量浓度达88.64mg/L,是对照培养基发酵液中有效磷质量浓度的2.34倍.通过测量培养基发酵液的活菌数OD600可知,优化培养基发酵液中有效活菌数是对照培养基发酵液的1.41倍.
3 结论与讨论
微生物的正常生长繁殖不仅需要充足的碳、氮源,还需要磷、钾、镁等无机盐,部分微生物还需要特殊的生长因子.解磷菌溶解难溶性磷酸盐的能力主要受菌体自身基因特性的影响.研究表明,对解磷菌枯草芽孢杆菌X1055进行紫外线诱变选育,筛选出的优良解磷突变株,其解磷量达5.22mg/L,解磷能力较原菌株提高17.8%[11].解磷能力还与培养条件有关,虞伟斌[12]、李福后等[13]研究表明,碳源、氮源的种类,培养条件等都是影响解磷菌溶解难溶性磷酸盐能力的因素.本研究通过单因素试验与正交试验,确定了解磷细菌M-3-01溶解磷矿粉能力的最佳发酵培养条件.高效解磷细菌M-3-01的最终发酵培养基优化结果为:葡萄糖质量浓度15 g/L,草酸铵质量浓度1.5 g/L,磷矿粉质量浓度2.5 g/L,无机盐质量浓度1.92 g/L,接菌量2.0%,pH值为6.0,转速为150 r/min,培养温度37℃.
供试菌株M-3-01的解磷能力受到供给氮源种类及质量浓度影响明显,可能与氮素参与合成微生物某些活性代谢物质有关.过高或过低的氮源质量浓度都不利于M-3-01菌株溶解磷矿粉.磷矿粉质量浓度对解磷细菌的解磷能力影响很大,磷矿粉质量浓度越大,M-3-01菌株溶解磷的效果越不明显.有研究表明,不同青霉菌株对培养基中磷矿粉用量的敏感程度不同[14],且与氮源有关.磷矿粉质量浓度超过20 g/L时,溶磷量大幅度降低[15].本研究结果与上述结论基本一致.
覃丽金等[16]对无磷细菌G12-6(Bacillusspp.)进行培养条件优化,当氮源为硝酸钾、碳源为蔗糖时,解磷活性表现最好.本研究得到的最优培养基中碳氮源较覃丽金等研究的结果有所不同,这可能是菌株属性的差异所致.本研究通过最优的配方组合进行培养条件优化,结果表明,M-3-01菌株在不同的培养环境下,解磷活性均有不同程度的变化.M-3-01菌株在不同起始pH值条件下均能较好地生长,说明其对pH的适应性很强,当pH值为6.0时,M-3-01菌株解磷活性最强,表明代表菌株M-3-01表现解磷活性的最适pH值为6.0;菌株在不同转速条件摇床培育时,解磷活性变化不明显;M-3-01菌株解磷活性在接菌量为2.0%时达到峰值.
本研究对M-3-01菌株的培养基组合进行优化并确定了适宜条件,今后将对中试发酵罐发酵条件应用进行研究,以确定M-3-01液体菌肥生产工艺,从而为其用于高效微生物菌肥的生产提供理论参考.
[1]宋建利,石伟勇.磷细菌肥料的研究和应用现状概述[J].化肥工业,2005,32(4):18-20.
[2]张爱华,杨启银,陈育如,等.解磷细菌突变株PS-01P菌株的选育及发酵条件的研究[J].安徽农业大学学报,2004,31(3):309-314.
[3]钟传青,黄为一.提高磷矿粉肥效的生物学途径[J].化肥工业,2002,29(2):15-17.
[4]WHITELAW M A,HARDEN T J,HELYAR K R.Phosphate solubilization in solution culture by the soil fungus Penicillium radicum[J].SoilBiology and Biochemistry,1999,31(5):655-665.
[5]CHABOT R,ANTOUN H,CESCAS M P.Growth promotion of maize and lettuce by phosphate-solubilizing RhizobiumLeguminosarum biovar.phaseoli[J].Plantand Soil,1996,184(2):311-321.
[6]I IIMER P,SCHINNER F.Solubilizaton of inorganic phosphates bymicroorganisms isolated from forest soils[J].Soil Biology& Biochemistry,1992,24(2):389-395.
[7]NAHASE.Phosphate solubilizingmicroorganisms:effectof carbon,nitrogen,phosphorus sources[J].Developments in Plantand soil sciences,2007,102:111-115.
[8]HU X J,LIZ J,CAO C,et al.Isolation and identification ofa phosphate-solubilizing bacterium Pantoea stewartii subsp.stewartii g6,and effects of temperature,salinity,and pH on its growth under indoor culture conditions[J].Aquaculture International,2010, 18(6):1079-1091.
[9]赵小蓉,林启美,李保国.C、N源及C/N比对微生物溶磷的影响[J].植物营养与肥料学报,2002,8(2):197-204.
[10]林启美,赵海英,赵小蓉,等.溶磷微生物对不同磷矿粉的溶解能力[J].中国农业科学,2002,35(10):1232-1235.
[11]孙剑秋,王鹏,张建,等.优良解磷菌株诱变选育与解磷培养基优化[J].核农学报,2010,24(1):41-45.
[12]虞伟斌,杨兴明,沈其荣,等.不同碳氮源对解磷菌K3溶磷效果的影响[J].南京农业大学学报,2011,34(5):81-85.
[13]李福后,王伟霞,潘建梅,等.有机磷分解细菌的选育及其发酵条件的研究[J].中国土壤与肥料,2007,3(6):74-77.
[14]ASEA P E A,KUCEY R M N,STEWART JW B.Inorganic phosphate solubilization by two Penicillium species in solution culture and soil[J].SoilBiolBiochenl,1988,20:459-464.
[15]张永奎,王安,陈茂春,等.细菌分解磷矿粉探索研究[J].矿产综合利用,2000(6):32-34.
[16]覃丽金,杨礼富,袁坤,等.10种热带牧草根际高效解磷细菌的筛选及其培养条件[J].热带作物学报,2009,30(11):1630-1636.
(责任编辑:邓天福)
Optim ization of fermentation process of phosphate-solubilizing bacteria M-3-01(Serratia nematodiphila)
KE Chunliang1,LIShujuan2,DUAN Yajie3
(1.Guangdong University ofPetrochemical Technology,Maoming525000,China;2.Maoming No.17 Middle School,Maoming 525000,China;3.South SubtropicalCrops Research Institute,Chinese Academy of TropicalAgricultural Sciences,Zhanjiang524091,China)
The single factor testwas used to study the effect of three kinds of key impact factors,carbon,nitrogen and ground phosphorite and their concentrations on the phosphorus dissolving efficiency of phosphate-solubilizing bacteria M-3-01,and the formula process of M-3-01 was optimized by orthogonal test in L9(34).The results showed that the final optimization result were:15 g/L of glucose,1.5 g/L of ammonium oxalate,2.5 g/L of phosphate rock powder,1.92 g/L of inorganic salt,2%of inoculation quantity,6.0 of pH,150 r/min and 37℃.After formula optimization,its formula were verified experiment,which optimized the set of effective phosphorus content up to 88.64 mg/L,which was 2.34 times that of CK effective phosphorus content.The consequence provides convincing data support for the formula to be applied in actual production.
phosphate-solubilizing bacteria;orthogonal test;medium optimization
Q5
A
1008-7516(2017)03-0006-10
10.3969/j.issn.1008-7516.2017.03.002
2007-04-20
海南省自然科学基金面上项目(20163110);中央级公益性科研院所基本科研业务费(1630062015010)
柯春亮(1988―),男,广东茂名人,硕士,助教.主要从事生物防控研究.
段雅婕(1983―),女,山西临汾人,硕士,助理研究员.主要从事香蕉病害的生物防治研究.
