犀角地黄汤加减联合血浆置换治疗急重型系统性红斑狼疮的疗效与机制研究
2017-07-12周涛
周 涛
(武汉科技大学附属武汉市普仁医院风湿免疫科,湖北 武汉 430081)
犀角地黄汤加减联合血浆置换治疗急重型系统性红斑狼疮的疗效与机制研究
周 涛
(武汉科技大学附属武汉市普仁医院风湿免疫科,湖北 武汉 430081)
目的探讨犀角地黄汤加减联合血浆置换(PE)治疗急重型系统性红斑狼疮(SLE)的疗效及作用机制。方法纳入我院180例SLE患者,随机数字表法分为A、B、C三组。A组采取环磷酰胺冲击治疗、B组采取PE治疗,C组采取PE联合犀角地黄汤。比较三组治疗前后的症状评分、SLEDAI评分、补体C3、血沉(ESR)、抗ds-DNA 抗体、血清肌酐(Scr)、血清胱抑素(CsyC)、谷草转氨酶(AST)、谷丙转氨酶(ALT)、24 h尿蛋白、人干扰素-r(IFN-r)、白介素-10(IL-10)、BAFF因子,统计 3组治疗总有效率及不良反应发生率。结果B、C组治疗后各观察点的症状评分、SLEDAI评分、ESR、ds-DNA 抗体、24 h尿蛋白、Scr、CsyC、AST、ALT、血清BAFF均低于A组(P<0.05)。C组治疗后各观察点的IFN-r-IL-10+与IFN-r+IL-10+亚群所占百分率低于A、B组(P<0.05)。B、C组治疗后各观察点的C3高于A组(P<0.05)。B组与C组治疗总有效率为分别为90.0%、93.3%,均高于A组的71.7%(P<0.05)。C组不良反应发生率为10.0%,低于A组与B组(P<0.05,P<0.01)。结论PE可去除血浆中有害成分、抑制炎症反应,联合犀角地黄汤可进一步扶助正气、解毒化瘀,改善机体免疫功能,达到增效减毒目的,效果更理想。
系统性红斑狼疮;犀角地黄汤;血浆置换
系统性红斑狼疮为常见自身免疫性疾病,预后差,治疗难度大,且累及多器官及系统,引起临床关注。西医多用糖皮质激素或免疫抑制剂治疗,但不少研究显示[1-2],西药副作用明显,部分患者无法耐受。血浆置换(PE)为血液净化技术,可迅速清除致病抗原及免疫复合物[3],但患者病情易反复或出现严重并发症。中医药可减轻药物副作用,辨证施治且利于提高患者生活质量[4]。本文以我院收治的急重症SLE患者为例,观察犀角地黄汤加减联合PE对急重症SLE的疗效及作用机制,现报道如下。
1 资料与方法
1.1 一般资料
1.1.1 诊断标准 符合美国风湿病学会制定的SLE诊断标准:(1)颧颊部红斑;(2)盘状红斑;(3)口腔溃疡;(4)光敏感;(5)胸膜炎或心包炎;(6)非侵蚀性关节炎;(7)抗 ds-DNA 抗体阳性;(8)抗核抗体异常;(9)溶血性贫血或白细胞减少;(10)排除药物及已知代谢紊乱的前提下存在癫痫发作及精神疾患;(11)蛋白尿(>0.5 g·d)或尿细胞管型。 另外 SLE 活动评分(SLEDAI)>9分,症状分级量化标准评分>24分,属急重症。
1.1.2 纳入标准 (1)符合SLE诊断及病情分级标准;(2)年龄在 18~65 岁;(3)病程在 10 年以内;(4)研究经医院伦理委员批准,患者及其家属对本研究知情同意并签署临床试验知情同意书。
1.1.3 排除标准 (1)合并严重感染者;(2)合并心、脑、肾原发病致药物耐受力差者;(3)药物性狼疮患者;(4)存在凝血功能异常者;(5)合并其他结缔组织病患者;(6)入组前3个月内有免疫抑制剂应用史者;(7)有过敏史者;⑻妊娠或哺乳期女性。
1.1.4 分组资料 纳入我院2011年1月~2016年4月的SLE患者180例,按随机数字表分为A、B、C三组,各60例。A组男33例、女27例;年龄21~62岁,平均(52.2±6.1)岁;病程 1~9 年,平均(4.0±1.8)个月;SLEDAI评分 10~20 分,平均(21.3±1.0)分。 B 组男 35例、女 25例;年龄 20~65岁,平均(52.6±5.8)岁;病程 1~10 年,平均(4.2±1.6)个月;SLEDAI评分9~20分,平均(21.1±1.2)分。 C 组男 31例、女 29 例;年龄 18~64 岁,平均(52.3±5.6)岁;病程 1~9 年,平均(4.0±1.3)个月;SLEDAI评分 10~20 分,平均(21.4±1.4)分。三组一般资料差异的两两比较均无统计学意义(P>0.05)。
1.2 方法
1.2.1 A组 采取环磷酰胺冲击治疗:应用醋酸泼尼松片(国药准字H62020285,生产单位:甘肃扶正药业科技股份有限公司,5 mg*100 片/瓶):每日 40~60 mg,病情稳定后减量。注射用环磷酰胺 (国药准字H14021788,生产单位:山西仟源制药有限公司,规格:0.2 g/支):静脉注射,1.0 g/次,1 次/d。 治疗 3 个月。
1.2.2 B组 采取PE治疗:应用德国费森尤斯4008S血液透析机治疗,间隔2 d 1次,共3次。依据血HCT计算总血浆量,每次置换量为总血浆量的50%。置换液组成包括胶体液(生理盐水及706代血浆)、晶体成分(新鲜血浆)、抗凝剂(ACD-A)。 每次置换后静脉注射400 mg环磷酰胺。治疗期间口服醋酸泼尼松片,方法同A组。治疗3个月。
1.2.3 C组 采取PE联合犀角地黄汤加减。处方:犀角 (可用水牛角代替,饮片先煎)30 g,生地黄25 g,忍冬藤 20 g,芍药 12 g,牡丹皮 9 g。 水煎取汁300 mL,1剂/d,分3次口服。血浆置换治疗同B组。治疗3个月。
1.3 观察指标与判定标准
1.3.1 症状评分与SLEDAI评分 症状评分包括发热、口疮、脱发、皮肤溃烂、面部红斑、双手红斑、关节疼痛、关节肿胀、精神状态(以上均0~3分)、小便短赤、舌苔、脉像(0~2 分),共 33 分。 SLEDAI评分为10天内症状或表现的总评分,最高105分。观察时间为治疗前10 d、治疗后10 d、治疗后3个月及6个月。
1.3.2 实验室指标 比较补体C3、ESR、抗ds-DNA抗体、肝肾功能指标(Scr、CsyC、AST、ALT、24 h 尿蛋白、IFN-r、IL-10及 BAFF因子。补体 C3用 IMMAGE全自动特种蛋白分析仪采取速率散射比浊法测定;ESR用魏氏血沉法检测;抗ds-DNA抗体、IL-10、BAFF用ELISA法检测;Scr用酶法测定;CsyC用乳胶颗粒增强散射免疫比浊法测定;AST、ALT、24 h尿蛋白用日立7170全自动生化分析仪测定;IFN-r用流式细胞仪检测。检测时间与症状评分的观察时间相同。
1.3.3 临床疗效 参照《中药新药临床研究指导原则》[5]中SLE疗效标准:治疗后实验室指标恢复至正常范围,症状积分减少95%以上,为临床治愈;实验室指标趋于正常,症状积分减少70%~95%,为显效;实验室指标有所下降,证候积分减少30%~69%,为有效;未达以上标准,为无效。治疗总有效率=(临床治愈+显效+有效)/n×100%。
1.3.4 不良反应 比较三组不良反应发生率。
1.4 统计学方法
2 结果
2.1 三组治疗前、后症状评分与SLEDAI评分的比较
治疗前三组症状评分与SLEDAI评分的两两比较均P>0.05;经治疗后三组各观察点的症状评分与SLEDAI评分均降低 (P<0.05);B、C组治疗后各观察点的症状评分与SLEDAI评分均低于A组(P<0.05);B、C 组无差异(P>0.05)。 见表1。
表1 三组治疗前、后症状评分与SLEDAI评分的比较(±s)
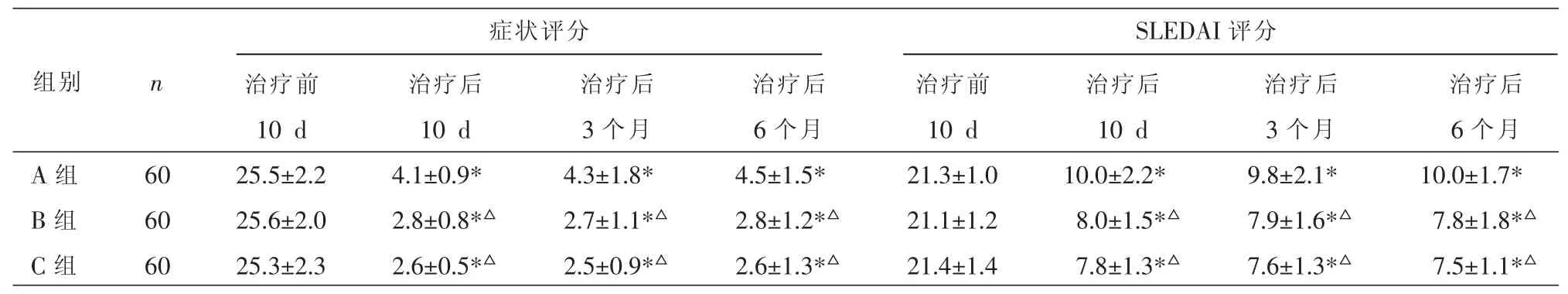
表1 三组治疗前、后症状评分与SLEDAI评分的比较(±s)
注:与本组治疗前比较,*P<0.05;与 A 组比较,△P<0.05。
症状评分SLEDAI评分组别 n A组B组C组60 60 60治疗前10 d 25.5±2.2 25.6±2.0 25.3±2.3治疗后10 d 4.1±0.9*2.8±0.8*△2.6±0.5*△治疗后3个月4.3±1.8*2.7±1.1*△2.5±0.9*△治疗后6个月4.5±1.5*2.8±1.2*△2.6±1.3*△治疗前10 d 21.3±1.0 21.1±1.2 21.4±1.4治疗后10 d 10.0±2.2*8.0±1.5*△7.8±1.3*△治疗后3个月9.8±2.1*7.9±1.6*△7.6±1.3*△治疗后6个月10.0±1.7*7.8±1.8*△7.5±1.1*△
2.2 三组治疗前、后补体C3与ESR的比较
治疗前三组补体C3与ESR的两两比较均P>0.05;治疗后三组各观察点的C3均升高、ESR均降低(P<0.05);B、C 组治疗后各观察点的 C3高于 A 组、ESR低于 A 组(P<0.05);B、C 组无差异(P>0.05)。 见表2。
表2 三组治疗前、后补体C3与ESR的比较(±s)

表2 三组治疗前、后补体C3与ESR的比较(±s)
注:与本组治疗前比较,*P<0.05;与 A 组比较,△P<0.05。
补体C3(g/L)ESR(mm/h)组别 n A组B组C组60 60 60治疗前10 d 0.4±0.3 0.5±0.4 0.4±0.2治疗后10 d 0.7±0.3*0.9±0.2*△1.0±0.4*△治疗后3个月0.7±0.4*0.9±0.4*△1.0±0.5*△治疗后6个月0.8±0.5*1.0±0.5*△1.0±0.4*△治疗前10 d 59.7±26.3 61.8±29.9 60.6±20.8治疗后10 d 22.3±5.0*34.4±7.1*△34.8±6.9*△治疗后3个月20.8±6.9*36.6±8.2*△37.3±7.7*△治疗后6个月19.7±6.3*34.8±7.5*△33.6±7.0*△
2.3 三组治疗前、后抗ds-DNA抗体与24 h尿蛋白的比较
治疗前三组抗ds-DNA抗体与24 h尿蛋白的两两比较均P>0.05;治疗后三组各观察点的ds-DNA 抗体与24 h尿蛋白均降低(P<0.05);B、C组治疗后各观察点的ds-DNA抗体与24 h尿蛋白均低于 A 组(P<0.05);B、C 组无差异(P>0.05)。 见表3。
表3 三组治疗前、后抗ds-DNA 抗体与24 h尿蛋白的比较(±s)

表3 三组治疗前、后抗ds-DNA 抗体与24 h尿蛋白的比较(±s)
注:与本组治疗前比较,*P<0.05;与 A 组比较,△P<0.05。
抗ds-DNA抗体24 h尿蛋白(g/24 h)组别 n A组B组C组60 60 60治疗前10 d 82.0±27.5 79.6±31.0 80.6±25.1治疗后10 d 72.5±9.6*61.9±14.6*△60.0±12.7*△治疗后3个月71.8±8.3*60.4±9.9*△58.9±9.1*△治疗后6个月70.9±7.9*60.0±6.7*△58.4±6.1*△治疗前10 d 2.1±0.5 2.0±0.6 2.2±0.7治疗后10 d 0.5±0.3*0.2±0.3*△0.1±0.3*△治疗后3个月0.4±0.3*0.2±0.2*△0.2±0.3*△治疗后6个月0.5±0.4*0.2±0.3*△0.2±0.2*△
2.4 三组治疗前、后补体Scr与CsyC的比较
三组治疗前 Scr与 CsyC的两两比较均P>0.05;治疗后三组各观察点的的Scr与CsyC均降低(P<0.05);B、C 组治疗后各观察点的 Scr与 CsyC 均低于A 组(P<0.05);B、C 组无差异(P>0.05)。 见表4。
表4 三组治疗前、后补体Scr与CsyC的比较(±s)
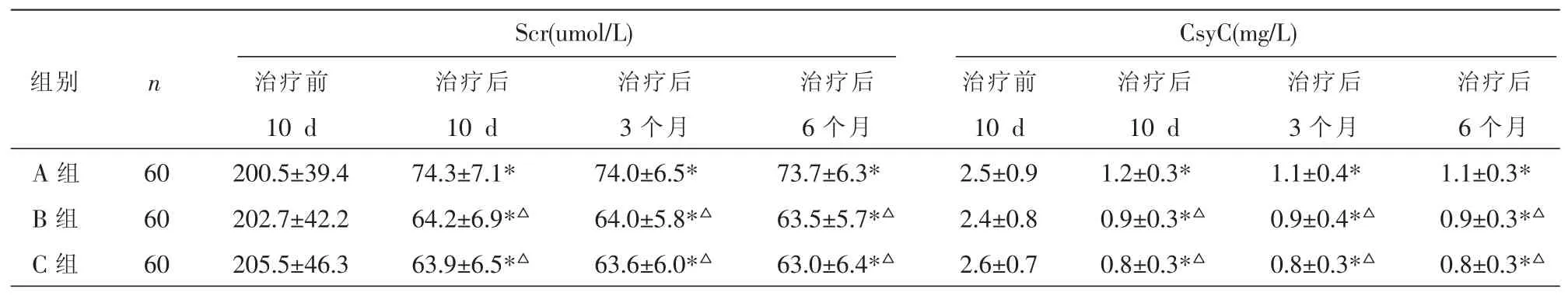
表4 三组治疗前、后补体Scr与CsyC的比较(±s)
注:与本组治疗前比较,*P<0.05;与 A 组比较,△P<0.05。
Scr(umol/L)CsyC(mg/L)组别 n A组B组C组60 60 60治疗前10 d 200.5±39.4 202.7±42.2 205.5±46.3治疗后10 d 74.3±7.1*64.2±6.9*△63.9±6.5*△治疗后3个月74.0±6.5*64.0±5.8*△63.6±6.0*△治疗后6个月73.7±6.3*63.5±5.7*△63.0±6.4*△治疗前10 d 2.5±0.9 2.4±0.8 2.6±0.7治疗后10 d 1.2±0.3*0.9±0.3*△0.8±0.3*△治疗后3个月1.1±0.4*0.9±0.4*△0.8±0.3*△治疗后6个月1.1±0.3*0.9±0.3*△0.8±0.3*△
2.5 三组治疗前、后AST与ALT的比较
三组治疗前AST与ALT的两两比较均P>0.05;治疗后三组各观察点的的AST与ALT均降低 (P<0.05);同时B、C组治疗后各观察点的AST与ALT均低于 A 组(P<0.05);B、C 组无差异(P>0.05)。 见表5。
表5 三组治疗前、后AST与ALT的比较(±s)

表5 三组治疗前、后AST与ALT的比较(±s)
注:与本组治疗前比较,*P<0.05;与 A 组比较,△P<0.05。
AST(U/L)ALT(U/L)组别 n A组B组C组60 60 60治疗前10 d 65.2±10.5 64.8±11.7 65.7±10.0治疗后10 d 37.8±5.7*33.2±6.2*△32.5±5.0*△治疗后3个月35.4±6.2*32.4±5.3*△31.7±5.9*△治疗后6个月34.0±5.2*31.6±5.7*△30.8±5.4*△治疗前10 d 63.4±9.8 62.4±8.9 60.5±9.4治疗后10 d 40.4±7.1*34.1±5.3*△35.0±4.8*△治疗后3个月37.4±5.0*32.0±4.1*△31.2±4.3*△治疗后6个月36.6±4.7*31.2±4.3*△30.3±3.9*△
2.6 三组治疗前、后CD4+T细胞中个细胞亚群百分率的比较
三组治疗前 IFN-r-IL-10+、IFN-r+IL-10+亚群所占CD4+T细胞百分率的两两比较均P>0.05;治疗后三组各观察点的IFN-r-IL-10+、IFN-r+IL-10+亚群所占百分率均降低(P<0.05);C组治疗后各观察点的IFN-r-IL-10+、IFN-r+IL-10+亚群所占百分率低于 A、B 组(P<0.05);A、B 组无差异(P>0.05)。 见表6。
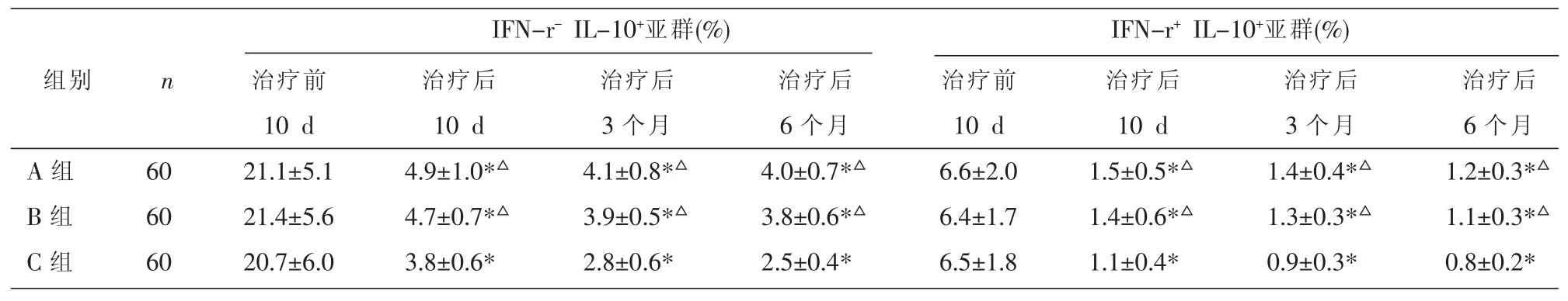
表6 三组治疗前、后CD4+T细胞中个细胞亚群百分率的比较 (x±s)
2.7 三组治疗前、治疗后血清BAFF水平的比较
三组治疗前血清BAFF水平的两两比较均P>0.05;治疗后三组各观察点的血清BAFF水平均降低(P<0.05);B、C组治疗后各观察点的血清BAFF水平均低于A组 (P<0.05);B、C组的比较则无统计学意义(P>0.05)。 见表7。
表7 三组治疗前、治疗后血清BAFF水平的比较(±s)
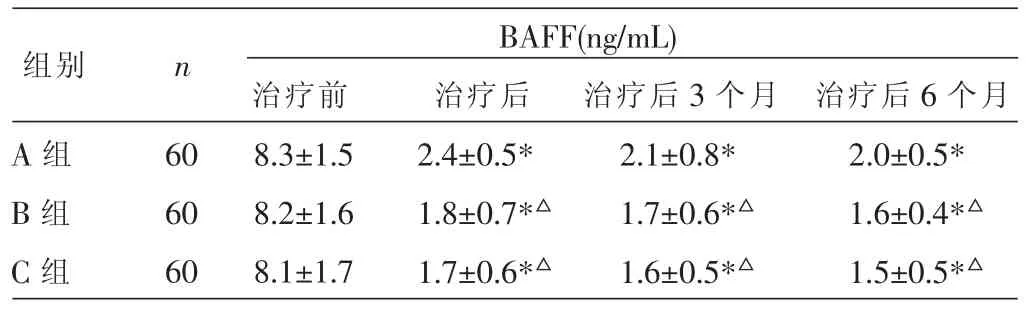
表7 三组治疗前、治疗后血清BAFF水平的比较(±s)
注:与本组治疗前比较,*P<0.05;与 C 组比较,△P<0.05。
组别 n A组B组C组60 60 60 BAFF(ng/mL)治疗前 治疗后 治疗后3个月 治疗后6个月8.3±1.5 8.2±1.6 8.1±1.7 2.4±0.5*1.8±0.7*△1.7±0.6*△2.1±0.8*1.7±0.6*△1.6±0.5*△2.0±0.5*1.6±0.4*△1.5±0.5*△
2.8 疾病疗效
A组治疗总有效率为71.7%(43/60),低于B组的 90.0%(54/60)与 C 组的 93.3%(56/60)(P<0.01)。 见表8。

表8 三组治疗总有效率的比较 n(%)
2.9 不良反应
A组不良反应发生率为25.0%(15/60),高于B组的16.7%(10/60)与C组的 10.0%(6/60)(P<0.05);B组不良反应发生率高于C组(P<0.05)。见表9。

表9 三组不良反应发生率的比较 n(%)
3 讨论
为探析PE治疗SLE的疗效及犀角地黄汤的减毒作用,本研究将纳入患者分为3组,A组采取环磷酰胺冲击治疗,B组采取PE,C组采取PE联合犀角地黄汤,结果示B、C组症状评分与SLEDAI评分下降均较A组明显,治疗总有效率达90.0%、93.3%,高于A组,提示PE效果优于环磷酰胺。
高浓度抗ds-DNA抗体是SLE的特异性表现之一[6],有研究指出[7],抗ds-DNA抗体可结合DNA分子形成复合物而损伤肾脏、脑组织。CysC主要经肾脏清除,SLE患者肾脏受累,对CysC的清除效果减弱[8],CysC上升。有研究显示[9],SLE患者血清Scr与24 h尿蛋白水平均偏高。本研究B、C组治疗后各观察点的抗 ds-DNA 抗体、Scr、CysC、24 h尿蛋白均低于A组,证实PE利于改善患者肾功能损伤。治疗后B、C组AST及ALT均降低,表明PE治疗SLE可更好缓解肝功能损伤。
环磷酰胺为治疗SLE常用免疫抑制剂,大量研究示[10-11],环磷酰胺副作用明显。PE为现代净化血液手段,通过对血液成分进行分离而起到去除血液中致病物质的作用。内毒素及免疫复合物随血液循环到达肝脏、肾脏并发生沉积而引起组织损害为SLE主要病因。环磷酰胺可缓解病情,但无法全面消除致病因子。PE对致病因子的消除更彻底、全面,治疗后症状减轻与肾功能改善均更明显。
有文献显示[12],SLE患者血清补体C3水平偏低。ESR为炎症的非特异性指标,水平受免疫复合物影响。有研究发现[13],BAFF的过度表达可诱导B淋巴细胞增殖与分化而参与SLE发病。B、C组治疗后补体C3升高幅度与ESR、BAFF降低幅度均更大,提示PE利于抑制炎症反应并提高补体C3水平。PE除通过血液分离清除SLE致病因子外,还可增强机体网状内皮细胞系统的清除功能,且在置换液代替中添加补体C3等于病情有益的成分,利于病情恢复。
中医药在扶正减毒方面的作用已得到临床认可[14],本研究中C组在B组基础上联用犀角地黄汤,结果显示消化道出血、恶心呕吐、脱发、低钙血症、胃肠道反应、高血压等不良反应总发生率为10.0%,低于B组的16.7%与A组的25.0%,且治疗后不同观察点的IFN-r-IL-10+亚群与IFN-r+IL-10+亚群所占百分率下降幅度大于A、B组,表明犀角地黄汤可增强患者免疫力、减轻毒副作用。SLE属中医“阴阳毒”、“蝶疮流注”范畴,病因以肾虚阴亏为实,热毒、血瘀为其标,虚实互为因果。犀角地黄汤由水牛角、生地、赤芍、丹皮等药物组成,方中水牛角为君药,清热解毒;生地为臣药,清热凉血、养阴生津;赤芍与丹皮共为佐药,赤芍与丹皮均性微寒,均清热凉血、活血散瘀。忍冬藤为使药,清热解毒、祛风通络。全方兼以清热、养阴,宁血、清热又不会导致耗血过多,凉血、散瘀又不会因血止而留瘀,发挥扶正固本、清热凉血、解毒化瘀之功。有动物实验表明[15],生地黄可抑制毛细血管通透性,降低患者IL-10水平,增加外周血液中T淋巴细胞数。地黄多糖可减轻细胞损伤,因而C组不良反应更少。
综上所述,PE可清除血浆中致病因子、抑制炎症反应,改善患者症状,联合犀角地黄汤可进一步扶助正气、解毒化瘀,增强机体耐受力和免疫力,扶正减毒,效果理想。
[1]周立偲,田 浤,高向东,等.生物技术药物治疗系统性红斑狼疮的研究进展[J].药学与临床研究,2014,22(3):251-256.
[2]欧阳恒.论难治性皮肤病之诊治[J].湖南中医药大学学报,2007,27(4):4-6.
[3]章海涛,刘正钊,胡伟新,等.双重血浆置换联合激素治疗重症狼疮性肾炎的临床观察[J].肾脏病与透析肾移植杂志,2013,22(3):201-206.
[4]Futatsuya K,Kakeda S,Kaichi Y,et al.Systemic lupus erythematosus:Prediction by MRI of thesubsequent development of brain lesions[J].Academic radiology,2014,21(5):617-623.
[5]郑筱萸.中药新药临床研究指导原则[M].中国医药科技出版社,2002:41-42.
[6]Okon LG,Werth VP.Cutaneous lupus erythematosus:Diagnosis and treatment[J].Bestpractice & amp;research:Clinical rheumatology,2013,27(3):391-404.
[7]Tsuchiya H,Haga S,Takahashi Y,et al.Identification of novel autoantibodies to GABAB receptors in patients with neuropsychiatric systemic lupus erythematosus[J].Rheumatology,2014,53(7):1219-1228.
[8]罗 徐.贝前列素钠联合糖皮质激素治疗狼疮肾炎患者蛋白尿和血尿的临床观察[J].湖南中医药大学学报,2014,34(6):38-40.
[9]赵成广,唐 莹,杜 悦,等.血浆置换与免疫吸附治疗儿童重症系统性红斑狼疮对照疗效分析[J].中国小儿急救医学,2014,21(12):795-798.
[10]简 讯,罗晓英,马 懿,等.血浆置换联合药物治疗儿童重症系统性红斑狼疮的临床疗效[J].医学临床研究,2013,30(7):1289-1291.
[11]Song JN,An JY,Hao GS,et al.Role of Akt signaling pathway in delayed cerebral vasospasm after subarachnoid hemorrhage in rats[J].Acta Neurochirurgica,2013,155(11):2063-2069.
[12]钟益萍,米向斌,张堂德,等.白芍总苷辅助治疗SLE对患者外周血CD4+CD25+T 细胞表达的影响[J].重庆医学,2014,43(32):4311-4313.
[13]姜 帆,周泓屹,吴广明,等.环磷酰胺联合泼尼松治疗老年性SLE对患者血清各指标影响及其疗效观察[J].标记免疫分析与临床,2016,23(2):132-134.
[14]Akbarian M,Soleymani H,Gharibdoost F.Isolated Hematuria in SLE Patients and its Association with Proteinuria,Uri-nary Castand SLE Disease Activity [J].Acta Medica Iranica,2011,47(1):321-324.
(本文编辑 李 杰)
Study on the Effect and Mechanism of Modified Xijiao Dihuang Decoction Combined with Plasma Exchange in Treating Acute Severe Systemic Lupus Erythematosus
ZHOU Tao
(Wuhan Puren Hospital Affiliated to Wuhan University of Science and Technology,Wuhan,Hubei 430081,China)
ObjectiveTo observe the effects of modified Xijiao Dihuang decoction combined with plasma exchange(PE)in treating acute sever systemic lupus erythematosus (SLE)and explore the mechanism.MethodsA total of 180 patients with SLE in our hospital were selected as study subjects.By the random number table method,the patients were divided into group A,group B and group C.Group A was given cyclophosphamide pulse therapy,while group B was treated with PE,and group C was treated with PE combined with Xijiao Dihuang decoction.The symptom scores,SLEDAI scores,complement C3,erythrocyte sedimentation rate (ESR),anti Ds-DNA antibody,serum creatinine (Scr),serum cystain (CsyC),aspertate aminotransferase(AST),alanine transaminase(ALT),24 h urine protein,human Interferon gamma(IFN-r),interleukin-10(IL-10)and BAFF were compared between groups before and after treatment.The total efficiency and the incidence rates of adverse reactions were statistically analyzed.ResultsThe symptom scores,SLEDAI scores,ESR,ds-DNA antibody,24 h urine protein,Scr,Csyc,AST,ALT and serum BAFF in group B and group C at different time points after treatment were lower than those in group A (P<0.05).The proportions of IFN-r-IL-10+subset and IFN-r+IL-10+subset in group C at different time points after treatment were lower than those in group A and group B (P<0.05).The C3in group B and group C at different time points after treatment were higher than those in group A (P<0.05).The total effective rates of group B and group C (90.0%,93.3%)were higher than that in group A (71.7%) (P<0.01).The incidence rate of adverse reactionsin group C (10.0%)was lower than that in group A and group C (P<0.05,P<0.01)).ConclusionPlasma exchange can remove harmful elements in plasma.The combined therapy with Xijiao Dihuang decoction can maintain vital Qi,detoxify and remove stasis and improve immunity,playing an effect-enhancing and toxicity-reducing role.Besides,the effect is more ideal.
systemic lupus erythematosus;Xijiao Dihuang decoction;plasma exchange
R259
A
10.3969/j.issn.1674-070X.2017.02.024
2016-09-26
周 涛,男,硕士,副主任医师,研究方向:风湿内科,E-mail:h847973@qq.com。
本文引用:周 涛.犀角地黄汤加减联合血浆置换治疗急重型系统性红斑狼疮的疗效与机制研究[J].湖南中医药大学学报,2017,37(2):204-208.
