冻干粉针剂配液灌装系统的清洁验证
2017-07-10王德艳
王德艳 谢 航
海口奇力制药股份有限公司GMP技术室 海南省海口市 570216
冻干粉针剂配液灌装系统的清洁验证
王德艳 谢 航
海口奇力制药股份有限公司GMP技术室 海南省海口市 570216
对生产结束后按清洁规程对系统进行清洁,然后进行清洁灭菌效果的取样检测无菌、内毒素、残留量等各项检测项目均符合标准,表明现行的清洁规程能有效地清洁生产系统及设备,防止交叉污染,保证下批产品规定的疗效、质量和安全性的状态,符合GMP生产要求。在产品生产后,若残留活性成分及其降解产物、辅料等,直接进入下批生产过程,必然对下批产品产生不良影响,根据GMP及《药品生产验证指南(2003)》[1]的要求,必须对其生产系统及设备的清洁方法进行定期的清洁验证,冻干粉针剂具有生产工艺相对复杂、其清洁验证难点在于残留、无菌取样方法与取样点的确定,对配液灌装系统进行取样点分析确定、对取样与检验方法进行验证,得出真实可靠的结果。
配液罐装系统;清洁验证;回收率
1 验证方法
1.1 验证目的
车间为了证明生产操作人员按照经批准的按设定的《配料过滤系统清洁、消毒标准操作规程》和《SYGZ-600直线液体灌装机清洁、消毒标准操作规程》,进行清洁灭菌操作,能对冻干粉针剂车间配液灌装系统进行有效的清洁、灭菌 ,避免对下批产品生产造成污染,保证产品质量。验证方案中最关键问题为如何确定残留参照物限度,用什么方法能准确地定量残留量,这包括取样方法和检测方法的制订与验证[1]。一般药品是由活性成分和辅料组成,根据《药品生产验证指南》的“清洁验证”评估了生产线最难清洗的残留物为奥美拉唑钠,所以作为本次清洁验证的参照物。
1.2 残留参照物限度的确定
在验证方案中,残留参照物限度检验方法的确定是关键,接受的限度标准基于以下原则:①如浓度限度10×10-6;②生物活性的限度为最低日治疗剂量的0.1%。一般说来,除非是高活性、高敏感性的药品,残留参照物限度 10×10-6是足够安全的。因此可进一步将其简化成最终淋洗水样品的浓度限度为10×10-6。根据以上原则,我们从残留参照物限度10×10-6可推导出设备内表面积残留物浓度 (表面残留物限度)。计算前需假设残留物均匀分布在设备表面上,在下批生产时全部溶解在产品中,限量计算L= 10•B/(SAxF ),式中:B-下批产品取最小批量,SA一接触面积,即设备总内表面积 (包括管道 ),F一安全因子 (根据残留物限度要求,取F= 100)。
1.3 检验方法的验证[2]
根据《药品生产验证指南 (2003)》的要求,在清洁验证中所使用的检验方法是质量保证体系的重要组成部分,也是验证方案的关键技术难点之一,为确保检验方法的准确性和重现性,检验方法必须验证 ,其验证包括:专属性、回收率、检测限和残留量限度、稳定性等。按中国药典2015 年版注射用奥美拉唑钠含量定项下的色谱条件为依据进行方法验证。
1.3.1 回收率试验
取样方法其过程也需经过验证,通过回收率试验验证取样过程的回收率和重现性。综合回收率一般不低于75%,多次取样回收率的RSD不大于20%,在设备表面材质相同的板材上,均匀地喷上约1ug/cm2注射用奥美拉唑钠溶液 ,待其干燥后用棉签对8个100mm×100mm的方块分别取样检测,经HPLC检测 ,残留量限度浓度为0.0685ug/cm2,最低检测浓度为0.1ug/ml,回收率约为82.7% (RSD=1.0%),结果表明回收率稳定符合检测方法的要求。
1.3.2 取样点的选择
取样点的选择,是取样方法的有机组成部分,要检测清洁效果如何,取样点就应包括各类最难清洁部位。由于整个生产系统中有多根管道且部分管径不同,给清洁带来一定的难度 。凡是死角、清洁剂不易接触的部位 ,都应视为最难清洁的部位。根据取样点的选择原则及生产系统的实际,我们确定管道连接处、钛棒壳、滤芯壳、灌装泵等应为最难清洁的部位,确立为取样点。
1.3.3 取样计划与结果
试生产三批结束后,操作人员对配液灌装系统进行清洁,取样检测残留量、微生物、无菌等项目。检测结果见表1,均符合规定,表明生产后配液灌装系统的清洁已达到GMP生产要求。
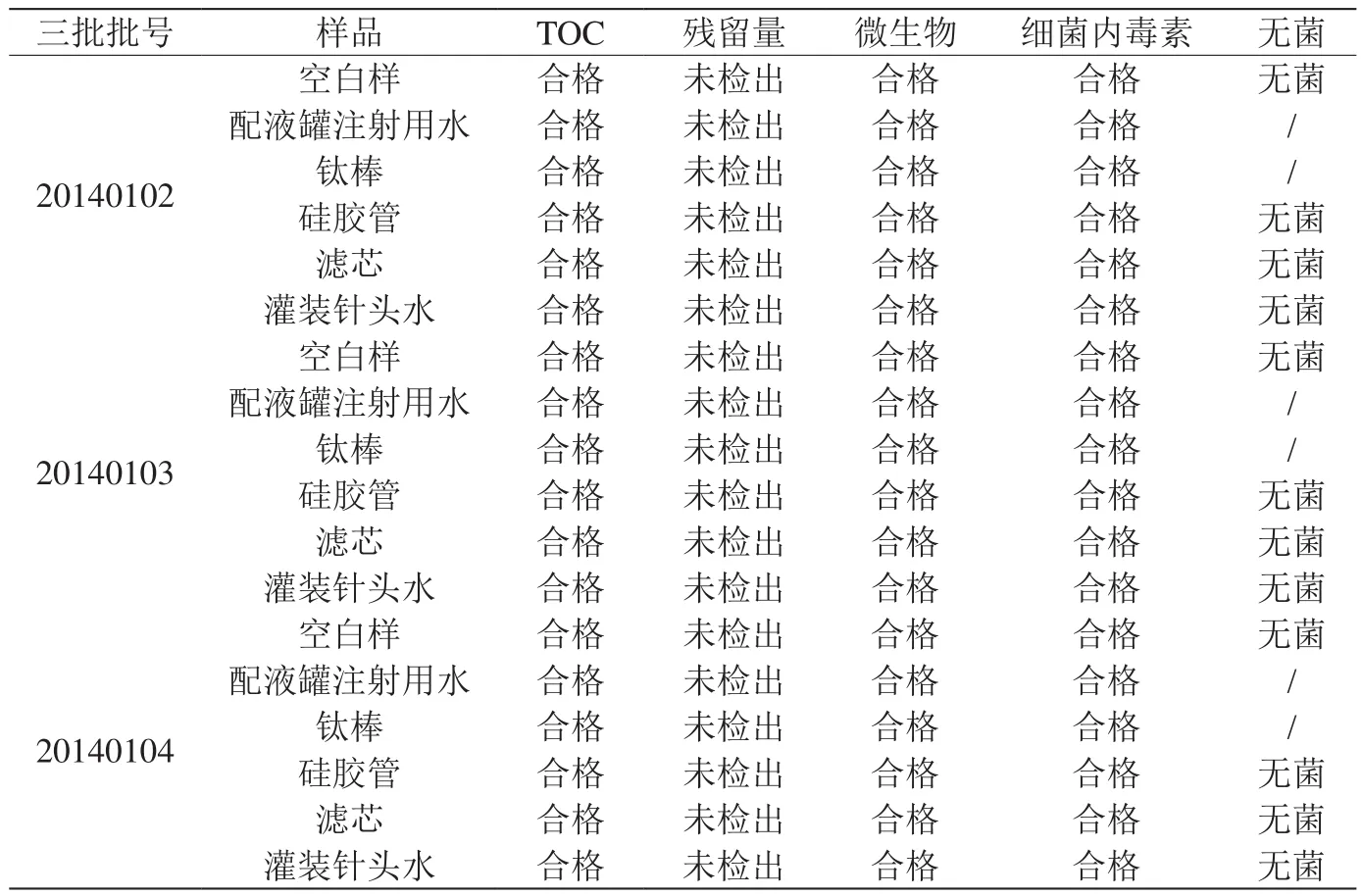
表1:试生产三批样品检测结果
2 结论
本次验证严格按照方案进行,根据生产前及生产后清洁的各种确认方法及检测项目的结果来看,均可达到验证方案及GMP生产的要求,证明生产车间现行的清洁规程及方法能有效地清洁配液灌装生产系统及设备,避免污染和混淆,保证下批产品规定的疗效、质量和安全性的状态,而且根据实际情况采取适宜的安全系数,即所推导出的合格标准具有可操作性[3]。本次验证是一次合格的清洁验证。
[1]白慧良,李武臣.药品生产验证指南(2003)[M].北京:化学工业出版社,2003:159-167.
[2]胡冬云.清洁规程及其验证[J].中国医药工业杂志,2002,33(07):350-352.
[3]陈雯秋.清洁验证合格标准的制定[J].医药导报,2005,24(05):452.
