兼养小球藻在不同浓度Fe3+培养下的蛋白质组学研究
2017-07-07刘彩霞顾文辉黄爱优伍松翠张宝玉王广策
刘彩霞, 顾文辉, 黄爱优, 3, 伍松翠, 张宝玉, 王广策
兼养小球藻在不同浓度Fe3+培养下的蛋白质组学研究
刘彩霞1, 2, 顾文辉1, 黄爱优1, 3, 伍松翠1, 2, 张宝玉1, 王广策1
(1. 中国科学院海洋研究所实验海洋生物学重点实验室, 山东青岛 266071; 2. 中国科学院大学, 北京 100049 ; 3. 中国科学院海洋研究所海洋科学与技术研究发展中心, 江苏南通 226006)
为研究小球藻()对不同浓度Fe3+的响应, 测定了自养和乙酸兼养小球藻在不同浓度Fe3+条件下的生长速率和油脂含量, 比较分析了兼养小球藻在不同浓度Fe3+下的蛋白质组表达差异。结果表明, 兼养小球藻比自养小球藻生长速率快, 积累的生物量多, 在缺铁条件下中性脂含量高。蛋白质组分析显示: 在缺铁条件下光合作用相关蛋白含量最低; 在缺铁和高浓度铁条件下, 热激蛋白、蛋白合成和糖代谢等过程相关蛋白表达都下调, 表明缺铁和高浓度铁条件对小球藻的生长都是逆境条件; 在缺铁条件下氨基酸代谢相关蛋白表达上调, 这可能是由于NO3–同化下降, 氨基酸合成减少, 需要进行氮的回收利用。上述结果表明: 在兼养条件下缺铁培养的小球藻可获得较高生物量和中性脂含量; 而高浓度铁能促进小球藻生长, 但不能提高中性脂含量, 对藻细胞也有一定的胁迫效应。
小球藻(); 兼养; 乙酸盐; 铁离子; 蛋白质组
石化燃料的短缺和温室气体CO2排放的增多, 迫使人们寻找新的可替代能源。在众多新能源中, 生物能源具有来源广泛、污染小、可再生性等优点, 应用前景广阔[1]。目前已发展作为生物能源的原料主要有谷物、菜油及微藻等。微藻具有生长周期短、产量大、油脂含量高等特点, 可以在远离农场和森林的地方(如池塘、发酵罐, 甚至废水)进行培养[2], 不占用耕地, 对生态链和食物链的伤害小[3], 因而已逐渐成为生物燃油首选的原料。
微藻油脂含量是微藻生物柴油能否实现工业化生产的关键因子之一, 受营养盐等生长条件的影响。已有报道, 氮缺乏[4-6]、磷限制[5-7]、高盐[8]和重金属胁迫[9]等条件均能促进微藻油脂积累。然而, 这些因子在提高油脂含量的同时也限制了生物量的积累, 并不能有效提高油脂产量。必须寻求其他调控因子, 在提高油脂含量的同时又不限制、甚至能促进生物量的积累。Behrenfeld等[10]证明铁元素是影响浮游微藻生物量的关键因素; Liu等[11]发现在小球藻()指数生长后期补加铁离子可提高细胞终密度, 在初始培养基中添加一定浓度铁离子可以促进油脂积累。在此基础上, 学者们对海洋微藻中的假微型海链藻[12]和某些淡水小球藻[13]、葡萄藻[14]、栅藻[15]等的研究中也发现了类似的结果, 说明铁元素可以同时促进微藻的生长和油脂的积累。
上述研究大多在自养条件下进行, 在兼养条件下能否得到类似的结果?有研究报道, 外加有机碳源(如乙酸盐, 糖浆, 甘油等)兼养也可提高小球藻油脂含量[16-17]。那么, 兼养条件下提高培养基中Fe3+的浓度是否也会促进小球藻油脂合成?作者以小球藻()为研究对象, 分别在自养和乙酸兼养条件下测定了不同浓度Fe3+对小球藻生长和油脂含量的影响, 比较分析了不同浓度Fe3+兼养小球藻的蛋白质组表达差异, 以期从蛋白质组角度对兼养条件下小球藻油脂积累途径进行解析, 为人工控制提高小球藻油脂含量提供理论依据。
1 材料与方法
1.1 藻种和培养条件
研究所用小球藻()由本实验室保存。所用培养基为改良的BG-11培养基, 将原BG-11培养基[18]中的铁用FeCl3代替柠檬酸铁, 自养时所用碳源为Na2CO3, 兼养时所用碳源为乙酸钠。所有培养均在光照培养箱中进行, 光强为100 µmol/(m2·s),温度为30℃, 光暗周期为12 h︰12 h(白天︰黑夜)。藻种分别在不含铁的自养和兼养培养基中培养5 d后, 2 000 g离心收集重新接种到不含铁的新鲜培养基中继续培养5 d, 使其充分缺铁。最后藻液离心收集后重新悬浮于5.4 L不含铁的新鲜培养基中, 混匀, 初始接种浓度为 0.1 (682)。将混匀的藻液均分到9个1 L的三角瓶中, 根据Liu等[11]的Fe3+设置浓度和前期试验, 将Fe3+浓度设置为0、10–6和10–5mol/L共3个处理, 每个处理3个重复。每天定时摇瓶3次。
1.2 生长测定
用紫外分光光度计(UV-1800)测定682 nm处的吸光度来确定其生长速率, 当藻细胞处于生长对数后期时, 2 000 g离心收集。
1.3 中性脂相对含量测定
中性脂的测定采用尼罗红(Nile Red)染色, 荧光分光光度计(HITACHI F-4500)测定的方法[19-20]。在培养过程中, 每天定时取10 mL藻液, 根据值进行浓缩或稀释, 使其为0.1~0.8。取900 µL藻液, 加入100 µL二甲基亚砜(DMSO), 混匀, 30℃水浴处理10 min。取处理后的藻液980 µL, 加入20 µL尼罗红染料(浓度为0.1 mg/mL丙酮), 染色1 min 30 s后测定570 nm处的荧光值, 激发光为480 nm。根据值与细胞数换算成百万细胞相对荧光值[20]。
1.4 总可溶性蛋白的提取
蛋白提取方法参照Wang等[21]的方法。在对数生长后期以2 000 g离心收集藻液, 去除上清, 液氮速冻后取0.5 g鲜藻于研钵中研磨5 min, 研磨时加适量石英砂。加蛋白提取液15 mL, 4℃放置0.5~2 h, 每20 min摇晃一次; 8 000 g 4℃离心20 min, 去除沉淀, 上清加入4倍体积的10%(/)三氯乙酸(TCA)-丙酮, 内含0.07%(/)β-巯基乙醇, 于–20℃静置过夜。8 000 g 4℃离心20 min, 去除上清, 用丙酮冲洗蛋白沉淀4次以去除三氯乙酸, 放置在–20℃使残留的丙酮挥发。蛋白粉末使用8 mol/L尿素(含125 mmol/L碳酸氢铵)在室温下(约25℃)充分溶解。8 000 g 4℃离心10 min, 去除未溶解沉淀。上清使用3K超虑管(Amicon Ultra 0.5 mL, Milipore)在8 000 g 4℃离心20 min;添加8 mol/L尿素, 超滤3次。
1.5 蛋白质定量和质谱检测
使用Solarbio BCA蛋白浓度测定试剂盒(Cat#PC0020)进行蛋白定量, 以8 mol/L尿素稀释, 使各样品蛋白终浓度为1 mg/mL。蛋白样品在37℃下用10 mmol/L DTT (二硫苏糖醇)还原1 h; 在黑暗条件下用50 mmol/L碘乙酰胺处理30 min, 进行烷基化; 最后在37℃下用胰酶消化(胰酶︰蛋白为1︰30), 消化后的多肽用1%的甲酸酸化并贮存在–80℃, 以备LC-MS/MS检测使用。质谱检测参照顾文辉的参数[22]。
2 结果
2.1 自养和兼养小球藻在不同铁离子浓度下的生长速率
图1显示自养和兼养小球藻都是在高浓度铁(1.2×10–5mol/L)条件下生长速率最快, 积累的生物量最多, 中浓度铁时次之, 缺铁(0 mol/L)时最慢。兼养条件下到达平台期所需时间短, 积累的生物量多, 自养条件下到达平台期所需时间长, 积累的生物量少。自养时, 在中浓度铁和高浓度铁条件下小球藻生长初期生长速率几乎一致, 到生长后期高浓度铁培养的小球藻生长速率比中浓度铁浓度快, 20 d时缺铁条件下小球藻生长接近平台期,约为0.8, 中浓度和高浓度铁则还在生长。兼养时, 小球藻的生长速率随铁离子浓度升高而加快, 缺铁处理5 d到达平台期,约为1.5, 高浓度铁浓度培养条件下约9 d到达平台期,约为3.0。与自养培养相比, 小球藻兼养培养条件下在短时间内积累了更多的生物量。
2.2 自养和兼养小球藻在不同Fe3+浓度下中性脂百万细胞荧光值
如图2所示, 在缺铁条件下, 自养和兼养小球藻随着培养时间的推移中性脂百万细胞相对荧光值逐渐上升, 随后下降。自养时, 小球藻在第6天百万细胞相对荧光值达到最高值, 兼养时一直处于较高水平, 在培养9 d后到最高值。中浓度铁条件下, 自养时中性脂百万细胞荧光值一直接近于0; 兼养时, 中性脂百万细胞荧光值随培养时间增加先上升后下降, 在第3 d到达最高值, 最后下降, 到第7天几乎降为0。高浓度铁条件下, 自养时中性脂百万细胞荧光值一直接近于0, 兼养时小球藻的中性脂百万细胞荧光值随培养时间的增加急剧下降, 培养5 d后基本降为0。
2.3 兼养蛋白质组结果分析
由生长速率和中性脂含量可以看出, 小球藻在兼养条件下能获得较高的生物量和中性脂含量, 所以我们选取兼养的3组处理进行蛋白质组分析。
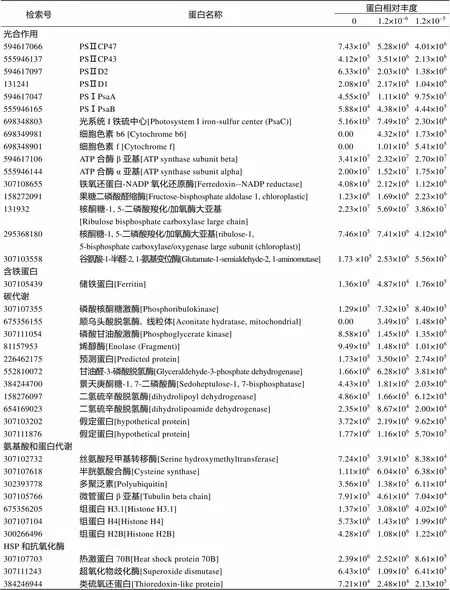
由表1可以看出, PS Ⅱ相关蛋白(CP47、CP43、D2、D1和PsaA)在中浓度铁条件下表达量最高, 在缺铁和高浓度铁条件下表达量都有所下降。PS Ⅰ相关蛋白(PsaA和PsaB)在缺铁时含量最低, 中浓度铁和高浓度铁时均高于缺铁时含量, 二者表达量相差不大。ATP酶的α和β亚基在中浓度铁条件下含量最低, 缺铁时含量高于高浓度铁条件。大部分卡尔文循环相关的酶(果糖二磷酸醛缩酶和核酮糖-5-磷酸激酶)随着铁离子浓度的升高而表达量增加。PS Ⅰ铁硫中心(PsaC)蛋白含量、放氧复合物相关蛋白和细胞色素b6/f复合体的b6和f蛋白含量都随着铁离子浓度的升高而升高。Fd-NADP氧化还原酶在缺铁和高浓度铁条件下含量较高, 缺铁条件下的表达量高于高浓度铁条件。储铁蛋白(ferrtin)在缺铁和高浓度铁时含量都较高。
碳代谢相关蛋白(主要是糖酵解途径、三羧酸循环和磷酸戊糖途径的几种酶)包括磷酸甘油酸激酶、烯醇酶、景天庚酮糖-1, 7-二磷酸酶等的含量都是在中浓度铁时最高。
氨基酸代谢相关酶和聚泛素在缺铁时含量最高, 均高于中浓度铁和高浓度铁水平; 微管蛋白和组蛋白都是在缺铁和高浓度铁条件下含量高, 且缺铁时含量比高浓度铁时要高, 中浓度铁时最低。HSP70B、超氧化物歧化酶和硫氧还蛋白样蛋白在高浓度铁时都含量最高。
3 讨论
3.1 缺铁限制小球藻生长
由生长曲线(图1)可以看出缺铁限制了小球藻的生长。铁元素是浮游植物生长的必需元素, 存在于光合生物色素合成的相关酶中, 是光合作用和呼吸作用电子传递链的主要组成成分, 也作为氮素同化的辅助因子[23]。光系统Ⅰ(PSⅠ)因为含铁量高(3个4Fe-4S, 12Fe/PSⅠ), 成为铁元素缺乏的主要靶标[24], 同时, 铁作为PSⅡ和细胞色素b6/f等电子传递系统组分的辅助因子, 缺铁也会引起其含量下降[25]。蛋白质组结果显示, 缺铁条件下PSⅠ和PSⅡ的光合元件含量较低, 可能已经降解, 光合电子传递受到影响, 光反应在缺铁条件下受到抑制。植物体内硝酸盐和亚硝酸盐的还原需要铁元素作为辅助因子[26], 缺铁会抑制植物体内的蛋白质合成[27], 氨基酸和蛋白代谢相关蛋白在缺铁时表达量高于中浓度铁组和高浓度铁组, 可能是在缺铁条件下NO3–同化下降, 氨基酸合成减少; 同时, 蛋白的降解加快, 利于氨基酸的重新利用。微管蛋白和组蛋白在细胞分裂过程中起重要作用[28], 在缺铁和高浓度铁条件下含量都较高, 并且缺铁时高于高浓度铁的含量, 说明在缺铁条件下细胞合成更多的骨架蛋白和组蛋白以备在条件适宜时进行细胞分裂和生长。
表1 通过LC-MS/MS鉴定的不同浓度铁离子下的总可溶性蛋白的质谱分析
Tab.1 Summary of the total soluble proteins identified by LC-MS/MS under different iron concentrations
3.2 兼养和缺铁共同作用下获得较高生物量和高油脂含量
有研究表明小球藻在兼养条件下, 生物量增加, 油脂含量提高[29]。小球藻在乙酸盐兼养条件下生长速率快, 到达平台期时间短, 生物量高。
中性脂测定结果(图2)显示缺铁条件下小球藻积累中性脂。藻细胞通过卡尔文循环固定CO2, 核酮糖-1, 5-二磷酸羧化/加氧酶是碳固定的限速酶, 虽然该酶不直接需要铁元素, 但碳同化过程消耗来自光反应的ATP和NADPH, 这些物质的供应受到铁缺乏的影响, 在缺铁条件下表达下调[25, 30], 导致光合固碳减少, 光合作用生成的有机物减少。铁元素是硝酸还原酶和亚硝酸还原酶的辅助因子, 在氮素的同化过程中有重要作用[26], 缺铁时无法为植物生长提供足够的氮源, 而藻细胞仍可直接吸收乙酸盐形成乙酰CoA, 多余的碳将进行重新分配, 合成中性脂。中浓度铁和高浓度铁时, 细胞有足够的铁合成各种含铁元件, 此时细胞同化的碳多用于合成细胞必需的蛋白和多糖, 细胞生长迅速, 合成中性脂的量少。
在缺铁的培养条件下, 自养和兼养的小球藻都积累中性脂, 但兼养时中性脂含量比自养时高很多, 生物量也比自养时高。所以, 兼养和缺铁共同作用下可获得较高的生物量和油脂含量。
3.3 高浓度铁促进生长, 但对细胞有一定的胁迫作用
高浓度铁条件下生长速率最大。高浓度铁下, 藻体合成大量光合相关蛋白和酶, 光反应加快, 生成的ATP和NADPH增多, 卡尔文循环相关酶表达量随着铁离子浓度升高而上升, 加速了碳固定速率。铁元素是很多生物过程的必需组分, 但铁离子浓度过高会产生大量活性氧[31], 对细胞光合膜造成氧化伤害[32], 蛋白质指结果显示PS Ⅱ光合蛋白含量下降, 说明高浓度铁离子对PS Ⅱ光合膜影响显著, 但PS Ⅰ对此似乎并不敏感, 无明显下降。生物有多种降低活性氧, 保护自身免受毒害的方式, 包括形成抗氧化分子(如谷胱甘肽、抗坏血酸、生育酚和类胡萝卜素)和抗氧化酶(SOD、CAT和APOX)以保护植物免受氧化伤害[33]。高浓度铁条件下, 与抗氧化相关的蛋白(热激蛋白和超氧化物歧化酶)表达量最高, 说明高浓度铁对小球藻造成氧化胁迫, 藻体合成更多抗氧化物质进行自我保护, 免受氧化伤害。叶绿素本身不含铁, 但合成叶绿素的部分酶需要铁元素作为辅助因子[34], 叶绿素合成的相关酶(谷氨酸半醛氨基转移酶)变化趋势与光系统的变化趋势一致, 在缺铁时表达最低, 在中浓度铁时表达最高, 高浓度铁时比中浓度铁时略有下调, 说明叶绿素的合成与光系统蛋白含量是正相关的。
[1] Hill J, Nelson E, Tilman D, et al. Environmental, economic, and energetic costs and benefits of biodiesel and ethanol biofuels[J]. Proceedings of the National Academy of Sciences, 2006, 103(30): 11206-11210.
[2] Valderrama L T, Del Campo C M, Rodriguez C M, et al. Treatment of recalcitrant wastewater from ethanol and citric acid production using the microalga Chlorella vulgaris and the macrophyte Lemna minuscula[J]. Water Research, 2002, 36(17): 4185-4192.
[3] Chisti Y, Biodiesel from microalgae[J]. Biotechnology Advances, 2007, 25(3): 294-306.
[4] Illman A, Scragg A, hales S. Increase in Chlorella strains calorific values when grown in low nitrogen medium[J]. Enzyme and microbial technology, 2000, 27(8): 631-635.
[5] Li Y, Han F, Xu H, et al. Potential lipid accumulation and growth characteristic of the green alga Chlorella with combination cultivation mode of nitrogen (N) and phosphorus (P). [J]. Bioresource Technology, 2014, 174(1): 24-32.
[6] 王瑶华, 吴洪喜, 黄振华, 等. 氮磷硅对咖啡双眉藻和缢缩菱形藻繁殖速度和油脂积累的影响[J]. 海洋科学, 2015, 38(4): 48-55. Wang Yaohua, Wu Hongxi, Huang Zhenghua, et al. Influence of nitrogen, phosphorous and silicon on reproduciing rate and lipid accumulation ofand[J]. Marine Sceiences, 2015, 38(4): 48-55.
[7] Reitan K I, Rainuzzo J R, Olsen Y. Effect of nutrient limitation on fatty acid and lipid content of marine microalgaeM1[J]. Journal of Phycology, 1994, 30(6): 972-979.
[8] Rao A R, Dayananda C, Sarada R, et al. Effect of salinity on growth of green alga Botryococcus braunii and its constituents[J]. Bioresource technology, 2007, 98(3): 560-564.
[9] Guschina I A, Harwood J L. Lipids and lipid metabolism in eukaryotic algae[J]. Progress in Lipid Research, 2006, 45(2): 160-186.
[10] Behrenfeld M J, Worthington K, Sherrell R M, et al. Controls on tropical Pacific Ocean productivity revealed through nutrient stress diagnostics[J]. Nature, 2006, 442(7106): 1025-1028.
[11] Liu Z Y, Wang G C, Zhou B C. Effect of iron on growth and lipid accumulation in Chlorella vulgaris[J]. Bioresource Technology, 2008, 99(11): 4717-4722.
[12] 蒋瑜, 严小军, 朱鹏, 等. Fe3+胁迫对假微型海链藻中性脂累积及DGAT表达的影响[J]. 海洋科学, 2013, 36(3): 87-94. Jiang Yu, Yan Xiaojun, Zhu Peng, et al. Influence of iron stress on neural lipid accumulation and DGAT expression in[J]. Marine Sciences, 2013, 36(3): 87-94.
[13] Concas A, Steriti A, Pisu M, et al. Comprehensive modeling and investigation of the effect of iron on the growth rate and lipid accumulation of Chlorella vulgaris cultured in batch photobioreactors[J]. Bioresource Technology, 2014, 153: 340-350.
[14] Ruangsomboon S. Effect of light, nutrient, cultivation time and salinity on lipid production of newly isolated strain of the green microalga, Botryococcus braunii KMITL 2[J]. Bioresource Technology, 2012. 109(1): 261-265.
[15] Ruangsomboon S, Ganmanee M, Choochote S. Effects of different nitrogen, phosphorus, and iron concentrations and salinity on lipid production in newly isolated strain of the tropical green microalga, Scenedesmus dimorphus KMITL[J]. Journal of Applied Phycology, 2013, 25(3): 867-874.
[16] Najafabadi H A, Malekzadeh M, Jalilian F, et al. Effect of various carbon sources on biomass and lipid production of Chlorella vulgaris during nutrient sufficient and nitrogen starvation conditions[J]. Bioresource Technology, 2015, 180: 311-317.
[17] Rai M P, Nigam S, Sharma R. Response of growth and fatty acid compositions of Chlorella pyrenoidosa under mixotrophic cultivation with acetate and glycerol for bioenergy application[J]. Biomass & Bioenergy, 2013, 58: 251-257.
[18] Stanier R, Kunisawa R, Mandel M, et al. Purification and properties of unicellular blue-green algae (order Chroococcales)[J]. Bacteriological Reviews, 1971, 35(2): 171.
[19] Fowler S D, Brown W J, Warfel J, et al. Use of nile red for the rapid in situ quantitation of lipids on thin-layer chromatograms[J]. Journal of Lipid Research, 1987, 28(10): 1225-1232.
[20] 刘志媛. 铁对几种不同代谢类型微藻的生长和油脂积累的影响[D]. 青岛: 中国科学院海洋研究所, 2008. Liu Zhiyuan, Effect of iron on growth and lipid accumulation in several microalgae with different metabolic type[D]. Qingdao: Insititute of Oceanology, Chinese Academy of Sciences. 2008.
[21] Wang S B, Hu Q, Sommerfeld M, et al. An optimized protocol for isolation of soluble proteins from microalgae for two-dimensional gel electrophoresis analysis[J]. Journal of Applied Phycology, 2003, 15(6): 485-496.
[22] 顾文辉. 积累类胡萝卜素的绿藻类囊体膜蛋白组学研究[D]. 青岛: 中国科学院海洋研究所, 2014. Gu Wenhui. Quantitative proteomics of thylakoid membranes in carotenoids accumulating Chlorophytes[D]. Qingdao: Insititute of Oceanology, Chinese Academy of Sciences, 2014.
[23] Geider R J, La Roche J. The role of iron in phytoplankton photosynthesis, and the potential for iron-limitation of primary productivity in the sea[J]. Photosynthesis Research, 1994, 39(3): 275-301.
[24] Straus N A. Iron Deprivation: Physiology and Gene Regulation, in[M]. Rryan D B. Springer Netherlands: Dordrecht, 1994: 731-750.
[25] Singh A K, McIntyre L M, Sherman L A. Microarray analysis of the genome-wide response to iron deficiencyand iron reconstitution in the cyanobacteriumsp.[J]. PCC 6803. Plant Physiology, 2003, 132(4): 1825-1839.
[26] Salisbury F, Ross C. Plant physiology[M]. Wadsworth: Wadsworth Publishing Company Inc, 1978.
[27] 邹春琴, 张福锁, 毛达如. 铁对玉米体内氮代谢的影响[J]. 中国农业大学学报, 1998, 5: 45-49. Zou Chunqin, Zhang Fusuo, Mao Daru. Effect of iron supply on nitrogen metabolism of corn[J]. Journal of China Agricultural University, 1998, 5: 45-49.
[28] Yoshikawa M, Yang G, Kawaguchi K, et al. Expression analyses of β-tubulin isotype genes in rice[J]. Plant and Cell Physiology, 2003, 44(11): 1202-1207.
[29] Heredia-Arroyo T, Wei W, Ruan R, et alMixotrophic cultivation of Chlorella vulgaris and its potential application for the oil accumulation from non-sugar materials[J]. Biomass and Bioenergy, 2011, 35(5): 2245-2253.
[30] Winder T L, Nishio J N. Early iron deficiency stress response in leaves of sugar beet[J]. Plant Physiology, 1995, 108(4): 1487-1494.
[31] Kampfenkel K, Van Montagu M, Inzé D. Effects of iron excess onplants (implications to oxidative stress)[J]. Plant Physiology, 1995, 107(3): 725-735.
[32] Gallego S M, Benavides M P, Tomaro M L. Effect of heavy metal ion excess on sunflower leaves: evidence for involvement of oxidative stress[J]. Plant Science, 1996, 121(2): 151-159.
[33] Asada K. Ascorbate peroxidase–a hydrogen peroxide- scavenging enzyme in plants[J]. Physiologia Plantarum, 1992, 85(2): 235-241.
[34] Marsh J H, Evans H, Matrone G. Investigations of the role of iron in chlorophyll metabolism. I. Effect of iron deficiency on chlorophyll synthesis I[J]. Plant Physiology, 1963, 38(6): 638.
(本文编辑: 梁德海)
Proteomic analysis of mixotrophic cultivation ofexposed to different iron concentrations
LIU Cai-xia1, 2, GU Wen-hui1, HUANG Ai-you1, 3, WU Song-cui1, 2, ZHANG Bao-yu1, WANG Guang-ce1
(1. Key Laboratory of Experimental Marine Biology, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China; 3.Nantong Branch, Institute of Oceanology, Chinese, Academy of Sciences, Nantong 226006, China)
Here, we investigated the effect of different iron concentrations on the growth rate and lipid content of autotrophic and mixotrophic cultivations of. Differential expression of proteins in mixotrophicexposed to different iron concentrations was analyzed. The results showed that mixotrophic cultivation demonstrated a faster growth rate and improved biomass than autotrophic cultivation. Iron deficiency may result in an increase in the lipid content. Proteomics analysis showed that the concentration of iron-containing proteins involved in photosynthesis was low in an iron-deficient culture condition. Hot shock proteins as well as proteins involved in translation and glycolysis were downregulated under both low and high iron concentrations, indicating that these growth conditions were stressful for. The concentration of proteins involved in amino acid metabolism increased under iron-deficient conditions, possibly due to downregulation of NO3−assimilation and amino acid synthesis. These results showed that both the growth rate and lipid content in mixotrophicwere higher under iron-deficient conditions. The growth ofwas accelerated under conditions of high iron concentrations, without affecting its lipid content. These results imply that high iron concentrations lead to a stress effect on the cells of.
; mixotrophic; acetate; Fe3+; proteomics
Jun. 11, 2016
[International S & T Cooperation Program of China (2015DFG32160), Ministry of Science and Technology of PRC fundamental research work (2012FY112900-01); Nantong Science and Technology Planning Project 2014 (AS2014007); Postdoctoral Innovation Project Special Funds of Shandong Province (2014)]
Q949.21
A
1000-3096(2017)03-0001-07
10.11759/hykx20160330001
2016-06-11;
2016-10-03-08
科技部国际合作专项(2015DFG32160); 科技部国家科技基础性工作专项(2012FY112900-01); 南通市2014年科技计划项目(AS2014007); 山东省博士后创新计划项目(2014)
刘彩霞(1989-), 女, 山东青岛人, 硕士研究生, 从事藻类分子生理学与发育调控研究, 电话: 0523-82898575, E-mail: caixliu@126.com; 张宝玉, 通信作者, 副研究员, 电话: 0532-82898923, E-mail: by-zhang@163.com; 王广策, 通信作者, 研究员, 电话: 0532-82898574, E-mail: gcwang@qdio.ac.cn
