热锻炼对龙须菜高温胁迫响应的影响
2017-07-07隋正红李秉钧郭振义鞠晓丹
付 峰, 隋正红, 李秉钧, 郭振义, 鞠晓丹
(1. 烟台大学 海洋学院, 山东 烟台 264005; 2. 中国海洋大学 海洋生命学院, 山东 青岛 266003)
热锻炼对龙须菜高温胁迫响应的影响
付 峰1, 隋正红2, 李秉钧1, 郭振义1, 鞠晓丹1
(1. 烟台大学 海洋学院, 山东 烟台 264005; 2. 中国海洋大学 海洋生命学院, 山东 青岛 266003)
夏季高温是限制龙须菜(Gracilariopsis lemaneiformis)生长和发育的一个主要问题。本研究以野生龙须菜作为材料, 经过28℃的热锻炼预处理72 h, 再分别置于32、36、40℃高温胁迫24 h, 并测定了高温胁迫条件下龙须菜的丙二醛(MDA)、过氧化氢(H2O2)和可溶性蛋白质的含量, 以及超氧化物歧化酶(SOD)活性和抗坏血酸(AsA)水平等生理指标, 研究了龙须菜对高温胁迫的响应。结果表明: 热锻炼能维持藻体较低的MDA含量, 降低H2O2的产生速率, 缓解藻体的膜脂过氧化伤害; 同时热锻炼缓解了可溶性蛋白质的降解, 增加了SOD酶的比活力, 缓解了AsA的下降速率, 说明热锻炼能缓解高温胁迫对藻体的伤害, 有效地提高了龙须菜对高温胁迫响应的能力。
龙须菜(Gracilariopsis lemaneiformis); 高温胁迫; 热锻炼
龙须菜(Gracilariopsis lemaneiformis)是一种主要的产琼胶海藻, 目前广泛栽培在辽宁、山东、浙江、福建、广东等地[1], 具有重要的经济价值。但是在夏季水温较高时, 藻体会出现变白, 甚至溃烂[2], 严重影响龙须菜的栽培及其产量。因此, 研究高温胁迫下龙须菜的生理响应, 对于提高其耐热性具有重要的意义。
植物体经温和的或亚致死高温的预处理后可以产生耐热性, 这种预处理即为热锻炼或热驯化[3-4]。对于高等植物的许多研究表明[5-7], 热锻炼可以诱导植物获得耐热性, 提高其抵御高温胁迫的能力。热锻炼在藻类中的研究不多, 目前对集胞藻Synechocystis sp. PCC6803的研究发现, 热锻炼对其光合系统耐受环境温度的变化非常重要[8]。对海带(Laminaria japonica)的研究也显示, 热锻炼预处理可以有效减轻海带叶片的氧化损伤, 提高其耐热性, 推测热锻炼获得的耐热性可能与体内水杨酸含量的提高有关[9]。丁柳丽等[10]发现在高温胁迫过程中, 高温(24℃)生长的龙须菜比正常温度(20℃)生长的龙须菜光合作用系统表现出更突出的耐热性能。
本研究以野生型龙须菜为材料, 对其进行28℃热锻炼72 h预处理后, 分别置于32、36和40℃的高温胁迫24 h, 以不经热锻炼组为对照, 研究热锻炼和不同温度的高温胁迫对龙须菜体内各项生理指标的影响, 以期为深入了解热锻炼对提高龙须菜耐高温机制提供理论基础。
1 材料与方法
1.1 实验材料
选用采自青岛湛山湾的野生龙须菜, 样品采集后除去表面杂藻后置于常温25℃光照培养箱中培养, 光强2 500 lx, 光周期12 h︰12 h, 每周更换新鲜的f/2培养液。
1.2 实验设计
将常温(25)℃培养的龙须菜, 取适量置于500 mL三角烧瓶中, 加入含有f/2的灭菌海水。热锻炼组设置为, 藻体在28℃的培养箱中热锻炼72 h, 然后分别再置于32、36和40℃培养箱中进行高温胁迫; 不经热锻炼的对照组藻体在25℃的培养箱中培养72 h, 然后与热锻炼的藻体一起置于32、36和40℃培养箱, 进行高温胁迫, 均设置为光强2 500 lx, 光周期12 L︰12 D。24 h后, 取胁迫后藻体进行各生理指标的测定, 每个胁迫条件设置3个平行。
1.3 实验方法
1.3.1 丙二醛(MDA)含量的测定
参考高俊凤等[11]的方法。称取0.2 g鲜质量龙须菜, 液氮研磨, 加入4 mL的磷酸钠缓冲液(0.05 mol/L, pH 7.8), 混匀后转移到离心管中。加入4 mL 0.5%的硫代巴比妥酸溶液充分摇匀, 沸水浴10 min, 冷却后于4℃、12 000 r/min离心15 min, 取上清, 测450、532和600 nm处的吸光值。MDA含量计算如下: MDA(μmol/g WF)= [6.45×(A652–A600)–0.56×A450] × Vt/ (1 000×WF), 其中, Vt: 上清的体积(mL); WF: 样品鲜质量(g)。
1.3.2 过氧化氢(H2O2)含量的测定
参考Sergiev等的方法[12]。称取0.2 g鲜质量龙须菜, 液氮研磨, 加入0.1%的三氯乙酸3 mL, 混匀后转移到离心管中, 4 1℃2 000 r/min离心15 min。取1 mL的上清液, 加入1 mL的0.1 mol/L的磷酸钾缓冲液(pH7.0)和2 mL的1 mol/L的碘化钾溶液, 黑暗静置1 h后, 测定A390, 并通过标准曲线查得过氧化氢物质的量。H2O2含量(nmol/g)= n×V /(Vs×WF), 其中n为标准曲线查得的溶液中过氧化氢物质的量(nmol); V为样品提取液总体积(mL); Vs为吸取样品液总体积(mL); WF为样品鲜质量(g)。
1.3.3 可溶性蛋白质含量的测定
参考高俊凤[11]的方法。称取0.2 g鲜质量龙须菜,液氮研磨, 加入4 mL的0.05 mol/L的磷酸钠缓冲液(pH 7.8), 将匀浆转移到试管中, 于4 1℃2 000 r/min离心15 min, 收集上清液。吸取1 mL提取液, 加入考马斯亮蓝溶液5 mL, 混匀, 放置20 min, 在595 nm处测吸光值, 并通过标准曲线查得蛋白质含量。可溶性蛋白质质量比(mg/g)= C×VT/(1 000V1×WF), 其中C为查得的标准曲线值(μg); VT为提取液体积(mL); V1为测定时加样量(mL); WF为样品鲜质量(g)。
1.3.4 超氧化物歧化酶(SOD)比活力的测定
参考高俊凤的方法[11]。称取0.2 g鲜质量龙须菜,液氮研磨, 加入4 mL的0.5 mol/L pH7.8的磷酸钠缓冲液, 将匀浆转移到试管中, 于4 1℃2 000 r/min离心15 min, 收集上清液。依次加入50 mmol/L 磷酸缓冲液(pH 7.8)3 mL, 130 mmol/L 的甲硫氨酸 600 μL, 0.75 mmol/L 氮蓝四唑(NBT) 600 μL, 0.1 mmol/L的EDTA·Na2600 μL和 0.02 mmol/L 核黄素 600 μL,置于35°C, 光照强度为 2 500 lx。显色 20 min。反应结束后立即用遮光布完全遮盖试管, 终止反应。测定反应液560 nm处吸光值。SOD总活力(U/g)= (A0–As)×Vt/(0.5A0×WF×V1), SOD比活力(U/mg)=SOD活力/总蛋白含量。其中A0为无酶反应液吸光值; As为待测样品的吸光值; Vt为提取液总体积(mL); V1为测定时吸取的提取液体积(mL); WF为样品鲜质量(g)。
1.3.5 抗坏血酸(AsA)含量的测定
参考刘泳的方法[13]。取0.2 g鲜质量龙须菜, 液氮研磨, 加入4 mL 5%的偏磷酸, 转移到试管中, 12 000 r/min下离心10 min。取上清液1 mL, 分别加入75 mmol/L的磷酸钠缓冲液(pH 7.4)0.8 mL, 10%的偏磷酸0.8 mL, 44%的磷酸0.8 mL, 4%的二联吡啶0.8 mL和3%的氯化铁0.4 mL, 测525 nm处吸光值, 根据标准曲线查得抗坏血酸物质的量(nmol)。抗坏血酸含量(nmol/g)= V×n /(Vt×WF), 其中n为抗坏血酸物质的量(nmol); Vt为所用样品提取液体积(mL); V为样品提取液总体积(mL); WF为样品鲜质量(g)。
1.3.6 数据分析方法
所有数据运用EXCEL和SPSS 20.0进行统计和方差分析, 采用最小显著差数(LSD)法比较差异显著性, 以P<0.05为差异显著。
2 结果与分析
2.1 热锻炼对龙须菜藻体膜脂过氧化和过氧化氢含量的影响
高温胁迫下, 龙须菜体内丙二醛(MDA)含量增加, 随着胁迫温度的升高MDA含量升高。高温胁迫下, 热锻炼处理组的MDA水平显著低于未经热锻炼处理组(P<0.05)。经热锻炼的藻体在40℃高温胁迫下, MDA含量比初始上升了140.03%, 而未经热锻炼组含量上升了169.72%, 表明热锻炼能有效缓解藻体膜脂过氧化的程度, 提高藻体抵抗高温的能力。
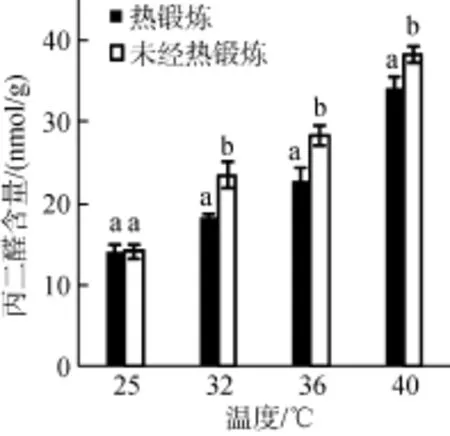
图1 热锻炼对高温胁迫下龙须菜丙二醛含量的影响Fig. 1 Effects of heat acclimation pretreatment on MDA contents in Gracilaria lemaneiformis under heat stress. Two samples within the same treatment condition sharing a common letter were not significantly different, whereas在同一处理温度内, 相同的字母表示差异不显著, 不同字母表示差异显著(P<0.05), 下同those with different letters were significantly different at P < 0.05, the same below

图2 热锻炼对高温胁迫下龙须菜过氧化氢含量的影响Fig. 2 Effects of heat acclimation pretreatment on hydrogen peroxide contents in Gracilaria lemaneiformis under heat stress
高温胁迫下, 龙须菜体内H2O2的含量出现明显的积累。经热锻炼的藻体, 高温胁迫下体内H2O2含量低于未经热锻炼的, 而且差异极显著(P<0.01)。经热锻炼的藻体在40℃胁迫下, H2O2含量比初始上升了642.43%, 而未经热锻炼组含量上升了857.31%,表明热锻炼能有效减少藻体过氧化氢的产生, 避免过量活性氧带来的伤害, 提高藻体抵抗高温的能力。
2.2 热锻炼对龙须菜藻体可溶性蛋白质含量和SOD比活力的影响
实验结果表明, 高温胁迫24 h后, 藻体内可溶性蛋白质含量降低, 但是热锻炼组的可溶性蛋白质含量始终高于未经热锻炼组。在40℃高温胁迫24 h后, 经热锻炼的藻体内可溶性蛋白质含量比初始降低了75.92%, 未经热锻炼组降低了88.48%, 二者差异极显著(P<0.01)。
实验结果表明, 高温胁迫下龙须菜体内SOD比活力升高, 随胁迫温度升高, SOD比活力增加, 热锻炼处理组保持较高的SOD比活力, 而且在高温胁迫下, 显著高于未经热锻炼处理组(P<0.01)。表明热锻炼能够有效提高SOD酶的比活力, 清除活性氧带来的伤害, 提高藻体的耐高温能力。

图3 热锻炼对高温胁迫下龙须菜可溶性蛋白质含量的影响Fig. 3 Effects of heat acclimation pretreatment on soluble protein contents in Gracilaria lemaneiformis under heat stress
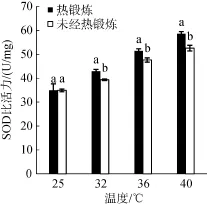
图4 热锻炼对高温胁迫下龙须菜SOD比活力的影响Fig. 4 Effects of heat acclimation pretreatment on the specific activity of SOD in Gracilaria lemaneiformis under heat stress
2.3 热锻炼对龙须菜藻体抗坏血酸含量的影响
实验结果表明, 高温胁迫下龙须菜体内抗坏血酸(AsA)含量下降, 随胁迫温度升高AsA含量呈下降趋势。在高温胁迫下, 热锻炼处理组的AsA含量下降幅度低于未经热锻炼处理组, 差异极显著(P<0.01),经热锻炼的藻体在40℃胁迫下, AsA含量比初始下降了87.46%, 而未经热锻炼组下降了94.72%。

图5 热锻炼对高温胁迫下龙须菜抗坏血酸含量的影响Fig. 5 Effects of heat acclimation pretreatment on the AsA content in Gracilaria lemaneiformis under heat stress
3 讨论
通常高于环境温度10~15℃的温度的快速升高称为热休克或者热胁迫[14]。野生龙须菜生长的最适温度在12~23℃, 根据前期的预实验结果, 同时为了保证藻体的存活, 热胁迫温度设置为32、36和40℃共3个温度, 处理时间为24 h。对高等植物的研究显示, 一定程度的热锻炼能够有效提高植物的耐高温性, 不同的研究者针对不同的物种选择的热锻炼方式不同[3], 本实验中设置热锻炼温度为28℃, 时间为72 h。本实验结果显示, 28℃热锻炼时间72 h可以有效诱导龙须菜的获得耐热性, 可以为后期龙须菜热锻炼的研究提供相应参考。
高温胁迫能够引起细胞膜脂过氧化, 加剧细胞膜受伤害的程度, 而丙二醛是膜脂过氧化的主要产物,是衡量高温下细胞膜受伤害程度的重要指标[15-16]。本研究结果显示, 高温胁迫导致龙须菜体内MDA含量增加, 胁迫温度越高对藻体细胞膜的伤害越严重,表现为MDA的含量越高, 这与孙雪等[17]对高温胁迫下龙须菜的研究结果一致。Sairam等[18]对温度敏感性不同的3种小麦进行高温胁迫, 结果显示耐高温的种类在高温胁迫下的MDA含量较低。本研究中,经热锻炼预处理的龙须菜在高温胁迫下藻体内MDA的含量显著低于未经热锻炼的, 说明经过热锻炼预处理的藻体膜脂过氧化程度较轻, 热锻炼能够通过缓解高温胁迫对藻体细胞膜的伤害提高藻体的耐高温能力。
高温胁迫下植物体内的氧化还原代谢平衡会被打破, 导致体内活性氧的大量积累[19-20]。H2O2是活性氧的一种, 高温胁迫下会产生过量的H2O2, 加剧植物细胞的氧化胁迫[21]。本研究显示, 随胁迫温度的升高, 龙须菜体内H2O2的含量极显著增加, 其中经热锻炼龙须菜在高温胁迫下藻体内H2O2的增加量有所缓解, 说明热锻炼能够有效提高藻体抗氧化能力,这与对高等植物热锻炼的研究结果相似。Dat等[22]研究显示热锻炼能诱导芥菜产生耐热性, 组织中的H2O2含量明显降低。Xu等[16]对两种耐热性不同的冷季型草坪草的研究显示, 高温胁迫下两种草叶内H2O2都有明显的累积, 在热锻炼的草叶中累积的水平较低, 而且经过热锻炼的敏感型的草坪草叶中的H2O2含量高于较耐热种类。
细胞内可溶性总蛋白在植物抵御高温胁迫的过程中发挥着重要的作用。本研究显示, 高温胁迫下可溶性蛋白质含量下降, 说明高温胁迫会导致可溶性蛋白的降解[23], 而且高温能影响细胞内各种酶的活性, 抑制蛋白质的正常合成, 也可能是导致高温时藻体可溶性蛋白质含量降低的原因[24]。本研究中热锻炼处理组可溶性蛋白质含量略高于未经热锻炼组,推测在高温胁迫下藻体会发生应激反应, 产生大量的热激蛋白[25], 参与藻体内蛋白质的运输、折叠, 保护蛋白质不被降解, 维持正常的细胞代谢, 热锻炼通过增加热激蛋白含量缓解了高温对藻体的伤害。
SOD是普遍存在的一种含金属辅基的酶, 是藻体抗氧化防御系统中应对高温胁迫的关键酶, 它能催化超氧阴离子自由基(O2–)的歧化反应, 生成H2O2和O2[26], 其他抗氧化酶类通过与SOD的协同作用,共同防御活性氧对细胞生物大分子的破坏[27]。张元等[28]对高温胁迫下坛紫菜叶状体的研究也显示, SOD酶比活力随着胁迫时间的延长而逐渐升高, 认为SOD活性受O2–诱导极显著提高。本实验结果显示, 高温胁迫下, SOD比活力升高, 并且胁迫温度越高, SOD比活力越高, 推测SOD活力在整个胁迫过程中持续增强[27]。实验结果显示经过热锻炼处理的藻体SOD比活力明显高于未经热锻炼的藻体, 说明热锻炼处理的藻体维持了较高的SOD比活力, 能够有效提高自身对活性氧等有害物质的清除能力, 延缓高温胁迫对藻体细胞的抗氧化损伤[6-7]。
植物抗氧化防御系统包括酶促抗氧化系统和非酶促抗氧化系统, AsA是植物体非酶促抗氧化系统的主要组成部分[29], 是清除活性氧的重要抗氧化剂,在抵御高温胁迫方面具有非常重要的作用[30]。徐伟君[31]研究发现, 高温胁迫下黄瓜幼苗AsA含量降低明显, 其相对降低量与黄瓜耐高温能力呈负相关关系。Wang等[32]研究显示, 随着高温胁迫时间的延长,葡萄叶片ASA含量急剧下降, 经热锻炼叶片的ASA含量始终高于未经热锻炼组。刘泳[13]对海带的研究发现, 耐热性相对较差的品种RC随高温胁迫时间的延长体内AsA含量呈现下降趋势, 耐热性较强的品种901变化趋势相反, 推测这种变化差异是由于耐热性强的品种自身AsA合成酶的较强稳定性所致。本实验结果显示, 高温胁迫下, AsA的含量下降, 而且胁迫温度越高, AsA含量越低, 这可能是由于一方面高温胁迫下AsA作为抗氧化剂参与自由基清除反应时部分被氧化, 另一方面是AsA的合成受到了高温胁迫的抑制[7,33]; 热锻炼藻体的AsA含量下降幅度显著低于未经热锻炼的, 表明热锻炼可以减缓藻体内AsA含量的降低, 提高藻体抵御高温胁迫的能力。
综上所述, 热锻炼可以缓解藻体的膜脂过氧化伤害, 降低藻体活性氧(H2O2)的产生速率, 维持较高的可溶性蛋白质含量, 提高SOD的比活力, 缓解抗氧化物质AsA的下降速率, 来降低高温胁迫对龙须菜藻体的氧化伤害, 提高藻体的抵御高温胁迫的能力。目前, 热锻炼对提高藻体耐高温性的研究主要集中在生理响应方面, 近些年随着分子生物学技术的发展, 还有待于在转录组、蛋白质组或者代谢组等方面的深入研究, 以期进一步揭示藻类对高温胁迫的响应机制, 为藻类的耐高温育种提供科学基础。
[1] 张学成, 费修绠, 王广策, 等. 江蓠属海藻龙须菜的基础研究与大规模栽培[J]. 中国海洋大学学报, 2009, 39(5): 947-954. Zhang Xuecheng, Fei Xiugeng, Wang Guangce, et al. Genetic Studies and Large Scale Cultivation of Gracilaria lemaneiformis[J]. Periodical of Ocean University of China, 2009, 39(5): 947-954.
[2] 付峰, 隋正红, 常连鹏, 等. 龙须菜果孢子的紫外诱变及优势突变体的筛选[J]. 中国海洋大学学报, 2014, 44(3): 50-56. Fu Feng, Sui Zhenghong, Chang Lianpeng, et al. UV-irradiation mutation on carpospores of Gracilariopsis lemaneiformis and screening of thermo-tolerant strains[J]. Periodical of Ocean University of China, 2014, 44(3): 50-56.
[3] Yeh C H, Kaplinsky N J, Hu C, et al. Some like it hot, some like it warm: Phenotyping to explore thermotolerance Diversity [J]. Plant Science, 2012, 195: 10-23.
[4] 陈思婷, 郭房庆. 植物耐热性及热激信号转导机制研究进展[J]. 中国科学: 生命科学, 2013, 43(12): 1072-1081. Chen Siting, Guo Fangqing. Heat stress tolerance and signaling in plants [J]. Scientia Sinica Vitae, 2013, 43(12): 1072-1081.
[5] Larkindale J, Vierling E. Core genome responses involved in acclimation to high temperature[J]. Plant Physiol, 2008, 146: 748-761.
[6] 何亚丽, 刘友良, 陈权, 等. 水杨酸和热锻炼诱导的高羊茅幼苗的耐热性与抗氧化的关系[J]. 植物生理与分子生物学学报, 2002, 28(2): 89-95. He Yali, Liu Youliang, Chen Quan, et al. Thermotolerance related to antioxidation induced by salicylic acid and heat hardening in tall fescue seedlings[J]. Journal of Plant Physiology and Molecular Biology, 2002, 28(2): 89-95.
[7] 徐胜, 何兴元, 陈玮, 等. 热锻炼对高羊茅(Festuca arundinacea)和多年生黑麦草(Lolium perenne)高温能力的影响[J]. 生态学报, 2008, 28(1): 162-171. Xu Sheng, He Xingyuan, Chen Wei, et al. Effects of heat acclimation on high-temperature stress resistance and heat-tolerance mechanism of Festuca arundinacea and Lolium perenne [J]. Acta Ecologica Sinica, 2008, 28(1): 162-171.
[8] Rowland J G, Pang X, Suzuki I, et al. Identification of components associated with thermal acclimation of photosystem Ⅱ in Synechocystis sp. PCC6803[J]. PLoS One, 2010, 5(5): e10511.
[9] Zhou B, Tang X X, Wang Y. Salicylic acid and heat acclimation pretreatment protects Laminaria japonica sporophyte (Phaeophyceae) from heat stress[J]. Chinese Journal of Oceanology and Limnology, 2010, 28(4): 924-932.
[10] 丁柳丽, 邹定辉, 刘露, 等. 气候变化对海藻龙须菜生长与光合作用耐热特性的影响[J]. 生态学报, 2015, 35(10): 3267-3277. Ding Liuli, Zou Dinghu, Liu Lu, et al. Effect of climate change on the growth and photosynthetic thermal tolerance in the marine macroalga Gracilaria lemaneiformis[J]. Acta Ecologica Sinica, 2015, 35(10): 3267-3277.
[11] 高俊凤. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2006. Gao Junfeng. Experimental Guide for Plant Physiology[M]. Beijing: Higher Education Press, 2006.
[12] Sergiev I, Alexieva V, Karanov E. Effect of spermine, atrazine and combination between them on some endogenous protective systems and stress markers in plants[J]. Compt Rend Acad Bulg Sci, 1997, 51: 121-124.
[13] 刘泳. 高温胁迫对海带生长的影响及其作用机理的初步探讨[D]. 青岛: 中国海洋大学, 2004. Liu Yong. The effeets of heat stress on the growth of Laminaria japonica and the Preliminary study on the effective meehanism[D]. Qingdao: Ocean University of China, 2004.
[14] Wahid A, Gelani S, Ashraf M, et al. Heat tolerance in plants: An overview[J]. Environment and Experimental Botany, 2007, 61: 199-223.
[15] Liu X Z, Huang B R. Heat stress injury in relation to membrane lipid peroxidation in creeping bentgrass [J]. Crop Science, 2000, 40(2): 503-510.
[16] Xu S, Li J L, Zhang X Q, et al. Effects of heat acclimation pretreatment on changes of membrane lipid peroxidation, antioxidant metabolites, and ultrastructure of chloroplasts in two cool-season turfgrass species under heat stress[J]. Environment and Experimental Botany, 2006, 56: 274-285.
[17] 孙雪, 蔡西栗, 徐年军. 海洋红藻龙须菜对2种逆境温度胁迫的应激生理响应[J]. 水生生物学报, 2013, 37(3): 535-540. Sun Xue, Cai Xili, Xu Nianjun. Physiological response of marine red algae Gracilaria lemaneiformis to two kinds of adverse temperature stress[J]. Acta Hydrobiologica Sinica, 2013, 37(3): 535-540.
[18] Sairam R K, Srivastava G C, Saxena D C. Increasedantioxidant activity under elevated temperatures: A mechanism of heat stress tolerance in wheat genotypes [J]. Biologia Plantarum, 2000, 43(2): 245-251.
[19] Mallick N, Mohn F H. Reactive oxygen species: response of algal cells [J]. Journal of Plant Physiology, 2000, 157(2): 183-193.
[20] Gill S S, Tuteja N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J]. Plant Physiology and Biochemistry, 2010, 48: 909-930.
[21] Anderson J A. Catalase activity, hydrogen peroxide content and thermotolerance of pepper leaves[J]. Scientia Horticulturae, 2002, 95(4): 277-284.
[22] Dat J F, Lopez-Delgado H, Foyer C H, et al. Parallel changes in H2O2and catalase during thermotolerance induced by salicylic acid or heat acclimation in mustard seedlings[J]. Plant Physiol, 1998, 116(4): 1351-1357.
[23] 周人纲, 樊志和, 李晓芝, 等. 热锻炼对小麦叶片细胞膜及有关酶活性的影响[J]. 作物学报, 1995, 21(5): 568-572. Zhou Rengang, Fan Zhihe, Li Xiaozhi, et al. The effect of heat acclimation on membrane thermostability and relative enzyme activity [J]. Acta Agronomica Sinaca, 1995, 21(5): 568-572.
[24] 凌晶宇, 梁洲瑞, 王飞久, 等. 温度胁迫对掌状海带幼苗生长、抗氧化系统及叶绿素荧光的影响[J]. 海洋科学, 2015, 39(12): 39-45. Ling Jingyu, Liang Zhourui, Wang Feijiu, et al. Effects of temperature stress on the growth, antioxidant system, and chlorophyll fluorescence of Laminaria digitata [J]. Marine Sciences, 2015, 39(12): 39-45.
[25] Kotak S, Larkindale J, Lee U, et al. Complexity of the heat stress response in plants[J]. Current Opinion in Plant Biology, 2007, 10: 310-316.
[26] Lu N, Zang X N, Zhang X C, et al. Gene Cloning, Expression and Activity Analysis of Manganese Superoxide Dismutase from Two Strains of Gracilaria lemaneiformis (Gracilariaceae, Rhodophyta) under Heat Stress[J]. Molecules, 2012, 17: 4522-4532.
[27] 鹿宁, 臧晓南, 张学成, 等. 高温胁迫下不同龙须菜品系抗氧化能力的比较[J]. 武汉大学学报(理学版), 2010, 56(5): 570-577. Lu Ning, Zang Xiaonan, Zhang Xuecheng, et al. Comparison of antioxidant activities of different strains of Gracilaria Leamaneiformis under high-temperature stress[J]. Journal of Wuhan University (Nat Sci Ed), 2010, 56(05): 570-577.
[28] 张元, 谢潮添, 陈昌生, 等. 高温胁迫下坛紫菜叶状体的生理响应[J]. 水产学报, 2011, 35(3): 379-386. Zhang Yuan, Xie Chaotian, Chen Changsheng, et al. Physiological responses of gametophytic blades of Porphyra haitanensis to rising temperature stresses[J]. Journal of Fisheries of China, 2011, 35(3): 379-386.
[29] 臧晓南, 张学成, 张璐, 等. 藻类高温胁迫分子响应的研究进展[J]. 武汉大学学报(理学版), 2008, 54(06): 732-738. Zang Xiaonan, Zhang Xuecheng, Zhang Lu, et al. Review of Molecular Biological Response of Alga to Heat Stress[J]. Journal of Wuhan University (Nat Sci Ed), 2008, 54(6): 732-738.
[30] 孙军利, 赵宝龙, 郁松林. SA对高温胁迫下葡萄幼苗AsA - GSH循环的影响[J]. 核农学报, 2015, 29(4): 799-804. Sun Junli, Zhao Baolong, Yu Songlin. Effects of exogenous salicylic acid (SA) on ascorbate glutathione cycle (AsA-GSH) circulation metabolism in grape seedlings under high temperature stress[J]. Journal of Nuclear Agricultural Sciences, 2015, 29(4): 799-804.
[31] 徐伟君. 高温胁迫对黄瓜幼苗抗坏血酸代谢影响的研究[D]. 西安: 西北农林科技大学, 2007. Xu Weijun. Study on the effects of high temperature on the metabolism of ascorbic acid in cucumber seedlings [D]. Northwest Agriculture and Forestry University, 2007.
[32] Wang L J, Li S H. Thermotolerance and related antioxidant enzyme activities induced by heat acclimation and salicylic acid in grape (Vitis vinifera L.) leaves[J]. Plant Growth Regulation, 2006, 48: 137-144.
[33] 孙艳, 徐伟君. 高温胁迫对不同黄瓜品种幼苗中抗坏血酸代谢的影响[J]. 西北农业学报, 2007, 16(6): 164-169. Sun Yan, Xu Weijun. Effect of High Temperature Stress on the Metabolism of Ascorbic Acid in Cucumber Seedlings [J]. Acta Agriculturae Boreali-occidentalis Sinica, 2007, 16(6): 164-169.
Effects of heat acclimation on high temperature stress response of Gracilariopsis lemaneiformis
FU Feng1, SUI Zheng-hong2, LI Bing-jun1, GUO Zhen-yi1, JU Xiao-dan1
(1. Ocean college, Yantai University, Yantai 264005, China; 2. College of marine life, Ocean University of China, Qingdao 266003, China)
Jul. 21, 2016
Gracilariopsis lemaneiformis; high temperature stress; heat acclimation Abstract: High temperatures in summer are a major problem in the growth and development of Gracilariopsis lemaneiformis. In this study, the wild-type G. lemaneiformis was used as material. After heat acclimation pretreatment at 28°C for 72 h, the algae were placed under conditions of high temperature stress of 32, 36, and 40°C for 24 h. The physiological indices such as MDA, hydrogen peroxide (H2O2) and soluble protein content, superoxide dismutase (SOD) activity, and ascorbic acid (ASA) content in G. lemaneiformis were measured under conditions of high temperature stress to assess the effects of high-temperature stress response of G. lemaneiformis. The results revealed that heat acclimation can maintain low MDA levels, reduce the production rate of active oxygen species (H2O2), and alleviate the damage of cell membrane lipid peroxidation. Furthermore, heat acclimation alleviated the degradation of soluble proteins, improved the specific activity of SOD, and relieved the declining AsA rate, indicating that heat acclimation can amend the harm of high temperatures in the algae and can improve the capacity of G. lemaneiformis to respond to high temperature stress.
S968.43
A
1000-3096(2017)04-0010-07
10.11759/hykx20160505001
(本文编辑: 梁德海)
2016-07-21;
2017-01-15
烟台大学博士启动金项目(HX14B04); 山东省高等学校科技计划项目(J16LE13)
[Foundation: The doctoral scientific research foundation of Yantai University, No.HX14B04; A project of Shandong Province higher educational science and technology program, No.J16LE13]
付峰(1979-), 女, 山东烟台人, 讲师, 博士, 主要从事海藻抗逆研究, 电话: 0535-6706010, E-mail: fufeng@ytu.edu.cn
