肝癌切除术中不同程度低体温对免疫功能影响的临床研究
2017-07-07陈似霞陈冬梅李春兰李小娟杨一兰
陈似霞,陈冬梅,李春兰,李小娟,杨一兰,彭 涛
肝癌切除术中不同程度低体温对免疫功能影响的临床研究
陈似霞,陈冬梅,李春兰,李小娟,杨一兰,彭 涛
[目的]探讨不同程度低体温对肝癌部分切除术病人免疫功能的影响,为手术病人体温护理提供依据。[方法]将160例术中低体温肝癌部分切除术病人按不同低体温分为A组(体温<35.0 ℃,41例)、B组(体温35.0 ℃~35.5 ℃,85例)和C组(体温35.6 ℃~35.9 ℃,34例)。比较3组术前、术后第1天及第5天T细胞亚群及中性粒细胞绝对值(NEU),比较术前、术后第1天及第2天白细胞介素-2(IL-2)、白细胞介素-6(IL-6)水平。[结果]3组病人术后第1天CD3+,CD4+,CD8+,IL-2、IL-6水平及术后第2天IL-2,IL-6水平比较差异具有统计学意义(均P<0.05),A组病人术后第1天CD3+,CD4+水平及IL-2水平低于B组、C组,CD8+水平及IL-6水平高于B组及C组。CD3+,CD4+,CD8+时间效应及交互效应具有统计学意义(均P<0.05);IL-2,IL-6水平组间效应、时间效应及交互效应具有统计学意义(均P<0.05)。[结论]体温<35.0 ℃对病人免疫功能影响较大,肝癌部分切除术病人应加强术中体温保护,避免严重低体温发生,以促进术后康复。
肝癌;术中;低体温;免疫功能;T细胞亚群;中性粒细胞
原发性肝细胞癌(HCC)是我国常见的恶性肿瘤之一,尤其好发于广西地区,以外科手术为主的综合治疗是肝癌的首选治疗方案。机体核心温度<36.0℃为低体温,是外科手术常见的并发症之一[1]。肝脏是机体静息状态下主要的产热器官,肝部分切除直接减少机体产热,同时在麻醉药物作用下体温调节功能异常,术野长时间暴露于低温环境、术中肝门血管通路频繁阻断及大量补液等均使肝癌切除术病人更容易发生术中低体温。免疫抑制是手术对免疫功能影响的主要表现,较多的研究表明:低体温可直接损伤免疫功能,增加创面出血及感染的概率、延长病人住院时间[2-3]。但从低温程度上对病人免疫功能的影响目前鲜有报道,因此,本研究拟探讨不同低温程度对病人免疫功能的影响,为手术病人体温护理提供依据。
1 对象与方法
1.1 研究对象 选择我院肝胆外科2012年6月—2013年8月收治的行肝部分切除术的肝癌病人160例,其中男127例,女33例;年龄24岁~72岁(46.80岁±11.81岁);肿瘤直径5cm~10cm(6.80cm±1.78 cm);手术时间3.0 h~6.8 h(4.42 h±1.30 h)。纳入标准:①术前肝功能Child-Pugh分级均为A级,或B级经术前保肝治疗后转为A级;②术后肝组织病理诊断为肝细胞癌;③美国麻醉师协会(ASA)分级为Ⅰ级~Ⅱ级,采取静吸复合麻醉方式;④术中及术后体温<36.0 ℃。排除标准:①术毕体温≥36.0 ℃者;②近期有发热、感染未控制者;③采用腹腔镜手术者;④有耳道疾病不宜测鼓膜温度者。根据病人术中出现最低程度体温分为A组(体温<35.0 ℃,41例)、B组(体温35.0 ℃~35.5 ℃,85例)、C组(体温35.6 ℃~35.9 ℃,34例)。
1.2 方法
1.2.1 体温测量方法 肺动脉体温是测量体核温度的金标准,但其创伤大且测量方法复杂。鼓膜温度同样可以反映体核温度,因此采用安全、简便的耳温计(倍尔康 ET001)测量鼓膜温度。病人在手术开始切皮至关腹结束后,每30 min测量记录体温1次。
1.2.2 标本采集与检测 于麻醉前、术后第1天、第5天晨取病人外周静脉血4 mL送本院检验科检测,其中2 mL用于检测CD3+、CD4+、CD8+,2 mL用于检测中性粒细胞绝对值(NEU)。麻醉前(术前)、术后第1天、第2天取静脉血2 mL,分离血清后置于-70 ℃冰箱保存,所有病例标本收集结束后采用酶联免疫吸附法(ELISA)双抗体夹心法统一检测白细胞介素-2(IL-2)、白细胞介素-6(IL-6)。ELISA试剂盒购于武汉博士德生物制品有限公司,特异性强,与其他细胞因子无交叉反应。
2 结果
2.1 3组病人一般情况比较(见表1)

表1 3组低体温病人一般情况比较
2.2 3组病人免疫细胞水平比较 3组病人术后第1天CD3+,CD4+,CD8+水平比较差异均具有统计学意义(均P<0.05),进一步两两比较,A组病人术后第1天CD3+,CD4+,CD8+水平与B组、C组比较差异具有统计学意义(均P<0.05),B组与C组比较差异无统计学意义(P>0.05)。重复测量方差分析结果见表3。

表2 3组病人术前、术后免疫细胞含量及NEU计数比较±s)

表3 3组病人免疫细胞重复测量方差分析
2.3 3组病人细胞因子含量比较 3组病人术后第1天及第2天IL-2和IL-6水平比较差异均有统计学意义(均P<0.05);进一步两两比较,A组病人术后第1天、第2天IL-2、IL-6水平与B组、C组比较差异具有统计学意义(均P<0.05),B组与C组比较差异无统计学意义(P>0.05),见表4。重复测量方差分析结果见表5,其组间效应、时间效应、交互效应均具有统计学意义(均P<0.05)。

表4 3组病人细胞因子术前、术后含量比较±s) pg/mL
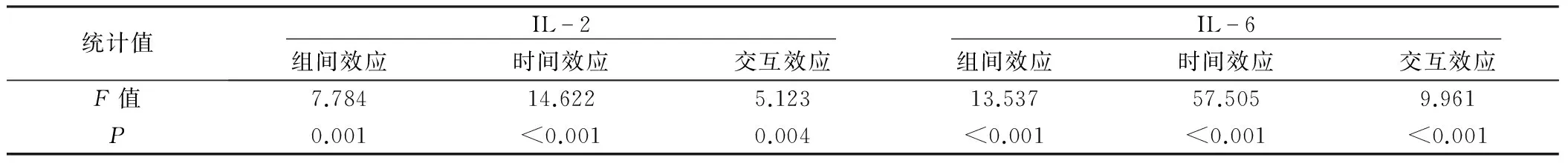
表5 3组病人细胞因子重复测量方差分析
3 讨论
传统意义上的免疫功能主要对机体发挥免疫监视等保护功能,但肿瘤细胞可通过一系列机制逃避宿主细胞的免疫攻击。免疫微环境可直接或间接影响肿瘤的发生发展[4]。影响免疫功能的因素有很多,低体温是其中之一,Gangjun等[5]研究表明:低体温对病人免疫抑制微环境起决定性作用。
3.1 不同程度低体温对病人细胞免疫功能有影响 肝癌病人多有病毒性肝炎背景,病毒性肝炎多存在免疫功能紊乱等状况,常表现为T淋巴细胞亚群比例失调,容易并发严重感染,加重肝功能损害导致病情恶化或死亡[6]。T细胞亚群是评价机体细胞免疫功能的主要指标,在抗肿瘤免疫中发挥重要作用。CD3+T细胞、CD4+T细胞能直接或通过分泌细胞因子杀伤肿瘤细胞,抑制肿瘤生长;而CD8+T细胞包括抑制性T细胞和杀伤性T细胞,具有免疫抑制及杀伤靶细胞作用,不但不能清除肿瘤细胞,反而在肿瘤发生发展过程抑制其他效应细胞的抗肿瘤作用[7-8]。CD3+T细胞、CD4+T细胞数量降低及CD8+T细胞数量升高均提示机体免疫功能处于较低水平。本研究结果显示:A组病人术后第1天CD3+及CD4+水平均低于B组和C组,CD8+水平高于B组及C组,经重复测量方差分析显示,CD3+及CD4+水平的组间效应、时间效应及交互效应均有统计学意义(均P<0.05),但在CD8+水平的重复测量方差分析中,其时间效应及交互效应均有统计学意义(均P<0.05),而组间效应却无统计学意义(P>0.05),这在理论上是难以解释的,可能与样本量有关,在未来研究中应进一步增加样本含量给予证实。因此认为,术中发生低体温病人其T细胞亚群在术后第1天受抑制程度最大,且体温下降程度越大,对T细胞介导的免疫抑制影响也越大。中性粒细胞是机体白细胞重要的组成部分,可以释放多种细胞因子杀伤肿瘤细胞,对肿瘤细胞具有免疫监视作用[9]。低体温主要通过抑制中性粒细胞的氧化杀伤作用抑制免疫功能。在本研究中中性粒细胞的绝对值重复测量方差分析中均无统计学意义,可能与麻醉药物、手术创伤及术后积极应用抗生素等原因有关。
3.2 不同程度低体温对病人细胞因子生成有影响 IL-2是由活化的T细胞产生,通过影响细胞因子有效促进免疫细胞增殖活化,介导免疫应答,参与抗体反应、造血及肿瘤监视,在机体抗肿瘤过程中发挥重要作用[10]。因此,各种原因导致的IL-2水平下降,将降低机体抗肿瘤免疫功能。Steven等[11]研究表明:轻微围术期低体温可通过诱导促炎到抗炎过程来减少IL-2生成。在肿瘤病人中,IL-6主要由肿瘤微环境内的炎性细胞及基质细胞产生[12],能诱导B细胞增殖、分化、产生抗体,调节肝脏急性期蛋白合成,诱导急性期反应[13]。大量研究证实,肝癌病人血清IL-6水平均有显著升高,为独立的肝癌危险因素。在一定程度上,IL-6水平可反映肝癌发生发展、恶性程度及预后[14]。手术创伤会引起机体免疫防御功能下降及炎性反应增强,促炎因子IL-6水平增加是炎性反应增强的体现[15]。本研究结果显示,A组病人术后第1天IL-2,IL-6含量分别与B组及C组比较,差异均有统计学意义(均P<0.05),重复测量方差分析显示其组间效应、时间效应及交互效应亦均有统计学意义(均P<0.05)。说明病人术中低温程度越低,术后IL-2下降水平与IL-6上升水平越明显。此与代永静等[16]研究结果相符。可能与机体内部各种酶的活性与温度依赖性有关,体温越低,酶的活性越容易受到抑制,从而影响细胞正常生理功能,进一步导致肝癌病人免疫功能低下,致使炎症反应增强。
3.3 避免术中严重体低温的发生有利于术后免疫功能恢复 低体温抑制机体免疫功能的机制尚未明确,但有研究表明:围术期保温有利于保护病人免疫功能,促进术后康复[8]。大量体外实验也证明:一定范围内的温度升高对T细胞介导的细胞免疫有明显的促进作用,能加强特异性免疫防御功能[17]。本研究低体温程度最轻的C组病人免疫抑制程度轻于其余两组,术后免疫功能恢复较快。提示:肝癌切除术病人若术中发生不可避免的低体温情况应采取积极保温措施阻止低体温发生。
4 小结
肝癌部分切除术病人术后均存在不同程度的免疫抑制,但术中不同程度的低体温对机体T淋巴细胞亚群及细胞因子可产生不同程度影响,尤其体温<35.0 ℃时,对机体的免疫功能抑制作用显著,体温35.6~35.9 ℃时病人免疫抑制程度较轻,术后免疫功能恢复较快。因此,临床上应重视术中体温的有效管理,避免机体严重低体温的发生,以利于病人术后康复。
[1] 彭顺平,谢艳丽,刘蔚.不同加温液体放置在医用恒温箱内的实际温度调查研究[J].护理研究,2016,30(10A):3572-3573.
[2] Fry DE,Fry RV.Surgical site infection:the host factor[J].Aorn Journal,2007,86(5):801-814.
[3] Horosz B,Malecmilewska M.Inadvertent intraoperative hypothermia[J].Anaesthesiology Intensive Therapy,2013,45(1):38-43.
[4] 张百红,岳红云.免疫微环境促进肿瘤发生发展的机制研究进展[J].现代肿瘤医学,2015,23(6):862-864.
[5] Du Gangjun,Liu Yinghui,Li Jiahuan,etal.Hypothermic microenvironment plays a key role in tumor immune subversion[J].International Immunopharmacology,2013,17(2):245-253.
[6] 李晓云,于晓辉,王维,等.肝细胞肝癌患者外周血中T细胞亚群和NK细胞的变化[J].肝脏,2016,21(5):381-383.
[7] Yuan CH,Sun XM,Zhu CL,etal.Amphiregulin activates regulatory T lymphocytes and suppresses CD8+T cell-mediated anti-tumor response in hepatocellular carcinoma cells[J].Oncotarget,2015,6(31):32138-32153.
[8] 章敏,谢言虎,周玲,等.充气式保温毯联合输液加温对全麻食管癌手术苏醒和免疫功能的影响[J].临床麻醉学杂志,2016,32(4):351-353.
[9] 孙楠.中性粒细胞与肿瘤的研究现状[J].当代医药论丛,2014,12(8):153-155.
[10] 庞婧,邓志华.IL-2在原发性肝癌中的作用及潜在临床应用价值[J].国际肿瘤学杂志,2015,42(12):939-941.
[11] Steven L,Lee MD,Felix D,etal.Hypothermia induces T-cell production of immunosuppressive cytokines[J].Journal of Surgical Research,2001,100(2):150-153.
[12] Bromberg J,Wang TC.Inflammation and cancer:IL-6 and stat 3 complete the link[J].Cancer Cell,2009,15(2):79-80.
[13] Metwaly HA,Al-Gayyar MMH,Eletreby S,etal.Relevance of serum levels of interleukin-6 and syndecan-1 in patients with hepatocellular carcinoma[J].Scientia Pharmaceutica,2011,80(1):179-188.
[14] 郭灵玲,林苏.血清白细胞介素-6与原发性肝细胞癌[J].国际免疫学杂志,2015,38(5):496-500.
[15] Russwurm S,Stonāns I,Schwerter K,etal.Direct influence of mild hypothermia on cytokine expression and release in cultures of human peripheral blood mononuclear cells[J].Journal of Interferon and Cytokine Research,2002,22(2):215-221.
[16] 代永静,王建荣,张明学,等.温热液体对人工关节置换患者术中低体温及术后免疫应激反应的影响[J].护理管理杂志,2010,10(12):845-847.
[17] 曾剑锋.术中低体温与免疫抑制的麻醉管理[C].南昌:江西省第十四次麻醉学学术年会论文汇编,2013:1.
(本文编辑范秋霞)
Clinical research on influence of varying degrees of hypothermia on immune function of patients during hepatectomy
Chen Sixia,Chen Dongmei,Li Chunlan,etal
(The First Affiliated Hospital of Guangxi Medical University, Guangxi 530021 China)
Objective:To probe into the effect of different degrees of hypothermia on immune function of patients with partial hepatectomy,and provide the basis for temperature care of surgical patients.Methods:A total of 160 cases of liver cancer patients with low temperature partial hepatectomy were divided into group A(T<35.0 ℃ 41 cases),group B(T35.0 ℃~35.5 ℃,85 cases) and group C(T35.6 ℃~35.9 ℃,34 cases).T cell subsets and neutrophil absolute value(NEU) were compared among 3 groups before operation and on 1st day and 5th day after operation.The levels of interleukin-2(IL-2) and interleukin-6(IL-6) were compared before operation and on 1st day and 2nd day after operation.Results:There was statistically significant difference in level of CD3+,CD4+,CD8+,IL-2,IL-6 on the 1st d after operation and level of IL-2 and IL-6 on the 2nd day after operation in three groups(allP<0.05).the level of CD3+and CD4+and IL-2 on 1st day after operation in group A were lower than those in group B and C,the level of CD8+and IL-6 were higher than those in group B and C.There was statistically significant difference in time effect and interaction effect of CD3+,CD4+,CD8+(allP<0.05).There was statistically significant difference in intergroup effect,time effect and interaction effect of IL-2 and IL-6 (allP<0.05).Conclusion:T<35.0 ℃ had a great influence on the immune function of patients,patients with partial hepatectomy for liver cancer,the body temperature should be strengthen to prevent severe hypothermia and promote postoperative recovery.
hepatocellular carcinoma;intraoperative;hypothermia;immune function;T lymphocyte subsets;neutrophils
广西区域性高发肿瘤早期防治研究重点实验室资助项目,编号:GK2013-13-A-01-04;广西壮族自治区卫生厅自筹经费科研课题,编号:Z2013078。
陈似霞,副主任护师,本科,单位:530021,广西医科大学第一附属医院;陈冬梅、李春兰、李小娟、杨一兰、彭涛单位:530021,广西医科大学第一附属医院。
信息 陈似霞,陈冬梅,李春兰,等.肝癌切除术中不同程度低体温对免疫功能影响的临床研究[J].护理研究,2017,31(20):2477-2480.
R473.6
A
10.3969/j.issn.1009-6493.2017.20.013
1009-6493(2017)20-2477-04
2016-12-03;
2017-04-18)
