口虾蛄提取物对人肺腺癌耐药细胞株A549/DDP增殖、耐药的影响及机制
2017-07-05邵松军方海燕段玲弟袁国航张湘燕郭兵
邵松军,方海燕,段玲弟,袁国航,张湘燕,郭兵
(1贵州医科大学附属省人民医院,贵阳 550002;2贵州医科大学;3贵州省第二人民医院)
·论著·
口虾蛄提取物对人肺腺癌耐药细胞株A549/DDP增殖、耐药的影响及机制
邵松军1,2,方海燕3,段玲弟2,袁国航1,张湘燕1,郭兵2
(1贵州医科大学附属省人民医院,贵阳 550002;2贵州医科大学;3贵州省第二人民医院)
目的 观察口虾蛄乙酸乙酯提取物(ESO)对人肺腺癌耐药细胞株A549/DDP增殖、耐药的影响,并探讨其机制。方法 选取人肺腺癌耐药细胞株A549/DDP,用不同浓度(0、200、400、800 μg/mL)的ESO干预细胞,24 h后,采用MTT法测算细胞增殖抑制率,流式细胞技术测算细胞周期百分率。采用流式细胞技术观察400 μg/mL ESO干预0、30、60 min细胞内荧光染料罗丹明123(Rh123)蓄积和外排情况。采用Western blotting法检测不同浓度ESO干预24 h后细胞多药耐药蛋白1(MDR1),并检测400 μg/mL ESO干预2、4、8 h后细胞ERK1/2、p-ERK1/2蛋白。结果 200、400、800 μg/mL的ESO干预细胞增殖抑制率分别为19.940%±0.041%、37.360%±0.024%、42.510%±0.008%,两两相比P均<0.01。0、200、400、800 μg/mL ESO干预细胞G2/M期分别为24.06%±2.22%、31.10%±0.79%、35.64%±1.15%、43.19%±0.43%,两两相比P均<0.01。Rh123在ESO干预细胞内积累增多、外排减少,且60 min时较30 min时明显(P均<0.01)。0、200、400、800 μg/mL ESO干预细胞MDR1蛋白相对表达量分别为1.22±0.23、0.83±0.16、0.37±0.09、0.31±0.04,两两相比P均<0.01。ESO干预不同时间A549/DDP细胞ERK1/2蛋白表达无变化,p-ERK1/2蛋白表达上调(P均<0.01)。结论 ESO通过使A549/DDP细胞发生周期阻滞,从而抑制其增殖;通过调节MAPK-ERK1/2信号通路,使其多药耐药发生逆转。
口虾蛄;非小细胞肺癌;多药耐药1;细胞外调节蛋白激酶1/2蛋白
肺癌发病率高,其中非小细胞肺癌占75%~85%[1]。目前化疗药物靶向性差,容易产生耐药,治疗效果并不显著。因此,寻找天然、高效、低毒、低价的抗肿瘤药物对肿瘤的防治和治疗、提高中晚期肿瘤患者的生存质量意义重大[2]。口虾蛄俗名濑尿虾,是极为常见的一种海洋生物。既往研究[3~6]发现,口虾蛄的乙醇粗提取物、乙酸乙酯提取物(ESO)对鼻咽癌细胞株有明显的增殖抑制作用,抑制作用主要与口虾蛄中的生物碱和蛋白多肽类物质有关。但口虾蛄提取物是否有广谱抗癌的特性,是否对耐药的肺癌细胞增殖有抑制作用,是否对耐药的肺癌细胞有多药耐药逆转效应未见报道。2015年12月~2016年12月,本研究观察了ESO对人肺腺癌耐药细胞株A549/DDP的增殖、耐药的影响,并探讨其机制。
1 材料与方法
1.1 实验仪器与试剂 胎牛血清、DMEM/High Glucose细胞培养基购于Gibco公司,顺铂购于齐鲁制药有限公司,DMSO、MTT购于Sigma公司,多药耐药蛋白1(MDR1)抗体购于Santa生物技术有限公司,p-ERK1/2、ERK1/2抗体购于Cell Signaling Technology生物技术有限公司。
1.2 ESO提取及配置 于广东湛江东风市场购新鲜的口虾蛄80 kg,用烘箱烘干,高效粉碎机粉碎后称重。采用湿法提取口虾蛄抗肿瘤有效活性成分。先以95%食用乙醇浸泡数次,直到浸泡液颜色变澄清。每次浸泡48 h,每3 h搅拌1次,共用乙醇溶液60 L,浸泡液用离心机离心留取上清液。将浸泡液混匀,然后用旋转蒸发仪在56 ℃恒温下旋转蒸发,得到乙醇粗提取物。乙醇粗提取物按1∶3加水,在60 ℃下搅拌,待分液漏斗中有乳浊液分层出现,向其加入一半体积的乙酸乙酯,充分震荡、静置数分钟到数小时;待明显分层后,打开分液漏斗旋塞,将下层乳浊液流入烧杯中,上层黄色澄清溶液即为乙酸乙酯萃取层,黄色澄清溶液经旋转蒸发仪减压浓缩得到黄褐色膏状物,即为乙酸乙酯提取物。共得到乙醇粗提取物1.7 kg,乙酸乙酯提取物0.14 kg,口虾蛄提取物提取率为0.175%[6]。采用DMSO将ESO配置成1 g/mL母液,分装于4 ℃冰箱保存,临用前用含血清的培养基稀释成所需终浓度(0、200、400、800 μg/mL)。处理细胞时,DMSO的最终浓度小于0.1%,该浓度不引起细胞生物学性状改变。
1.3 细胞株来源及培养 人肺腺癌耐药细胞株A549/DDP由广东医科大学附属医院中心实验室惠赠,最大耐药倍数2.47。用含10%胎牛血清的DMEM高糖培养基培养A549/DDP,用终浓度为1.2 μmol/L的顺铂维持其耐药性。在温度为37 ℃、含5% CO2的培养箱培养,用0.25%含DTT的胰蛋白酶消化、传代细胞,取对数生长期细胞用于实验。
1.4 细胞增殖抑制率测算 采用MTT法。取对数生长期A549/DDP细胞接种于96孔培养板,每孔约含5 000个细胞;空白对照为不含细胞的等量完全培养基。待细胞贴壁后,阴性对照中仅加入等体积的培养基,干预组中各孔分别加入终质量浓度为200、400、800 μg/mL的ESO。每个浓度设5个复孔。培养24 h后,每孔加入20 μL浓度为5 mg/mL的MTT,继续培养4 h。弃掉培养液,每孔加入150 μL的DMSO,平板摇床低速振荡10 min,酶标仪570 nm波长下测定其吸光度(A)值,实验重复3次。细胞抑制率(%)=[1-(干预组A值-空白对照A值)/(阴性对照A值-空白对照A值)]×100%。
1.5 细胞周期检测 采用流式细胞术。取对数生长期的A549/DDP细胞(1×106/孔),置于6孔板中,待细胞贴壁、铺满后,予不同浓度(0、200、400、800 μg/mL)ESO干预后继续培养24 h。胰酶消化,离心(1 000 r/min),PBS洗2次,-20 ℃预冷的70%乙醇固定,置于4 ℃冰箱过夜保存。取出固定细胞样本,离心(1 500 r/min)弃乙醇,PBS洗2次,将细胞重悬于0.2 mL冷PBS中,然后加入0.5 mL已配好的碘化丙啶(PI)染色液,置于4 ℃冰箱避光染色30 min,350目尼龙膜过滤。用流式细胞仪测定各组细胞DNA的含量,然后用细胞周期分析软件进行分析,得出细胞周期百分率。
1.6 细胞MDR1蛋白功能活性检测 采用流式细胞术检测罗丹明123(Rh123)在细胞内积累、外排的荧光强度,以代表MDR1蛋白的转运功能。Rh123的激发波长507 nm,发射波长529 nm。实验分为阴性对照组及干预组,取对数生长期的A549/DDP细胞(1×106/孔),置于6孔板中,用含有5 μmol/L的Rh123培养液于37 ℃、5% CO2培养箱中分别培养0、30、60 min。每个时间点离心收集细胞,用冷PBS洗2遍,然后重悬于0.5 mL冷的PBS中,置于冰上,采用流式细胞仪检测Rh123的荧光峰。干预组需在不含Rh123培养液中加入400 μg/mL的ESO,余处理同前。
1.7 细胞MDR1、ERK1/2、p-ERK1/2蛋白检测 采用Western blotting法。检测不同浓度(0、200、400、800 μg/mL)ESO干预24 h后细胞MDR1蛋白;检测400 μg/mL ESO干预2、4、8 h后细胞ERK1/2、p-ERK1/2蛋白。提取总蛋白,样品进行SDS-PAGE后转膜。转膜条件为300 mA、恒电流90 min。5%脱脂奶粉封闭1 h,然后加入1 mL一抗MDR1(1∶1 000)、ERK1/2(1∶1 000)、p-ERK1/2(1∶1 000)、β-actin(1∶4 000),4 ℃孵育过夜,回收一抗,TBST洗膜3次,每次10 min。分别加入2 mL二抗(1∶5 000),室温孵育2 h,TBST洗膜3次,每次10 min,ECL发光液发光成像,用凝胶图像分析软件分析灰度值。

2 结果
2.1 不同浓度ESO干预细胞增殖抑制率比较 200、400、800 μg/mL的ESO干预细胞增殖抑制率分别为19.940%±0.041%、37.360%±0.024%、42.510%±0.008%,两两相比P均<0.01。
2.2 不同浓度ESO干预细胞周期百分率比较 见表1。
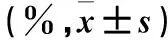
表1 不同浓度ESO干预细胞周期百分率比较
注:与0 μg/mL相比,*P<0.01;与200 μg/mL相比,▲P<0.01;与400 μg/mL相比,#P<0.01。
2.3 各组细胞Rh123积累、外排的荧光强度比较 见表2。
2.4 不同浓度ESO干预细胞MDR1蛋白表达比较 0、200、400、800 μg/mL的ESO干预细胞MDR1蛋白相对表达量分别为1.22±0.23、0.83±0.16、0.37±0.09、0.31±0.04,两两相比P均<0.01。

表2 各组细胞Rh123积累、外排的荧光强度比较
注:与阴性对照组相比,#P<0.01;与干预组0 min时相比,*P<0.01;与干预组30 min时相比,▲P<0.01。
2.5 ESO干预不同时间细胞ERK1/2、p-ERK1/2蛋白表达比较 见表3。

表3 ESO干预不同时间细胞ERK1/2、p-ERK1/2蛋白表达比较
注:与0 h时相比,*P<0.01;与2 h时相比,▲P<0.01;与4 h时相比,#P<0.01。
3 讨论
肺癌是目前全球发病率和病死率最高的恶性肿瘤之一[7]。2012年,我国肺癌病死率和发病率均位列恶性肿瘤第一,年发病和死亡病例为70.5万和56.9万[8]。肿瘤化疗研究进展提示,各类化疗药物通过对细胞周期调控,诱导肿瘤细胞凋亡,以达到控制肿瘤增殖的目的[9]。大量临床研究数据表明,采用单一化疗药物治疗肺癌效果并不显著,且易产生耐药。虽已经开发了针对MDR1蛋白靶点的分子靶向药物,但因其不良反应多,易发生耐药,而退居二线。
中药临床疗效明显,其不良反应少,在逆转肿瘤的多药耐药方面已成为研究热点,中药单体及多种成分均具有逆转肺癌多药耐药的作用[10~12]。多药耐药是指肿瘤细胞对一种化疗药物产生耐药的同时,对之前未接触过的多种抗肿瘤药物同样产生耐药。肿瘤细胞产生耐药是中晚期癌症患者治疗失败的主要原因,耐药分子机制十分复杂,涉及膜转运蛋白介导的药物外排泵机制、相关耐药蛋白过表达、酶类介导的肿瘤细胞解毒及修复功能增强、凋亡调控基因异常、信号转导因子发挥抗凋亡机制、肿瘤干细胞靶点表达缺失等多种因素[13~15]。有学者认为细胞间黏附作用介导肿瘤耐药,但多数学者认为肿瘤耐药主要与MDR1蛋白在肿瘤细胞中过度表达并介导药物外排有关。本研究结果发现,ESO对A549/DDP细胞增殖有抑制作用,且随着ESO浓度的增加作用不断增强。既往研究表明,ESO通过阻滞细胞周期S期而抑制细胞有丝分裂,从而抑制肝癌细胞增殖。何欣等[16]发现丹参酮ⅡA能显著降低肿瘤患者体内MDR1蛋白、TOPOⅡ的表达,从而提高抑瘤率及肿瘤细胞的凋亡率。刘盛楠等[17]发现白藜芦醇能够抑制肺癌细胞A549的生长,诱导其凋亡。ESO对A549/DDP细胞增殖抑制,是否与细胞周期阻滞及促进其凋亡有关?本研究采用流式细胞技术对其细胞周期进行检测,结果发现,经ESO干预的A549/DDP细胞,其G2/M期发生周期阻滞,随着ESO浓度的增加阻滞作用不断增强。可见,ESO主要通过调控A549/DDP细胞周期,从而抑制其增殖。
唐晓勇等[18]发现浙贝母碱对A549/DDP有多药耐药的逆转作用,其可能是通过截断细胞外膜肺耐药相关蛋白(LRP)的胞内药物外排泵功能及诱导细胞凋亡,从而发挥逆转肿瘤多药耐药活性的作用。Li等[19]发现,胡椒碱对A549/DDP有明显的增敏作用,且能逆转其多药耐药,逆转倍数达14.4倍,其逆转机制可能与抑制多药耐药蛋白、多药耐药相关跨膜蛋白(MRP)的表达,从而增加细胞内化疗药物的蓄积或减少清除,并下调ABCG2、ABCB1等耐药基因的表达有关。本研究结果显示,Rh123在ESO干预A549/DDP细胞内积累增多、外排减少,且60 min时较30 min时明显,可见ESO可以在细胞内蓄积或清除减少,实现耐药逆转。本研究结果发现,A549/DDP耐药细胞经ESO干预后,MDR1蛋白表达下调,随ESO浓度的增加蛋白下调更明显。而ESO干预不同时间A549/DDP细胞ERK1/2蛋白表达无变化,p-ERK1/2蛋白表达上调,表明MAPK-ERK信号通路激活,调节了ESO对细胞的敏感性,其机制有待进一步研究。下一步我们将采用qRT-PCR检测MDR1基因表达,以及敲低或RNA干扰MDR1基因,或使用MDR1基因及ERK1/2信号通路抑制剂进行干预,或加入ATP酶活性抑制剂干预,检测MRP、乳腺癌耐药蛋白、LRP等多个耐药蛋白表达,进一步探讨ESO与耐药逆转的关系,明确其作用机制。
[1] He YY, Zhang XC, Yang LL, et al. Prognostic significance of genotype and number of metastatic sites in advanced non-small cell lung Cancer[J]. Clin Lung Cancer, 2014,15(6):441-447.
[2] Rajeswaran A, Trojan A, Burnand B, et al. Giannelli, efficacy and side effects of cisplatin and carboplatin-based doublet chemotherapeutic regimens versus non-platinum-based doublet chemotherapeutic regimens as first line treatment of metastatic non-small cell lung carcinoma: a systematic review of randomized controlled trials[J]. Lung Cancer, 2008,59(1):1-11.
[3] 赵明伦,罗晨美,龙发,等.人低分化鼻咽癌上皮细胞系生长能力检测和对中草药及海洋药物的反应[J].湛江医学院学报,1988,6(2):37-40.
[4] 李明勇,黄培春,孔霞,等.MTT法测定口虾蛄提取物的体外抗肿瘤活性[J].现代肿瘤学,2005,13(3):336-337.
[5] 冯承恩,吕应年,叶才果,等.口虾蛄乙酸乙酯提取物分离及体外抗肿瘤活性的研究[J].长春中医药大学学报,2009,25(2):173-174.
[6] 叶才果,潘海燕,黄培春,等.海洋来源的口虾蛄生物碱的分离纯化和抗鼻咽癌作用的研究[J].时珍国医国药,2008,19(12):2965-2966.
[7] Siegel RL, Miller KD, Jemal A, et al. Cancer statistics, 2017[J]. CA Cancer J Clin, 2017,67(1):7-30.
[8] 陈万青,郑荣寿,张思维,等.2012年中国恶性肿瘤发病和死亡分析[J].中国肿瘤,2016,24(1):1-8.
[9] Meng G, Chai K, Li X, et al. Luteolin exerts pro-apoptotic effect and anti-migration effects on A549 lung adenocarcinoma cells through the activation of MEK/ERK signaling pathway[J]. Chem Biol Interact, 2016,257:26-34.
[10] Thomas H, Coley HM. Overcoming multidrug resistance in cancer:An update on the clinical strategy of inlubiting p-glycoprotein[J]. Cancer Control, 2003,10(2):159 -165.
[11] 欧阳兵,季旭明,李文华,等.中药复方逆转肿瘤多药耐药研究的基本思路和方法[J].山东中医药大学学报,2002,26(6):472-473.
[12] 徐萌,周蓓.汉防己甲素逆转肺癌化疗耐药和凋亡抗性的实验研究[J].新中医,2006,38(6):90-91.
[13] Jiang YQ, Xu XP, Guo QM, et al. Reversal of cisplatin resistance in non-small cell lung cancer stem cells by Taxus chinensis var[J]. Genet Mol Res, 2016,15(3). doi: 10.4238/gmr.15038336.
[14] Shi YQ, Qu XJ, Liao YX, et al. Reversal effect of a macrocyclic bisbibenzyl plagiochin E on multidrug resistance in adriamycin-resistant K562/A02 cells[J]. Eur J Pharmacol, 2008,584(2):66-71.
[15] Baguley BC. Muhiple drug resistance mechanisms in cancer[J]. Mol Biote Chnol, 2010,46(3):308-766.
[16] 何欣,刘华,曾柏荣,等.丹参酮ⅡA 对小鼠S180肿瘤获得性多药耐药及P-gp、LRP的影响[J].湖南中医药大学学报,2010,30(7):16-18.
[17] 刘盛楠,隋文静,邵淑丽,等.白藜芦醇诱导肺癌A549细胞凋亡[J].基因组学与应用生物学,2015,35(4):685-691.
[18] 唐晓勇,唐迎雪,许鹏,等.浙贝母碱对A549/顺铂耐药肺癌细胞株核苷酸ERCC1基因及LRP表达的影响[J].中国中西医结合杂志,2015,35 (12):1490-1494.
[19] Li S, Lei Y, Jia Y, et al. Piperine, a piperidine alkaloid form Piper nigrum re-sensitizes P-gp, MRP1 and BCRP dependt multidrug resistant cancer cell[J]. Phytomedicine, 2011,19(1):83-87.
Effects of ESO extracts on proliferation and drug resistance of human lung adenocarcinoma drug-resistant cell line A549/DDP
SHAOSongjun1,FANGHaiyan,DUANLingdi,YUANGuohang,ZHANGXiangyan,GUOBing
(1GuizhouProvincialPeople'sHospital,Guiyang550002,China)
Objective To observe the effects of ethyl acetate extracts of Squilla oratoria (ESO) on proliferation and drug resistance of human lung adenocarcinoma drug-resistant cell line A549/DDP and to investigate its mechanism. Methods We selected the A549/DDP cell line, which were treated with different concentrations of ESO (0, 200, 400, 800 μg/ml) for 24 h. The proliferation inhibition rates of A549/DDP cells were detected by MTT assay. The cell cycle percentage was determined by flow cytometry (FCM). We used FCM to detect the Rhodamine123 (Rh123) accumulation and efflux in A549/DDP cells treated with 400 μg/mL ESO for 0, 30, and 60 min. After the cells were treated with different concentrations of ESO for 24 h, the multidrug resistance 1 (MDR1) protein was detected by Western blotting. Meanwhile, we detected the ERK1/2, p-ERK1/2 protein of cells after 400 μg/mL ESO treatment for 2, 4, and 8 h.Results The proliferation inhibition rates of A549/DDP cells treated with 200, 400, and 800 μg/mL ESO were 19.940%±0.041%, 37.360%±0.024%, and 42.510%±0.008%, and significant difference was found between every two groups (allP<0.01). A549/DDP cells treated with 0, 200, 400, and 800 μg/mL ESO could be blocked in G2/M phase, and the proliferation inhibition rates were 24.06%±2.22%, 31.1%±0.79%, 35.64%±1.15%, and 43.19%±0.43%, respectively; significant difference was found between every two groups (allP<0.01). ESO increased the accumulation of Rh123 level of A549/DDP cells, reduced the efflux, and this change was more significant at 60 min than at 30 min (allP<0.01). The expression of MR1 protein was 1.22±0.23, 0.83±0.16, 0.37±0.09, and 0.31±0.04 in A549/DDP cells after 0, 200, 400, 800 μg/mL of ESO treatment respectively, allP<0.01. However, p-ERK1/2 protein expression was up-regulated in A549/DDP cells (P<0.01), but p-ERK1/2 protein expression had no variation at different time of ESO treatment. Conclusion ESO inhibits the proliferation of A549/DDP cells through cell cycle arrest, and reverses the multidrug resistance by regulating the MAPK-ERK1/2 signaling pathway.
Squilla oratoria; non-small-cell lung cancer; multidrug resistance 1; extracellular signal-regulated kinase 1/2 protein
贵州省科技合作计划项目(黔科合LH字2015-7126号)。
邵松军(1984-),男,硕士,主治医师,主要从事肺癌的基础与临床研究。E-mail: 351224694@qq.com
张湘燕(1962-),女,硕士,教授、主任医师,主要从事肺癌的基础与临床研究。E-mail: zxy35762@126.com
10.3969/j.issn.1002-266X.2017.22.001
R285.5
A
1002-266X(2017)22-0001-04
2017-02-22)
