异绿原酸A的抗氧化活性研究
2017-07-05轩铭王岱
,, , ,轩铭,,,王岱,,,,*
(1.山西医科大学药学院,山西太原 030001; 2.山东省科学院生物研究所,山东省科学院重点实验室, 山东省生物检测技术工程实验室,山东济南 250014; 3.山东省生物传感器重点实验室,山东济南 250014; 4.山东省分析测试中心,山东济南 250014;)
异绿原酸A的抗氧化活性研究
侯彩平1,2,韩利文2,3,张凤1,2,楚杰2,3,张轩铭2,3,王荣春2,3,陈锡强2,3,王岱杰4,刘可春2,3,田青平1,*,何秋霞2,3,*
(1.山西医科大学药学院,山西太原 030001; 2.山东省科学院生物研究所,山东省科学院重点实验室, 山东省生物检测技术工程实验室,山东济南 250014; 3.山东省生物传感器重点实验室,山东济南 250014; 4.山东省分析测试中心,山东济南 250014;)
从忍冬根药材中提取异绿原酸A,采用DPPH法、水杨酸比色法、邻苯三酚自氧化法及还原力测定法来进行体外抗氧化实验,利用皮肤荧光斑马鱼模型研究异绿原酸的体内抗氧化活性。结果表明,在0.5~10 μg/mL范围内,异绿原酸A对DPPH和羟基自由基表现出了较好的清除作用,清除率最高分别达97.04%和60.01%;而异绿原酸A在5~200 μg/mL范围内超氧自由基清除率最高仅达到28.04%;还原力测定OD值在0.5~100 μg/mL范围内最高达0.98,说明异绿原酸A的还原能力强;异绿原酸A在皮肤荧光斑马鱼体内抗氧化效果良好,在浓度为25 μg/mL时,相对抗氧化能力可达到60.4%。异绿原酸A对自由基有较好的清除能力,有良好的体内体外抗氧化活性。
异绿原酸A,皮肤荧光斑马鱼,抗氧化能力,自由基
异绿原酸是绿原酸的二咖啡酰基取代异构体,该类化合物是由奎宁酸与咖啡酸通过酯化反应缩合而成的有机酚酸类天然产物,广泛存在于金银花(Lonicerajaponica)、杜仲以及含酚酸类物质的植物中[1],异绿原酸有抗炎、抗病毒、降血压和体外抗氧化活性[2]。异绿原酸A(3,5-O-二咖啡酰奎宁酸)和异绿原酸C呈现较好的抗炎活性,能通过抑制白细胞迁移和炎症过程超氧阴离子的产生而发挥体外抗炎作用[3]。在异绿原酸A对大肠杆菌抑菌实验时,周志娥等[4]发现其抑菌效果好于绿原酸,对细胞膜、细胞壁的作用效果也强于绿原酸。Robinson等[5]发现异绿原酸A除了能抑制HIV-1整合酶,还能抑制HIV-1在组织中的复制,对HIV-1的治疗指数大于100。Oh等[6]研究了异绿原酸A和C的降血压作用,均能抑制血管紧张素转换酶的活性。Iwai等[7]对绿咖啡豆中的7种异绿原酸类化合物体外抗氧化活性进行了测试,其中异绿原酸A、B、C均有抗氧化活性。Heilmann等[8]利用人中性白细胞以酵母多糖刺激产生呼吸爆发,检测细胞氧自由基的生成情况,表明异绿原酸A有很强的捕获超氧阴离子和羟基自由基的能力。
异绿原酸A的研究主要集中于制备工艺、含量测定、药理活性[1]及体外抗氧化活性方面的研究[9],其体内抗氧化活性研究较少,本文采用皮肤荧光斑马鱼模型来评价异绿原酸A体内抗氧化效果。斑马鱼的基因与人类基因有87%的相似性,被广泛地应用于生命科学研究[10]。转基因皮肤荧光斑马鱼cy17(krt4-NTR:GFP)(简称皮肤荧光斑马鱼)是将绿色荧光蛋白连接在角质细胞上[11],该品系内置硝基还原酶元件,加入甲硝唑能够导致角质细胞产生凋亡且绿色荧光蛋白表达降低。而加入抗氧化物质会抑制角质细胞的凋亡,绿色荧光蛋白表达也相应增加,故通过在荧光显微镜下观察并计数角质细胞变化,来测定物质的抗氧化能力[12]。通过体内外实验考察异绿原酸A的抗氧化活性,对将其研制成有抗氧化活性的天然药物提供一些参考。
1 材料与方法
1.1材料与仪器
实验用忍冬根 济南市建联中药店,经鉴定该药材为忍冬科、忍冬属、忍冬(LonicerajaponicaThunb)的干燥根;间氨基苯甲酸乙酯甲磺酸盐(MS222) Sigma公司,CAS:886-86-2;水 双蒸水;斑马鱼培养水 配方为5 mmol/L NaCl,0.17 mmol/L KCl,0.14 mmol/L CaCl2,0.16 mmol/L MgSO4;VC国药集团化学试剂有限公司;甲硝唑(培养水溶解,现配现用) 北京鼎国昌盛生物技术有限责任公司;1,1-二苯基-2-三硝基苯肼(DPPH) 上海梯希爱化成发展有限公司;薄层硅胶GF254、柱色谱硅胶(200~300目) 青岛海洋化工厂;HPLC用甲醇、乙腈为色谱纯 美国Tedia公司;转基因皮肤荧光斑马鱼cy17(krt4-NTR:GFP) 山东省科学院生物研究所繁殖;HPLC用水 纯净水;无水乙醇、乙酸乙酯、甲醇、石油醚、VC、二甲基亚砜(DMSO)、KCl、CaCl2、MgSO4、亚硝酸钠、硝酸铝、硫酸亚铁、水杨酸、双氧水、二氯甲烷、氯化铁、磷酸二氢钠、磷酸氢二钠、铁氰化钾、氢氧化钠等试剂 分析纯。
YMC-PEAK ODS-A column(250 mm×4.6 mm,i.d. 5 μm)分析型色谱柱 安捷伦科技有限公司;旋转蒸发器R-3 瑞士BUCHI公司;普源L-3000系列高效液相色谱仪 北京普源精电科技有限公司;Waters 600型高效液相色谱仪 美国Waters公司;Bruker-400核磁共振波谱仪 瑞士布鲁克公司;Agilent 1200RRLC-6410 QQQ-MS/MS质谱仪 安捷伦科技有限公司;Nicolet710傅里叶变换红外光谱仪 上海力晶科学仪器有限公司;SPECTRA MR多功能酶标仪 北京宏昌信科技有限公司;Olympus SZX-16型荧光显微镜 日本Olympus公司;LE 204E/02型电子天平 上海梅特勒-托利多仪器有限公司;恒温培养箱 上海精宏实验设备有限公司;KQ2200DV型数控超声波冲洗器 昆山市超声仪器有限公司;电热恒温水浴锅 上海贺德实验设备有限公司。
1.2实验方法
1.2.1 从忍冬根中提取异绿原酸A 称取干燥忍冬根5 kg,粉碎,95%乙醇分别回流提取2、2和1 h,提取液合并、浓缩,得乙醇提取物;依次用等体积石油醚、乙酸乙酯、正丁醇萃取4次,分别合并每部分萃取液,减压浓缩干燥得到3种浸膏。其中乙酸乙酯浸膏通过硅胶柱色谱(CH2Cl2-CH3OH,100∶0→0∶100)分为13段。第9部分(CH2Cl2-CH3OH,10∶1)经硅胶柱色谱、Sephadex LH-20、高效制备液相色谱得七种化合物[13],测定其氢谱和碳谱。
1.2.2 异绿原酸A体外抗氧化实验
1.2.2.1 DPPH自由基清除实验 采用DPPH法[14]测定异绿原酸A对DPPH自由基的清除作用。将异绿原酸A用DMSO配制成2 mg/mL的母液,再分别用水依次稀释为10、5、2.5、1、0.5 μg/mL的实验浓度。0.1 mmol/L DPPH溶液用无水乙醇配制,锡箔纸包裹避光备用。准确吸取200 μL不同浓度的异绿原酸A溶液和300 μL新配制的0.1 mmol/L DPPH溶液到EP管中,混合均匀,锡箔纸包裹后于室温暗反应30 min,以VC溶液作为阳性对照,在517 nm处用酶标仪测定反应液的吸光度。样品对DPPH清除率的计算公式为:
SA(%)=[1-(Ai-Aj)/A0]×100
其中,Ai为样品溶液的吸光度,Aj为抗氧化剂本底吸光度,A0为空白对照吸光度。
1.2.2.2 羟基自由基清除实验 采用水杨酸比色法[15]测定异绿原酸A对羟基自由基的清除作用。将异绿原酸A用DMSO配制成2 mg/mL的母液,再分别用水依次稀释为10、5、2.5、1、0.5 μg/mL的实验浓度。在EP管中依次加入100 μL FeSO4溶液,100 μL不同浓度抗氧化剂溶液,100 μL水杨酸乙醇溶液,混合均匀,最后加入100 μL 6 mmol/L H2O2溶液,反应开始,置37 ℃水浴反应30 min,用酶标仪于510 nm处测得吸光度Ai;用水代替反应体系中的H2O2测得抗氧化剂本底吸光度Aj;用水代替反应体系中的抗氧化剂测得空白对照吸光度A0。羟基清除率计算公式如下:
SA(%)=[1-(Ai-Aj)/A0]×100。
1.2.2.3 超氧自由基清除实验 采用邻苯三酚自氧化法[16]测定异绿原酸A对超氧自由基的清除作用。将异绿原酸A用DMSO配制成2 mg/mL的母液,再分别用水依次稀释为200、50、20、10、5 μg/mL的实验浓度。取450 μL 50 mmol/L Tris-HCl缓冲液和100 μL的异绿原酸A溶液到EP管中,混合均匀,25 ℃水浴20 min后,加入40 μL 25 ℃预热的邻苯三酚溶液,混匀,置于25 ℃水浴4 min后,立刻加入100 μL 8 mmol/L的盐酸溶液。用酶标仪测定320 nm波长处的吸光度值,以VC溶液作为阳性对照。超氧自由基清除率计算公式如下:
SA(%)=(A0-Ax)/A0×100
式中,A0为不加抗氧化剂的空白对照吸光度,Ax为抗氧化剂吸光度。
1.2.2.4 还原力实验 采用还原力测定法[17]测定异绿原酸A的还原能力。将异绿原酸用DMSO配制成2 mg/mL的母液,再分别用水依次稀释为100、50、10、1、0.5 μg/mL。称取Na2HPO47.16 g以适量水溶解后再定容至100 mL配制成0.2 mol/L的甲溶液,称取NaH2PO43.12 g以适量水溶解后再定容至100 mL配制成0.2 mol/L的乙溶液,各取甲溶液40 mL,乙溶液60 mL混合配制成磷酸缓冲液。称取铁氰化钾1 g以适量水溶解后再定容至100 mL配制成1%浓度的铁氰化钾溶液。称取二氯乙酸10 g以适量水溶解后再定容至100 mL配制成10%浓度的二氯乙酸溶液。称取FeCl30.1 g以适量水溶解后再定容至100 mL配制成0.1%浓度的FeCl3溶液。用移液枪准确取400 μL不同浓度的异绿原酸A和VC溶液加入到2 mL EP管中,然后加入400 μL 0.2 mol/L的磷酸缓冲液,再添加400 μL 1%的铁氰化钾溶液后混匀。置于50 ℃的水浴锅中反应20 min。反应结束后加入400 μL 10%的二氯乙酸溶液混匀后,在离心机中以3000 r/min的转速离心10 min,吸取上清液800 μL加入已配好的FeCl3溶液(80 μL 0.1%的FeCl3溶液和640 μL蒸馏水)中混匀。静置10 min,用酶标仪于700 nm处测定吸光度。
1.2.3 皮肤荧光斑马鱼体内抗氧化活性研究 皮肤荧光斑马鱼的养殖方法参照Westerfield[18]的方法,选择成熟的皮肤荧光斑马鱼,按照雌鱼与雄鱼1∶1的比例于放入繁殖缸内,次日清晨收集受精卵,加入1%的亚甲基蓝溶液,然后放入28 ℃培养箱中培养。24 h后取出皮肤荧光斑马鱼胚胎,放置于1 mg/mL的链霉蛋白酶溶液中约1 min左右,脱去皮肤荧光斑马鱼胚胎外层的卵膜,将脱去卵膜的皮肤荧光斑马鱼胚胎随机分成空白对照组、溶剂对照组、甲硝唑组、甲硝唑+VC组和甲硝唑+异绿原酸A组(25、50、100 μg/mL),每组胚胎7个,同时设置2个重复孔,加入24孔板中,每组实验进行三次。根据实验分组,在空白和溶剂对照组加入2 mL培养水,溶剂对照组再加入5 μL的DMSO,甲硝唑组直接用新鲜培养水配成0.01 mol/L的甲硝唑溶液,甲硝唑组、异绿原酸A组(25、50、100 μg/mL)和VC组(100 μg/mL)分别加入2 mL 0.01 mol/L的甲硝唑溶液,同时VC组按照各自的浓度加入不同量的40 μg/mL的VC溶液,将异绿原酸A用DMSO先配制成40、20、10 mg/mL的母液,再每组加5 μL母液,摇匀,置于28 ℃的恒温培养箱中培养24 h之后,将皮肤荧光斑马鱼用间氨基苯甲酸乙酯甲磺酸盐(MS222)麻醉后拍照,在荧光显微镜下观察皮肤荧光斑马鱼的生长情况以及皮肤角质细胞的数量,并利用Imagepro-plus软件统计各条皮肤荧光斑马鱼的皮肤荧光点数量,再用SPSS 13.0对数据进行统计分析。
SA(%)=(N2-N1)/(N0-N1)×100
式中,SA为相对抗氧化能力,N0为溶剂对照组角质细胞数量,N1为甲硝唑组荧光角质细胞数量,N2为给药组荧光角质细胞数量。
2 结果与分析
2.1异绿原酸A的结构确定
分析氢谱和碳谱数据得其中一种化合物为异绿原酸A,纯度为93.75%(白色粉末,ESI-MS-m/z 515.4[M-H]-(C25H24O12);1H NMR(400 MHz,DMSO-d6)δ-7.51(1H,d,J=14.8 Hz,H-7′),7.43(1H,d,J=14.8 Hz,H-7″),7.06(2H,d,J=5.6 Hz,H-2′,2″),6.97(2H,d,J=6.4 Hz,H-6′,6″),6.78(2H,brs,H-5′,5″),6.23(1H,d,J=15.8 Hz,H-8′),6.19(1H,d,J=15.8 Hz,H-8″),5.33(1H,m,H-5),5.13(1H,m,H-3),3.84(1H,s,H-4),2.14(1H,m,H-6α),1.99(2H,m,H-2),1.91(1H,m,H-6β);13C NMR(100 MHz,DMSO-d6)δ-72.9(C-1),36.2(C-2),71.1(C-3),68.0(C-4),71.4(C-5),35.2(C-6),175.8(C-7),126.1(C-1′),126.0(C-1″),115.2(C-2′),114.6(C-2″),145.2(C-3′,3″),148.9(C-4′),148.7(C-4″),116.3(C-5′,5″),166.1(C-9′),166.6(C-9″),121.7(C-6′,6″),146.1(C-7′),145.6(C-7″),116.2(C-8′),115.3(C-8″)。该化合物波谱数据与文献[19]报道的3,5-O-二咖啡酰奎宁酸即异绿原酸A数据基本一致,故鉴定化合物为异绿原酸A。
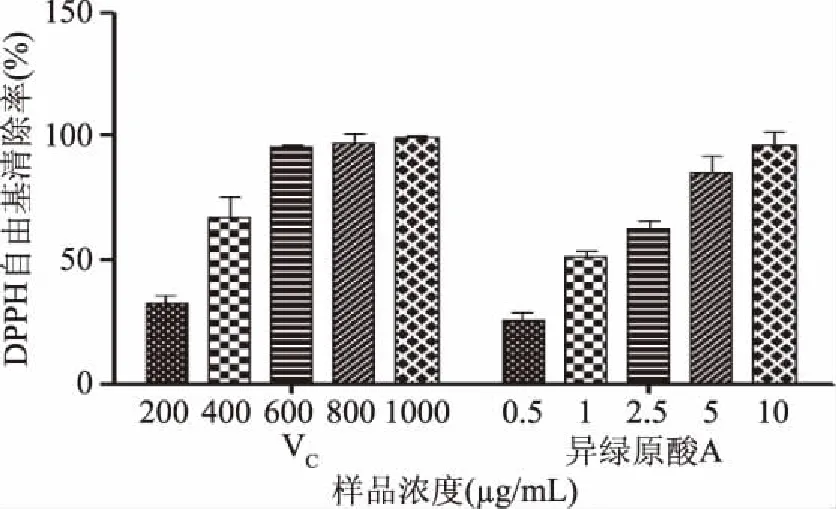
图1 不同浓度样品对DPPH·的清除作用Fig.1 Scavenging effect of DPPH· in different concentration samples
2.2异绿原酸A的DPPH自由基清除活性
异绿原酸A的DPPH自由基清除活性结果如图1所示,在该实验浓度0.5~10 μg/mL范围内,异绿原酸A对DPPH·的清除作用随浓度的升高而逐渐增强,呈现明显的剂量-浓度效应。600 μg/mL VC的DPPH·清除率达到99.00%,而异绿原酸A在浓度仅为10 μg/mL时清除率即接近于100%(97.04%),这说明异绿原酸A具有比VC更强的DPPH·清除作用。
2.3异绿原酸A的羟基自由基清除活性
异绿原酸A的羟基自由基清除活性结果如图2所示,在该实验浓度0.5~10 μg/mL范围内,异绿原酸A对羟基自由基的清除率随浓度升高而逐渐增大,异绿原酸A在10 μg/mL时,其清除率为60.01%,而VC浓度在200~1000 μg/mL范围内清除率均在20.00%左右,未发生明显变化。故实验表明异绿原酸A表现出高于VC的良好的羟基自由基清除能力。
异绿原酸A对DPPH自由基和羟基自由基具有良好的清除作用,这可能是因为异绿原酸A本身的酚羟基结构极易与自由基反应,提供质子和电子使其失去反应活性,故具有显著的抗氧化特性[20]。

图2 不同浓度的样品对羟基自由基的清除作用Fig.2 Scavenging effect of ·OH in different concentration samples
2.4异绿原酸A的超氧自由基清除活性
异绿原酸A的超氧自由基清除活性结果如图3所示,异绿原酸A浓度从5 μg/mL升高到200 μg/mL时,其对超氧自由基的清除率从20.39%上升到28.04%,未出现明显的剂量依赖性。VC浓度从5 μg/mL升高到200 μg/mL时,其对超氧自由基的清除率从41.70%上升到60.00%。异绿原酸A与阳性对照组(VC)相比较而言,其清除超氧自由基的作用明显较弱。说明异绿原酸A清除超氧自由基的能力较弱。研究发现,异绿原酸A能够抑制黄嘌呤氧化酶活性,使得次黄嘌呤氧化为黄嘌呤、再氧化为尿酸的过程中所产生的超氧阴离子减少[21],这可能是异绿原酸A清除超氧自由基的机制。

图3 异绿原酸A和VC对超氧自由基的清除率Fig.3 Scavenging effect of · in isochlorogenic acid A and VC
2.5异绿原酸A的还原能力测定
异绿原酸A的还原力实验结果如图4所示,异绿原酸A和VC的OD值在0.5~100 μg/mL浓度范围内,随着样品浓度的增大而增大,OD值越大,其还原力越大,且异绿原酸A的OD值曲线稍高于VC,说明异绿原酸A的还原能力稍强于VC,具有强的还原力,其中异绿原酸A的OD值最高可达0.98。

图4 不同浓度样品的还原力测定Fig.4 Determination of reducing power of different concentration samples
2.6异绿原酸A的体内抗氧化活性
异绿原酸A对皮肤荧光斑马鱼皮肤细胞生成的影响见表1,溶剂对照组中,皮肤荧光斑马鱼的皮肤荧光点最多(图5A),加入甲硝唑后绝大部分荧光点消失(图5B),同时加入VC和不同浓度的异绿原酸A溶液后,荧光点数量明显地增多(图5C~F),而随着异绿原酸A浓度的增加,荧光点数逐渐减少,说明异绿原酸A的抗氧化能力在25 μg/mL下可能效果更明显,随着浓度增加抗氧化能力反而下降,说明异绿原酸A的体内抗氧化作用可能存在剂量窗。体内实验结果也显示异绿原酸A具有抗氧化活性。异绿原酸A与甲硝唑共孵育后,皮肤荧光斑马鱼皮肤上的荧光点数量比甲硝唑组明显增多,说明异绿原酸A具有明显的抗氧化活性。随着异绿原酸A浓度的增加,皮肤荧光斑马鱼皮肤细胞逐渐减少,说明在本实验浓度范围内,异绿原酸A的抗氧化活性随着浓度的升高而降低,这说明异绿原酸A的抗氧化活性呈现hormesis现象。在低于25 μg/mL浓度下,抗氧化活性比较强,随着浓度增加,虽然与模型组(甲硝唑组)相比呈现抗氧化活性,但是比低浓度组的抗氧化活性低,说明异绿原酸A可能逐渐呈现出与甲硝唑的协同促凋亡活性。

表1 异绿原酸A对皮肤荧光斑马鱼皮肤细胞生成的影响Table 1 Effect of flavonoids on the skin fluorescent zebrafish embryo formation by isochlorogenic acid A
注:***表示与甲硝唑组相比,加入样品后皮肤荧光斑马鱼的荧光数量具有显著性,且p<0.001。

图5 异绿原酸A对皮肤荧光斑马鱼抗氧化活性的影响Fig.5 Effects of Isochlorogenic acid on oxidation in zebrafish embryo by isochlorogenic acid A注:A,溶剂对照组;B,0.01 mol/L甲硝唑组;C,0.01 mol/L甲硝唑+VC 100 μg/mL组;D:0.01 mol/L甲硝唑+异绿原酸A 25 μg/mL组;E:0.01 mol/L甲硝唑+异绿原酸A 50 μg/mL组;F:0.01 mol/L甲硝唑+异绿原酸A 100 μg/mL组。
3 结论
从忍冬根中提取异绿原酸A并初步研究了异绿原酸A的体内外抗氧化活性。通过DPPH法、水杨酸比色法、邻苯三酚自氧化法及还原力测定法说明异绿原酸A对DPPH和羟基自由基表现出良好的清除作用,而超氧自由基清除率较弱,还原力测定值高于VC,具有强还原能力;利用皮肤荧光斑马鱼模型进行的体内实验说明异绿原酸A能够恢复甲硝唑所致的皮肤损伤,具有体内抗氧化活性。异绿原酸A具有良好的体内体外抗氧化活性,本研究为食品中无毒且有效抗氧化成分的开发提供了依据。
[1]李祖晟,朱志安. 二咖啡酰奎宁酸药理实验研究进展[J]. 医药综述,2004,10(4):249-250.
[2]Kimura Y,Okuda H,Okuda T,et al. Studies on the activities of tannins and related compounds,X. Effects of caffeetannins and related compounds on arachidonate metabolism in human polymorphonuclear leukocytes[J]. J Nat Prod,1987,50(3):392-399.
[3]倪付勇,宋亚玲,刘露,等. 异绿原酸A、B和C的制备工艺研究[J]. 中草药,2015,46(3):369-373.
[4]周志娥,罗秋水,熊建华,等.绿原酸、异绿原酸A对大肠杆菌的抑菌机制[J]. 食品科技,2014,39(3):228-231.
[5]Robinson W E,Reinecke M G,Abdel-Malek S,et al. Inhibitors of HIV-1 replication that inhibit HIV intergrase[J]. Proc Natl Acad Sci USA,1996,93(13):6323-6331.
[6]Oh H,Kang D G,Lee S,et al. Angiotensin converting enzyme inhibitors from Cuscuta japonicaChosy[J]. J Ethnopharm,2002,83
(12):105-108.
[7]Iwai K,Kishimoto N,Kakin Y,et al.Invitroantioxidative effects and tyrosinase inhibitory activities of seven hydroxycinnamoyl derivatives in green coffe beans[J]. J Agric Food Chem,2004,52(15):4893-4898.
[8]Heilmann J,Merfort I,Weiss M. Radical scavenger activity of different 3′,4′-dihydroxyflavonols and 1,5-dicaffeoylquinic acid studied by inhibition of chemiluminescence[J]. Planta Med,1995,61(5):435-438.
[9]李熹,邱细敏,任达兵,等. 高速逆流色谱法分离纯化艾叶中的异绿原酸A[J]. 食品工业科技,2016(10):295-297.
[10]薛迪,韩利文,何秋霞,等. 复方苦参注射液联合顺铂对斑马鱼血管生成的协同作用[J]. 时珍国医国药,2015(7):1585-1587.
[11]Chi-Fang Chen,Che-Yu Chu,Te-Hao Chen,et al. Establishment of a Transgenic Zebrafish Line for Superficial Skin Ablation and Functional Validation of Apoptosis Modulatorsinvivo[J]. Plos One,2011,6(5):1-14.
[12]关炳峰,谭军,周志娣. 金银花提取物的抗氧化作用与其绿原酸含量的相关性研究[J].食品工业科技,2007,28(10):127-129.
[13]于金倩,王召平,朱姮,等. 忍冬根的化学成分及其抗炎作用[J]. 药学学报,2016(7):1110-1116.
[14]Hu W,Guo T,Jiang WJ,et al. Effects of ultrahigh pressure extraction on yield and antioxidant activity of chlorogenic acid and cynaroside extracted from flower buds of Lonicera japonica[J]. Chin J Nat Med,2015,13(6):445-453.
[15]杨明惠,何丽仙,李珍贵. 分光光度法测定Fenton体系中产生的羟自由基[J]. 大理学院学报,2007,6(4):38-40.
[16]郭雪峰,岳永德,汤锋. 用清除超氧阴离子自由基法评价竹叶提取物抗氧化能力[J].光谱学与光谱分析,2008,28(8):1823-1826.
[17]Yen G C,Duh P D. Antioxidative Properties of Methanolic Extracts from Peanut Hulls[J]. Journal of the American Oil Chemists Society,1993,70:383-386.
[18]Westerfield M,Wegner J,Jegalian B G. Specific activation of mammalian Hox promoters in mosaic transgenic zebrafish[J]. Genes Dev,1992,6(4):591-598.
[19]王岱结. 忍冬叶化学成分及其抗H5亚型禽流感病毒研究[D]. 泰安:山东农业大学,2013.
[20]程漩格,王素军,曾洁,等. 异绿原酸A在大鼠体内的生物利用度和药物代谢动力学[J]. 中国实验方剂学杂志,2015(16):79-82.
[21]Carocho M. A review on antioxidants,pro-oxidants and related controversy-Natural and synthetic compounds,screening and analysis methodologies and future perspectives[J]. Food Chem Toxicol,2013,51:15-25.
StudyontheantioxidantactivityofisochlorogenicacidA
HOUCai-ping1,2,HANLi-wen2,3,ZHANGFeng1,2,CHUJie2,3,ZHANGXuan-ming2,3,WANGRong-chun2,3,CHENXi-qiang2,3,WANGDai-jie4,LIUKe-chun2,3,TIANQing-ping1,*,HEQiu-xia2,3,*
(1.School of pharmacology,Shanxi Medical University,Taiyuan 030001,China; 2.Biology Institute of Shandong Academy of Sciences,Key Laboratory of Shangdong Academy ofSciences,Shangdong Provincial Engineering Laboratory for Biological Testing Technology,Ji’nan 250014,China; 3.Shangdong Provincial Key laboratory of Biosensors,Ji’nan 250014,China; 4.Shandong Analysis and Test Center,Ji’nan 250014,China)

isochlorogenic acid A;zebrafish;antioxidant activities;free radical
2016-11-05
侯彩平(1991-),女,硕士研究生,研究方向:药剂学,E-mail:hcp071003@163.com。
*通讯作者:田青平(1968-),女,博士,教授,研究方向:经皮给药吸收机理及新剂型的研究,E-mail:tianqp123456@163.com。 何秋霞(1980-),女,博士,研究员,研究方向:药物筛选,E-mail:heqx@sdas.org。
国家自然科学基金青年基金(31400979);海洋公益性行业科研专项(201505030-2)。
TS255.1
:A
:1002-0306(2017)12-0072-05
10.13386/j.issn1002-0306.2017.12.013
