益生菌对结直肠息肉内镜下切除后肠道菌群的影响
2017-07-05聂刚张茜玲
聂刚 张茜玲
【摘要】 目的:觀察益生菌对结直肠腺瘤患者内镜下切除术后肠道菌群的影响。方法:选取40例结直肠腺瘤患者,以10例健康体检者作对照为正常组,采集粪便标本,测定肠道菌群,观察不同组间患者肠道菌群构成变化。将40例结直肠腺瘤患者随机分成3组:手术对照组10例,内镜下切除术后不予益生菌治疗;美常安组患者15例,在结肠镜下切除腺瘤后给予美常安(枯草杆菌二联活菌肠溶胶囊)口服(2粒,3次/d);培菲康组患者15例,在结肠镜下切除腺瘤后给予培菲康(双歧杆菌三联活菌胶囊)口服(2粒,2次/d)。总疗程均为4周,分别采集术前和术后的粪便标本进行检测,对比两种益生菌对肠道菌群的影响。结果:结直肠腺瘤患者存在肠道菌群紊乱,与正常组相比,结直肠腺瘤患者粪便中的粪肠球菌、双歧杆菌及乳杆菌数量明显下降,而大肠杆菌数目明显上调,差异均有统计学意义(P<0.05),拟杆菌数量比较差异无统计学意义(P>0.05)。与术前比较,服用两种益生菌后患者粪便中的双歧杆菌、乳杆菌数量均上调,而大肠杆菌数量降低,差异均有统计学意义(P<0.05);粪肠球菌的数量较术前有所上升,但差异无统计学意义(P>0.05);拟杆菌数量在治疗前后比较差异均无统计学意义(P>0.05)。结论:结直肠腺瘤患者存在肠道菌群改变,益生菌制剂可使结直肠腺瘤患者的有助于恢复肠道菌群,在结直肠腺瘤的治疗中有重要的临床意义。
【关键词】 大肠癌; 结直肠腺瘤; 肠道菌群; 益生菌
Effect of Probiotic on Intestinal Flora in Patients after Resection of Colorectal Adenomas/NIE Gang,ZHANG Xi-ling.//Medical Innovation of China,2017,14(16):009-012
【Abstract】 Objective:To observe the effect of probiotic on intestinal flora in patients after resection of colorectal adenomas.Method:Forty patients with colorectal adenomas were selected to test the changes of intestinal flora,the results were compared with 10 cases of healthy physical examination.Patients with colorectal adenomas were divided into three groups,the operational control group with 10 cases of colonoscopy surgery without other special treatments,the observation group of 15 cases were given Medilac-s (two tablets,three times a day) or Bifico (two tablets,twice a day).After colonoscopy surgery, for a period of treatment 4 weeks,the changes of intestinal flora and the recurrence of colorectal adenomas of all groups were observed.Result:The intestinal flora disturbance was confirmed in patients with colorectal adenomas.Compared with the normal group,the numbers of dung enterococcus, bifidobacterium and lactobacillus were decreased in patients with colorectal adenomas,otherwise,the numbers of escherichia coli were increased,the differences were statistically significant(P<0.05),but there was no difference in Bacteroides(P>0.05).After using two kinds of probiotics,the numbers of Bifidobacterium and Lactobacillus were increased in patients with colorectal adenomas,otherwise,the numbers of Escherichia Coli were decreased,the differences were statistically significant(P<0.05).The numbers of dung Enterococcus were insignificant increased(P>0.05).There was no difference in Bacteroides(P>0.05).Conclusion:Patients with colorectal adenomas existed intestinal flora changes.Intestinal flora could be recovered by probiotics among patients with colorectal adenomas.It has an important clinical significance in the treatment of colorectal adenomas.
【Key words】 Colorectal cancer; Colorectal adenomas; Intestinal flora; Probiotics
First-authors address:The University Affiliated Hospital,Chongqing Medical University,Chongqing 401331,China
doi:10.3969/j.issn.1674-4985.2017.16.003
大肠癌是欧美国家常见的消化系肿瘤,在我国其发病率也已升至恶性肿瘤发生率的第4~6位,其中约3/4患者系由大肠腺瘤发展而来[1]。国内外推荐的结直肠腺瘤(colorestal adenoma,CRA)的主要治疗手段是内镜下息肉切除治疗,全美息肉研究机构证实,结肠镜切除腺瘤性息肉可预防结直肠癌的发生[2],虽然通过内镜早期发现大肠腺瘤样息肉而摘除可减少部分大肠癌的发生,但复发率高达40%~50%[3]。目前国内外已有多项研究发现大肠肿瘤患者存在肠道菌群改变[4],提示肠道菌群紊乱可能参与了腺瘤癌变的进展过程。研究表明,补充益生菌可调节调节肠道免疫[5-6]、修复肠上皮屏障功能[7]、抑制肿瘤细胞增殖等[8]。目前关于预防性服用益生菌对结直肠腺瘤患者肠道菌群的系统性研究暂未见相关报道。本课题拟通过观察大肠腺瘤内镜切除后服用益生菌对肠道菌群的影响,进一步证实肠道菌群在大肠腺瘤患者中的意义,为临床治疗提供依据,现报道如下。
1 资料与方法
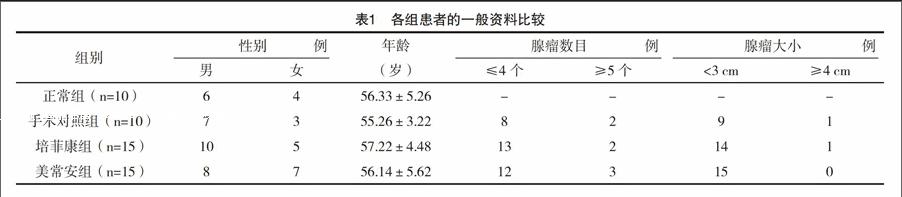
1.1 一般资料 选取2014年5月-2016年5月收集的正常人群10例,结直肠腺瘤患者40例,结直肠腺瘤患者均符合临床诊断标准。将上述对象分为四组,正常人群为正常组,随机选取10例结直肠腺瘤患者作为手术对照组,其余30例随机分成组培菲康组和美常安组,每组各15例。三组患者的一般资料比较差异均无统计学意义(P>0.05),具有可比性,见表1。所选病例患者在采样前1个月未使用抗生素、微生态活菌制剂和聚乙二醇等泻药。研究方案通过医院伦理学委员会审核,并获得患者知情同意书。
1.2 排除标准 (1)家族性腺瘤性息肉病或遗传性非息肉病结肠癌患者;(2)有腹泻、活动性消化性溃疡或胃、肠出血史等消化道疾病史;(3)1周内服用过阿司匹林、华法林等抗凝药物;(4)接受放化疗及免疫治疗的患者;(5)合并心、脑、血管、肝、肾、肺、胰腺、内分泌和造血系统严重原发性疾病,以及患有其它正在用药治疗,影响试验药物观察的患者;(6)准备妊娠、已妊娠或哺乳期妇女、精神病患者;(7)有吸毒史;(8)年龄在18岁以下,70岁以上;(9)不符合纳入标准,未按规定用药,无法判断疗效,资料不全而影响疗效安全性者。
1.3 方法 正常组:无结直肠腺瘤的正常人群。手术对照组:结直肠腺瘤内镜下切除后不另做治疗。培菲康组:结直肠腺瘤内镜下切除后,培菲康(双歧杆菌三联活菌胶囊,由上海信谊药厂有限公司生产)2粒,2次/d,连续服用4周。美常安组:结直肠腺瘤内镜下切除后,美常安(含枯草杆菌、肠球菌二连活菌肠溶胶囊,由北京韩美制药公司生产)2粒,3次/d,连续服用4周。诊疗前、治疗第4周后收集粪便标本,查大便细菌计数。疗程中禁用其他对消化系统有影响的药物,平时多食新鲜、粗纤维食物,忌食辛辣、炙博、肥腻及腌制品。所有结直肠腺瘤均采内镜下切除。术后观察切口部位是否出现穿孔、出血现象,将结肠腺瘤进行病理组织学檢查。
1.4 粪便培养及计数 正常人群组及结直肠腺瘤患者在治疗前后均留取粪便标本。取新鲜粪便0.1 g于EP管中并尽快送检(时间<30 min),加入生理盐水倍比稀释,震荡混匀,用接种环分别接种至不同的培养基上,需氧菌放置于37 ℃有氧条件下培养24~48 h计数,厌氧菌采用抽气换气法培养72 h后计数,使用ALB半自动微生物鉴定系统(法国生物梅里埃公司)行细菌鉴定,结果以每克粪便中菌落形成单位的对数值(l g CFU/g)表示,代表菌群有:需氧菌2种(大肠杆菌、粪肠球菌),厌氧菌3种(双歧杆菌、乳杆菌、拟杆菌)。
1.5 观察指标 观察正常组人群和结肠腺瘤患者粪便菌群构成情况,对比服用益生菌前后结肠腺瘤患者肠道菌群的变化情况。
1.6 统计学处理 使用SPSS 20.0统计软件进行分析,计量资料采用(x±s)表示,比较采用配对t检验,计数资料采用 字2检验,多组数据比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
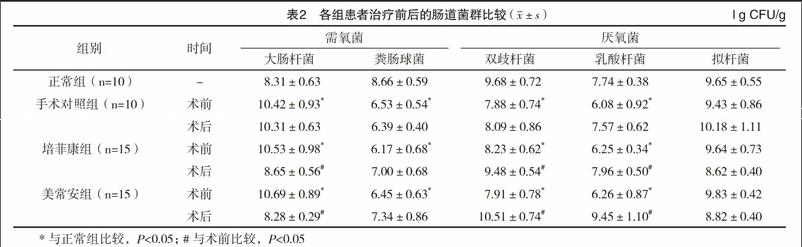
结直肠腺瘤患者存在肠道菌群紊乱,与正常组相比,术前对照组、培菲康组、美常安组患者粪便中的粪肠球菌、双歧杆菌及乳酸杆菌数量均明显下降(P<0.05)。大肠杆菌在术前对照组、培菲康组、美常安组与正常组对比,差异均有统计学意义(P<0.05)。拟杆菌数量各组间比较均差异均无统计学意义(P>0.05)。对照组患者粪便中的菌群术后与术前比较,差异无统计学意义(P>0.05)。经过两种益生菌治疗后的培菲康组、美常安组患者粪便中的双歧杆菌、乳酸杆菌数量上调(P<0.05),大肠杆菌数量下调(P<0.05),而粪肠球菌数目有所上调但差异无统计学意义(P>0.05)。见表2。
3 讨论
结直肠癌已严重危害人类的健康,而结肠腺瘤是临床上常见的消化道类疾病,是一种结肠的良性肿瘤,被公认为癌前病变[9]。目前普遍认为,大肠腺瘤在大肠癌形成发展过程中不可避免,积极根除大肠腺瘤可以降低大肠癌的发生率[10],但是由于其在结肠镜下易发生穿孔、大出血等现象,结肠腺瘤复发的机率较大[11]。
人体微生态系统以肠道微生态系统最主要、最复杂,含有微生物400多种,其中双歧杆菌、嗜酸乳杆菌、粪链球菌占98 %以上,与人体的能量、物质代谢关系密切,参与维持人体健康。
已有多项研究证实,结肠癌人群与健康人群肠道微生物存在构成差异,表现为明显的菌群稳态失衡[12-13]。Scanlan等[4]通过对结直肠癌和腺瘤性息肉病患者肠道菌群构成进行分析,发现结直肠癌及腺瘤性息肉病患者肠道菌群多样性和优势菌群降低,提示肠道菌群结构组成的改变可能对结肠癌的发生有促进作用。目前认为肠道菌群是影响CRC发生的环境因素之一,与之相关的主要功能包括调控肠上皮细胞增殖、分化,合成必需营养成分和/或生物活性成分,抑制病原体过度繁殖并激活肠道免疫系统等。肠道菌群失调和结肠癌之间的关系近年来已受到国内外广泛关注,对于肠道菌群失调参与结肠癌的发生发展也有了一定的认识,肠道菌群的作用已成为CRC发病机制研究中新的热点[14]。目前认为,肠道菌群紊乱失调会释放大量的细菌毒素,诱发结肠炎等炎性肠病,肠道屏障功能的损伤会引起非致病性细菌的转位,进而影响免疫系统稳态,导致肠道黏膜促炎症反应信号传导机制异常,使其向致癌相关的免疫反应转变,进而诱导结肠癌的发生[15]。同时,肠道微生物参与营养代谢过程中的某些产物对肠道上皮细胞具有毒性作用,致使受损肠道黏膜上皮瘤化。目前学术界认为,肠道内微生物所致的局部和全身的慢性炎症是导致肿瘤发生的主要机制[16]。
益生菌作为临床上最常用的微生态制剂,已被广泛应用于多种疾病的防治。体外研究亦发现,益生菌能够影响结肠癌细胞的增殖、凋亡和黏附等恶性生物學行为[17]。研究表明肠道菌群失调介导的慢性和低炎症状态容易刺激肿瘤的形成,主要与免疫细胞及其产生的细胞因子有关[18]。肠道菌群失调致代谢能力的改变,由于肠道厌氧菌产生一系列的代谢酶作用于不同的底物,产生致癌物质而引发结直肠癌[19]。培菲康是含有双歧杆菌、乳酸杆菌、粪肠球菌等活性成分,而美常安是含有高浓缩枯草杆菌、屎肠球菌的新型微生态制剂,目前已在腹泻及溃疡性结肠炎等疾病的防治中起到重要作用[20]。本文对结直肠腺瘤患者及正常人群的肠道菌群结构进行了简单的分析,发现粪肠球菌、双歧杆菌及乳杆菌数量明显下降,而大肠杆菌数量明显上调,提示结直肠腺瘤患者存在肠道菌群紊乱。服用益生菌制剂后,患者粪便中的乳酸杆菌、双歧杆菌数量上调,而大肠杆菌数量降低,考虑为美常安中的枯草杆菌利用生物夺氧作用降低肠道定植部位的氧浓度,造成适合厌氧菌群生长的环境,促进双歧杆菌等有益菌的生长,从而抑制大肠杆菌等致病菌的生长。而培菲康可以直接提供机体活性的双歧杆菌,从而抑制大肠杆菌的生长,益生菌制剂可以纠正结直肠腺瘤患者肠道菌群紊乱,提示益生菌可以对结直肠腺瘤患者具有临床治疗作用,为临床防治结直肠腺瘤提供新的思路和治疗手段。
参考文献
[1]陈灏珠.实用内科学[M].北京:人民卫生出版社,2005:1934.
[2] Zauber A G,Winawer S J,OBrien M J,et al.Colonoscopic polypectomy and long-term prevention of colorectal-cancer deaths[J].The New England Journal of Medicine,2012,366(8):687-696.
[3]房静远.大肠癌的化学预防:问题与希望并存[J].中华内科杂志,2009,48(2):93-94.
[4] Scanlan P D,Shanahan F,Clune Y,et al.Culture-independent analysis of the gut microbiota in colorectal cancer and polyposis[J].Environmental Microbiology,2008,10(3):789-798.
[5] De Moreno,De Leblanc A,Perdigon G.The application of probiotic fermented milks in cancer and intestinal inflammation[J].The Proceedings of the Nutrition Society,2010,69(3):421-428.
[6] Pagnini C,Saeed R,Bamias G,et al.Probiotics promote gut health through stimulation of epithelial innate immunity[J].Proceedings of the National Academy of Sciences of the United States of America,2010,107(1):454-459.
[7] Normand S,Delanoye-Crespin A,Bressenot A,et al.Nod-like receptor pyrin domain-containing protein 6 (NLRP6) controls epithelial self-renewal and colorectal carcinogenesis upon injury[J].Proceedings of the National Academy of Sciences of the United States of America,2011,108(23):9601-9606.
[8] Baldwin C,Millette M,Oth D,et al.Probiotic Lactobacillus acidophilus and L. casei mix sensitize colorectal tumoral cells to 5-fluorouracil-induced apoptosis[J].Nutrition and Cancer,2010,62(3):371-378.
[9] Wu X F,Lian N Q,Lu C F,et al.Research progress on effect of intestinal flora on chronic liver diseases[J].Chinese Pharmacological Bulletin,2013,29(12):1644-1647.
[10]朱浩,孙明军.大肠侧向发育型肿瘤内镜下的诊断与治疗[J].临床消化病杂志,2011,23(6):343-346.
[11]王少军,胡乃中,石海,等.结肠高危性腺瘤的临床分析及Decorin在腺瘤中的表达与意义[J].中国肿瘤临床,2010,37(12):685-688.
[12] Ma X,Hua J,Li Z.Probiotics improve high fat diet-induced hepatic steatosis and insulin resistance by increasing hepatic NKT cells[J].Journal of Hepatology,2008,49(5):821-830.
[13] Icaza-Chavez M E.Gut microbiota in health and disease[J].Revista de Gastroenterologia de Mexico,2013,78(4):240-248.
[14] Shen X J,Rawls J F,Randall T,et al.Molecular characterization of mucosal adherent bacteria and associations with colorectal adenomas[J].Gut Microbes,2010,1(3):138-147.
[15] Kinnebrew M A,Pamer E G.Innate immune signaling in defense against intestinal microbes[J].Immunological Reviews,2012,245(1):113-131.
[16] Konstantinov S R,Kuipers E J,Peppelenbosch M P.Functional genomic analyses of the gut microbiota for CRC screening[J].Nature Reviews Gastroenterology & Hepatology,2013,10(12):741-745.
[17] Zhu Y,Michelle L T,Jobin C,et al.Gut microbiota and probiotics in colon tumorigenesis[J].Cancer Letters,2011,309(2):119.
[18] Singh N,Gurav A,Sivaprakasam S,et al.Activation of gpr109a,receptor for niacin and the commensal metabolite butyrate,suppressescolonic inflammation and carcinogenesis[J].Immunity,2014,40(1):128-139.
[19] Vos W M D,Vos E A D.Role of the intestinal microbiome inhealth and disease: from correlation to causation[J].Nutr Rev,2012,70(Suppl 1):S45-S56.
[20]陳方,姚莉亚,潘勇裕.培菲康在肠道菌群失调中的双向调节作用[J].中国医药导刊,2008,10(3):418-419.
(收稿日期:2017-03-16) (本文编辑:周亚杰)
