添加NaBF4对阳极氧化法制备TiO2纳米管光催化剂的影响
2017-07-05王竹梅朱晓玲李月明廖润华沈宗洋
王竹梅朱晓玲李月明廖润华 沈宗洋
(景德镇陶瓷大学材料科学与工程学院,中国轻工业功能陶瓷材料重点实验室,景德镇333403)
添加NaBF4对阳极氧化法制备TiO2纳米管光催化剂的影响
王竹梅朱晓玲李月明*廖润华 沈宗洋
(景德镇陶瓷大学材料科学与工程学院,中国轻工业功能陶瓷材料重点实验室,景德镇333403)
在阳极氧化电解液中添加NaBF4制得了具可见光活性的B掺杂TiO2纳米管阵列(B/TNTs)。采用扫描电镜(FE-SEM)、能谱仪(EDS)、X射线衍射(XRD)、傅立叶红外光谱(FTIR)、紫外-可见漫反射光谱(UV-Vis DRS)以及X射线光电子能谱(XPS)对样品进行表征,以亚甲基蓝(MB)的光催化降解为目标反应评价其光催化活性。结果表明:添加NaBF4后,TiO2纳米管表面形貌变化较大;B掺入到TiO2晶格中形成B-O-Ti键;B掺杂使得TiO2纳米管表面羟基量增加、光学带隙能减小、光吸收阀值红移,且B掺杂量越多,其相应值的变化量越大;B掺杂能促进TiO2锐钛矿相的发育,纳米管经550℃煅烧后仍保持未掺杂样品的锐钛矿相结构;NaBF4的最佳添加量为0.6%(w/w)时,所得样品光催化活性最佳,可见光下光催化降解MB的4 h降解率由未添加的39.90%提高至75.15%,且反复使用10次后其光催化性能基本保持不变;总有机碳(TOC)分析结果表明,MB在可见光下能被B/TiO2有效矿化。
B掺杂;TiO2纳米管阵列;可见光;光催化活性
0 引言
电化学阳极氧化法制得的高度有序的二氧化钛(TiO2)纳米管阵列(TNTs)除了具有传统TiO2的催化活性高、价廉、耐腐蚀性强以及无污染等一系列优点外,还具有比表面积大、电荷传递快、容易回收再利用等诸多优点,因而利用TNTs光催化降解有机污染物被广泛研究[1-2]。但纯TNTs和其它形态的TiO2一样,存在禁带宽度大(锐钛矿3.2 eV,金红石3.0 eV)和电子迁移率低(10-4~10-5cm2·V·s-1)的问题,导致其可见光利用率和量子效率均很低,不能满足实际应用需求。拓展TiO2的光谱响应范围的途径主要有光活性染料表面敏化[3]、窄带半导体(如Fe2O3[2]、CdS[4]、CdTe[4]等)修饰、贵金属(如Au、Pt和Ag等)纳米颗粒沉积[4]及离子掺杂改性[4]等。其中,对二氧化钛进行非金属元素的掺杂改性是近年的研究热点,Asahi等[5]研究发现,经过非金属修饰改性后的二氧化钛在可见光区域有显著的响应,且表现出优异的光催化效率。常用的非金属掺杂元素有N[5-6]、B[7-8]、C[9-10]、卤素[11]等,对二氧化钛进行非金属元素改性可以产生新的杂化价态,光催化剂的带隙能可以得到一定程度的降低,进而达到可见光响应的目的。当TNTs在含NH4F的有机电解液(如丙三醇)中生成时,不仅生成的纳米管更长[12],而且还能在TNTs中掺入电解液中含有的非金属元素(如C、N和F)[6,8,10],这种掺杂方法比通过后处理方式掺杂获得的TNTs质量更好。另外,由于B原子半径小,更易掺杂进入TNTs[8],且TNTs中掺杂硼能抑制光生电子-空穴的复合[13],因而,Lu等[8]和Ratnawati等[14]在上述有机电解液中添加NaBF4,获得的B/TNTs有着较好的性能。但是,他们的研究均表明添加NaBF4后,纳米管的微观形貌没有明显变化,而本研究却发现微观形貌变化非常明显。另外,他们的研究并未进行表面基团,特别是与光催化性能密切相关的表面羟基吸附情况等的细致系统研究。本文通过在添加NaBF4的有机电解液中原位阳极氧化制备了B掺杂TNTs,系统研究了其微观结构、表面基团、光学性能与光催化活性之间的关联。
1 实验部分
1.1 B/TiO2纳米管制备
将纯度为99.5%的钛箔(10 mm×40 mm×0.1 mm)分别在丙酮、酒精和蒸馏水中超声清洗15 min,再化学抛光60 s(抛光液VHF∶VHNO3∶VH2O=1∶4∶2),最后用蒸馏水冲洗、自然晾干备用。以钛箔作阳极,石墨棒作对电极,阳极氧化面积为1 cm2,电极间距为4 cm,电解液为添加少量NaBF4的乙二醇、H2O和NH4F(物质的量之比为190∶31∶1)混合液,NaBF4加入量分别为0%(w/w,下同)、0.2%、0.4%、0.6%、0.8%,氧化电压60 V,氧化时间2 h,整个反应过程在室温(25℃)、磁力搅拌条件下进行,得到样品用适量乙二醇超声清洗30 s,再用蒸馏水冲洗、烘干后550℃热处理2 h,得到样品分别记为B0、B2、B4、B6、B8。
1.2 B/TiO2纳米管的表征
采用日立公司S-4800场发射扫描电子显微镜(SEM)观察样品的形貌,工作电压3 kV;采用OXFORD公司INCAX-sight型能谱仪(EDS)测定样品元素及其比例;用Bruker AXS D8 ADVANCE型X射线衍射仪(XRD)检测样品的晶相组成,工作电压40 kV,电流40 mA,Cu Kα(λ=0.154 18 nm),扫描角15°~70°;用美国热电公司Thermo escalab 250Xi型X射线光电子能谱仪(X-rayphotoelectron spectroscopy,XPS)分析样品的表面元素组成及化学态,真空度为10-9Pa,单色Al Kα射线,以污染C1s作结合能校正;用美国PerkinLmer公司Lambda 850型紫外-可见分光光度仪检测样品的紫外-可见漫反射分光光谱,波长范围为200~850 nm;采用美国热电集团Nicolet 5700型傅里叶红外光谱仪测定样品所带的表面官能团。
1.3 样品光催化活性测试
将pH值为2.10的10 mg·L-1亚甲基蓝(MB)与1 mol·L-1Na2SO4混合溶液作为模拟污染物,将样品浸入装有10 mL模拟污染物的透光性良好的小容器中,暗吸附30 min后,用上海第三分析仪器厂721型分光光度计在655 nm测试吸光度(A0)。然后用白炽灯(波长400~780 nm)在垂直于纳米管片方向照射4 h后取样3 mL测其吸光度(At)。由下式计算其降解率D:
D=(At-A0)/A0×100%
2 结果与讨论
2.1 B/TiO2纳米管阵列表面形貌及元素分析
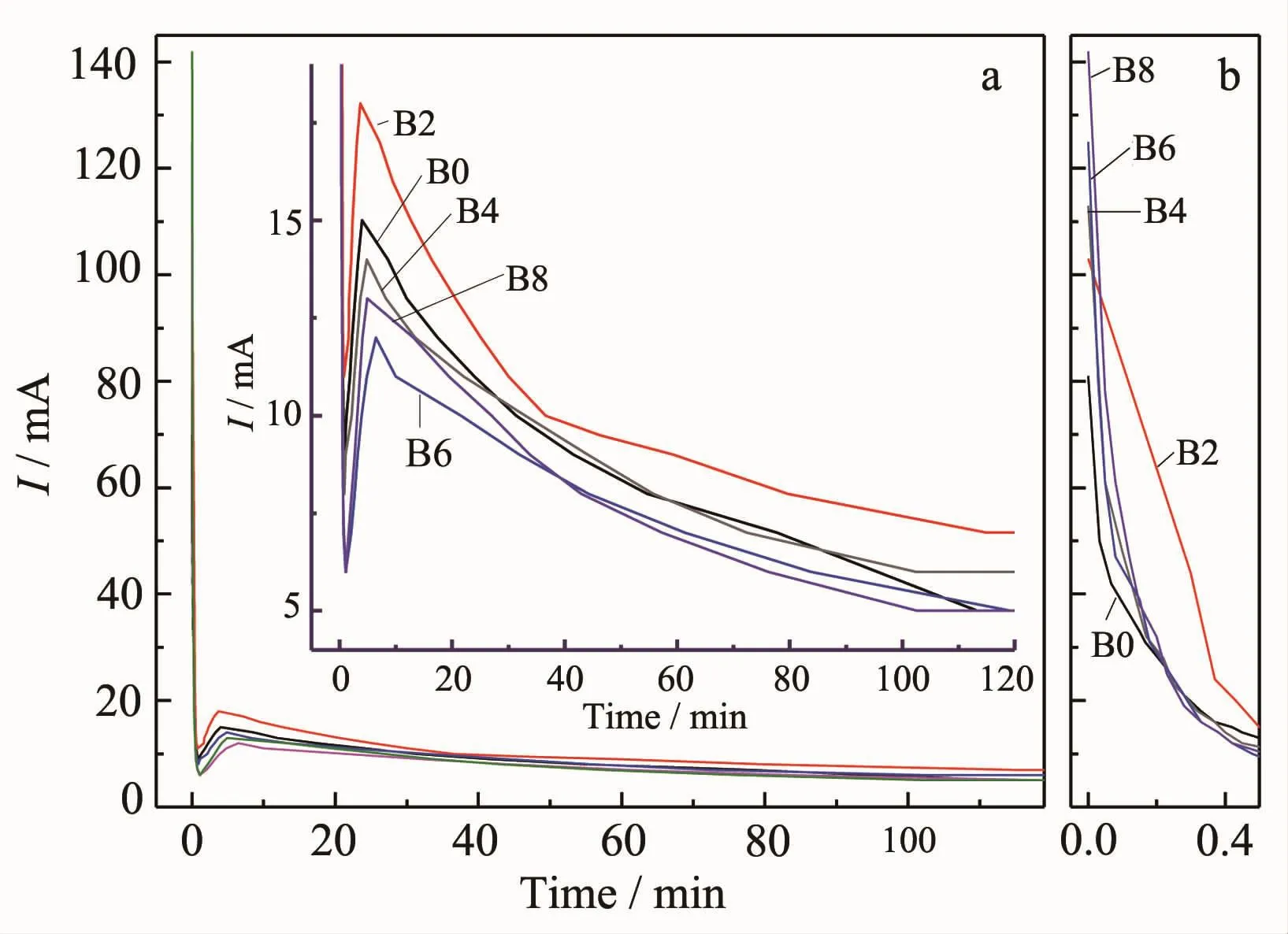
图1阳极氧化过程各样品的电流-时间曲线Fig.1Current-time curves of the samples in the anodic oxidation process
图1 为添加不同量NaBF4制备TNTs阳极氧化过程中的电流-时间曲线。由图可见,电流变化分3个阶段:(1)初始阶段:初始电流均较大,随后急剧下降;(2)再次上升又下降阶段;(3)平稳阶段。由初始时间段放大图(图1b)可见,初始时未添加NaBF4的B0电流最小,随着NaBF4添加量的增加,初始电流也随之增大,B8的初始电流最大,这是因为NaBF4在溶液中解离为Na+和BF4-,溶液的电导率增加导致的。由电流放大图(图1a)观察第二阶段可见,NaBF4添加量为0.2%的B2再次上升时电流最大,而当NaBF4添加量大于0.2%后,再次上升时电流不但比B2小,而且比B0也小,这可能是NaBF4的添加量较大时,会使电极表面钝化造成的。
图2为各样品(B0、B2、B4、B6、B8)表面SEM照片和EDS图谱。由图可见,未添加NaBF4的B0样品(图2a)每个纳米管之间连接紧凑,表面平整,其纳米管上端开口,内径70~140 nm,管壁厚15~30 nm;添加NaBF4量最少的B2样品(图2b)表面形成了一些深浅不一的圆孔,孔内和孔表面有许多无规则的颗粒状物体,这应该是由于0.2%NaBF4的添加,阳极氧化电流增大(图1b),腐蚀过程相对激烈,从而在形成纳米管的过程中,管内不但有纵向腐蚀,同时还伴随着横向腐蚀,致使表面部分腐蚀有些脱落、且大部分管坍塌形成的;随着NaBF4添加量增加至0.4% (B4,图2c),由于表面钝化(见图1分析),腐蚀没有B2样品激烈,从而形成了不太规则的纳米管,但大部分管内仍可观察到横向腐蚀造成的颗粒状物质;当NaBF4添加量增加至0.6%(B6,图2d)时,表面钝化更严重,腐蚀更缓慢,从而形成比较规则的纳米管,内径50~130 nm,管壁厚25~70 nm,单位面积中的纳米管个数明显比未添加NaBF4的B0样品少;当NaBF4添加量进一步增加至0.8%(B8,图2e)时,此时NaBF4量比较多,虽然BF4-刻蚀Ti和TiO2相对于F-更温和[15],但BF4-在溶液中解离形成F-的量不容忽视(BF4-+3H2O=H3BO3+4F-+3H+[16]),此时溶液的侵蚀能力增强,在钝化和侵蚀作用的双重作用下,最终形成的表面形貌与B0非常相似。上述B2、B4、B6及B8样品的形貌与Ratnawati等[14]报道的结果不一致,那是因为本研究中的NaBF4添加量是该文献的10倍左右,所以造成的影响较大。
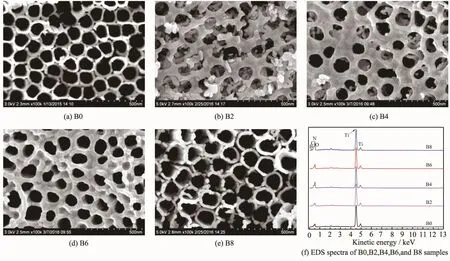
图2添加不同量NaBF4样品的SEM照片及EDS图谱Fig.2SEM images and EDS spectra of the samples with different NaBF4concentration
图2 (f)为各样品的EDS图谱表面元素组成,各样品包含元素Ti、O、C和N四种元素,其中元素C和N为阳极氧化过程中分别由乙二醇[8]和NH4F[6]引入;添加NaBF4的B2、B4、B6和B8样品均检测出B元素,其含量(原子百分数)分别为0.73%、1.96%、2.17%、1.44%。
2.2 纳米管阵列的晶型结构表征
图3为各样品(B0、B2、B4、B6、B8)的XRD图。由图可见,所有样品的衍射峰只有锐钛矿相TiO2(PDF#894921)和金属Ti(PDF#882321),金属Ti峰属于TNTs下层的钛基底,说明TNTs的晶型结构没有因NaBF4的添加而改变;对比25.4°的(101)晶面峰强可见,添加NaBF4各样品的该峰均不同程度增强了,B掺杂量最高的B6样品峰强最高,说明B掺杂能促进TiO2锐钛矿相的发育;由图3b可以看出,添加NaBF4后各样品的锐钛矿相主晶相峰均稍微往左偏移了,这是因为B取代了Ti,由于B的价态(B3+)和Ti(Ti4+)不一样,容易形成氧空位而导致晶格变大,或者是B掺入晶格间隙造成的,且峰偏移量的变化趋势也与B掺杂量的变化趋势一致(见XPS分析)。
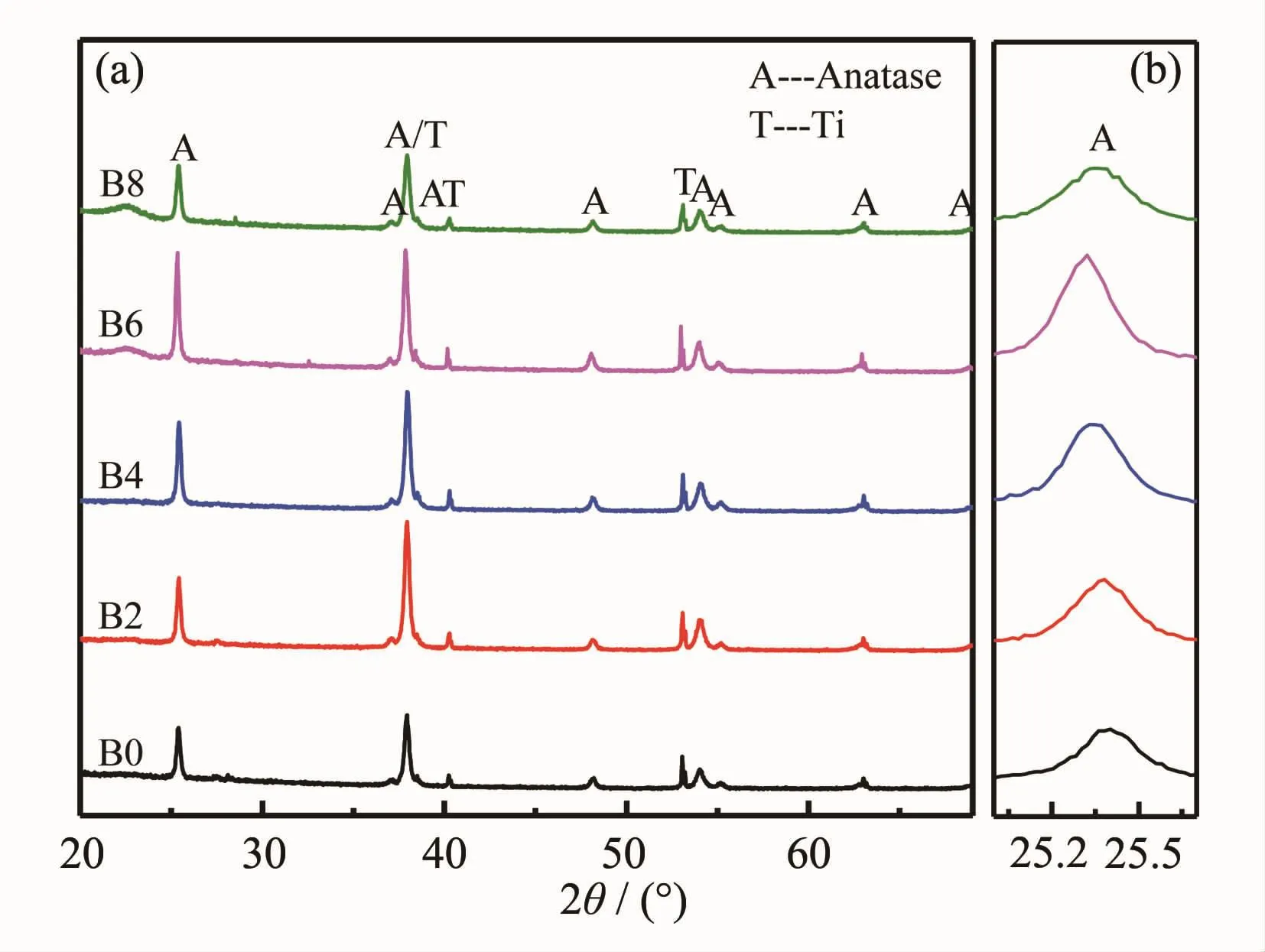
图3 添加不同量NaBF4制备样品的XRD图Fig.3XRD patterns of the samples with different NaBF4concentration
2.3 XPS分析
采用X射线光电子能谱(XPS)分别对各样品的表面元素组成及元素化学态进行了分析,其全谱分析见图4。由图可见,各样品中主要成分为Ti、O、C、N四种元素,其中,N、C来源见EDS分析;添加NaBF4的TNTs在191.4 eV结合能附近检测出B1s的特征峰。
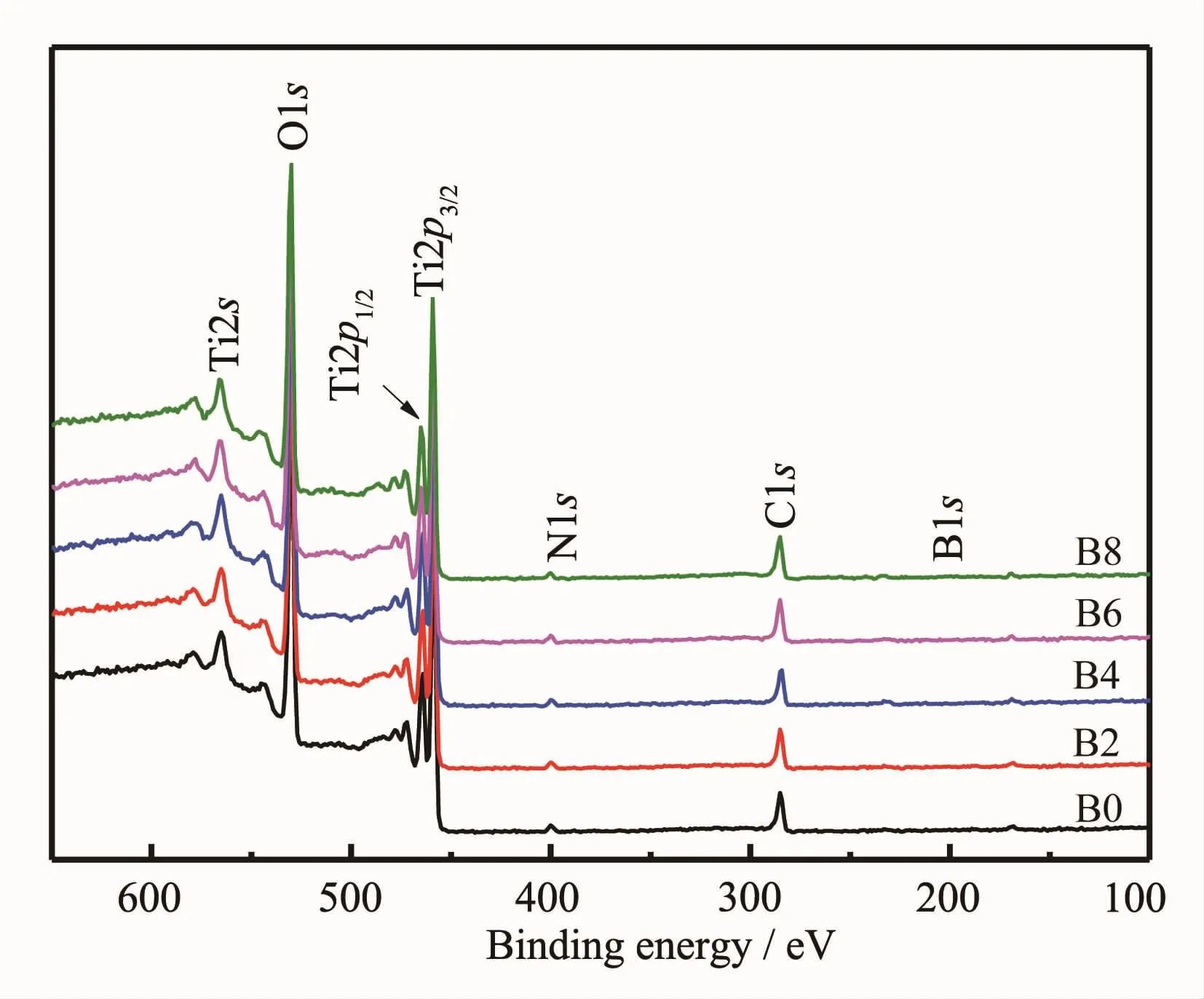
图4 添加不同量NaBF4制备样品的XPS全谱图Fig.4XPS survey spectra of the samples with different NaBF4concentration
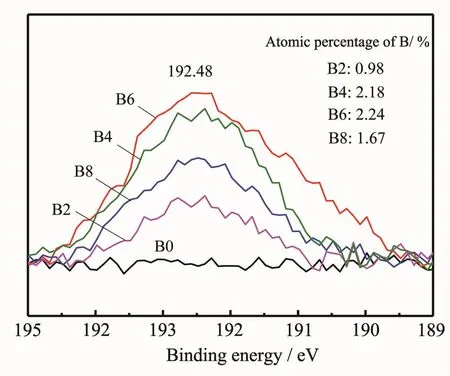
图5添加不同量NaBF4制备样品表面B1s的XPS能谱图Fig.5XPS spectra of B1s for the samples with different NaBF4concentration
图5 为添加不同量NaBF4样品表面B1s的XPS能谱图。由图可见,在结合能192.48 eV附近检测到添加NaBF4的样品出现了B1s峰。TiB2中Ti-B键B1s结合能为187.5 eV,B2O3中B-O键B1s结合能193.0 eV,图5中192.48 eV响应峰应该是TiB2和B2O3的结合状态Ti-O-B键结合能数据,这与相关文献报道的B掺杂TiO2的B1s峰((Ti-O-B-O-Ti))一致[17-20]。由图5还可看到,掺杂量随着NaBF4添加量的增加呈先增大后减小的趋势,B6样品最大,达2.24%,这是因为随着NaBF4添加量的增加,反应附着在纳米管表面的B也增加,但当NaBF4添加量过多(如添加0.8%)时,溶液的腐蚀能力增强,形成的纳米管多且管壁薄,从而使样品表面对B的反应吸附量减少。各样品的硼掺杂量与变化趋势均能验证EDS检测所得B含量结果。
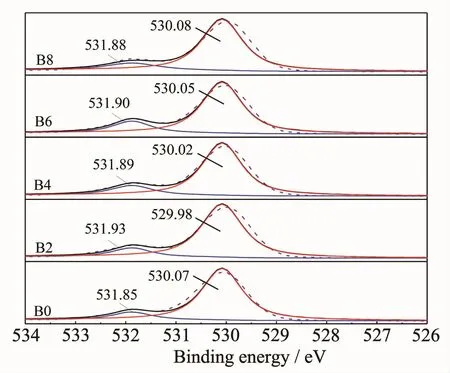
图6添加不同量NaBF4制备样品表面O1s的XPS能谱图Fig.6XPS spectra of O1s for the samples with different NaBF4concentration
图6 为各样品表面O1s的XPS能谱图。由图可见,O1s可拟合为2个峰,低结合能530.0 eV左右的峰(O1s峰2)对应的是Ti-O键;高结合能531.9 eV左右的肩峰(O1s峰1),为吸附在TiO2表面的羟基氧峰[21-22]。两峰面积的比例大小见表1。
由表1可见,B掺杂后,吸附在样品表面的羟基数量较未掺杂样品均增加了,说明B的掺杂,有利于促进TNTs表面活性羟基基团的增加,且基团数量随着NaBF4添加量的增加呈先增加后减小的趋势,这与B掺杂量的变化趋势一致(图5)。
2.4 FTIR分析
图7为各样品表面FTIR图谱。图7a中,1 635 cm-1附近的窄峰为TiO2表面吸附水分子的羟基O-H键的弯曲振动峰[23];1 445 cm-1附近的峰归属于Ti-O-B键的特征吸收峰[24];1 050 cm-1附近的小峰为N掺杂取代形成的N-Ti-O键[12];1 125 cm-1左右的小峰可能是C掺杂成为填隙原子形成的Ti-O-C键[25];由于FTIR分析是定性和半定量分析,且TiO2膜较薄导致测试得出的上述吸收峰峰强普遍偏小,因而只能确定官能团的存在与否,而各样品官能团的峰强对比不明显。由图7b可以看出,在750 cm-1左右区间有一个尖而强的吸收带,这是TiO2晶体表面的Ti-O键的伸缩振动和变角振动峰[26],对比TNTs(B0)和B/TNTs(B2、B4、B6、B8)在该区间的特征吸收峰位置,发现掺B使Ti-O的特征吸收峰向低波数发生微小偏移(图7b),这是因为掺杂元素B的原子数小于Ti,使得阴离子基团的吸收峰位置向低波数频移[27],B6样品的B掺入量最多(2.24%),该吸收峰的偏移量也最大。
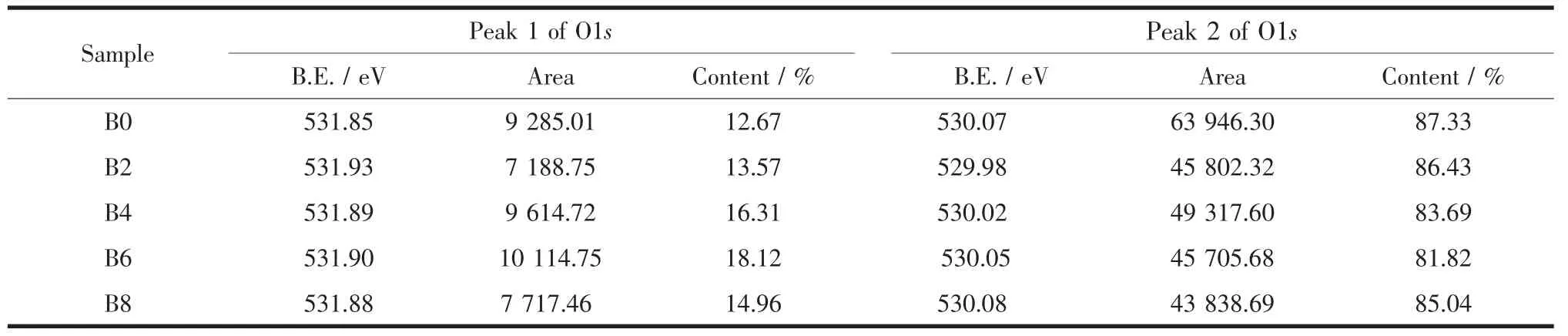
表1 添加不同量NaBF4制备样品表面O1s的XPS谱峰参数Table 1Peak parameters for O1s XPS spectra of the samples with different NaBF4concentration*
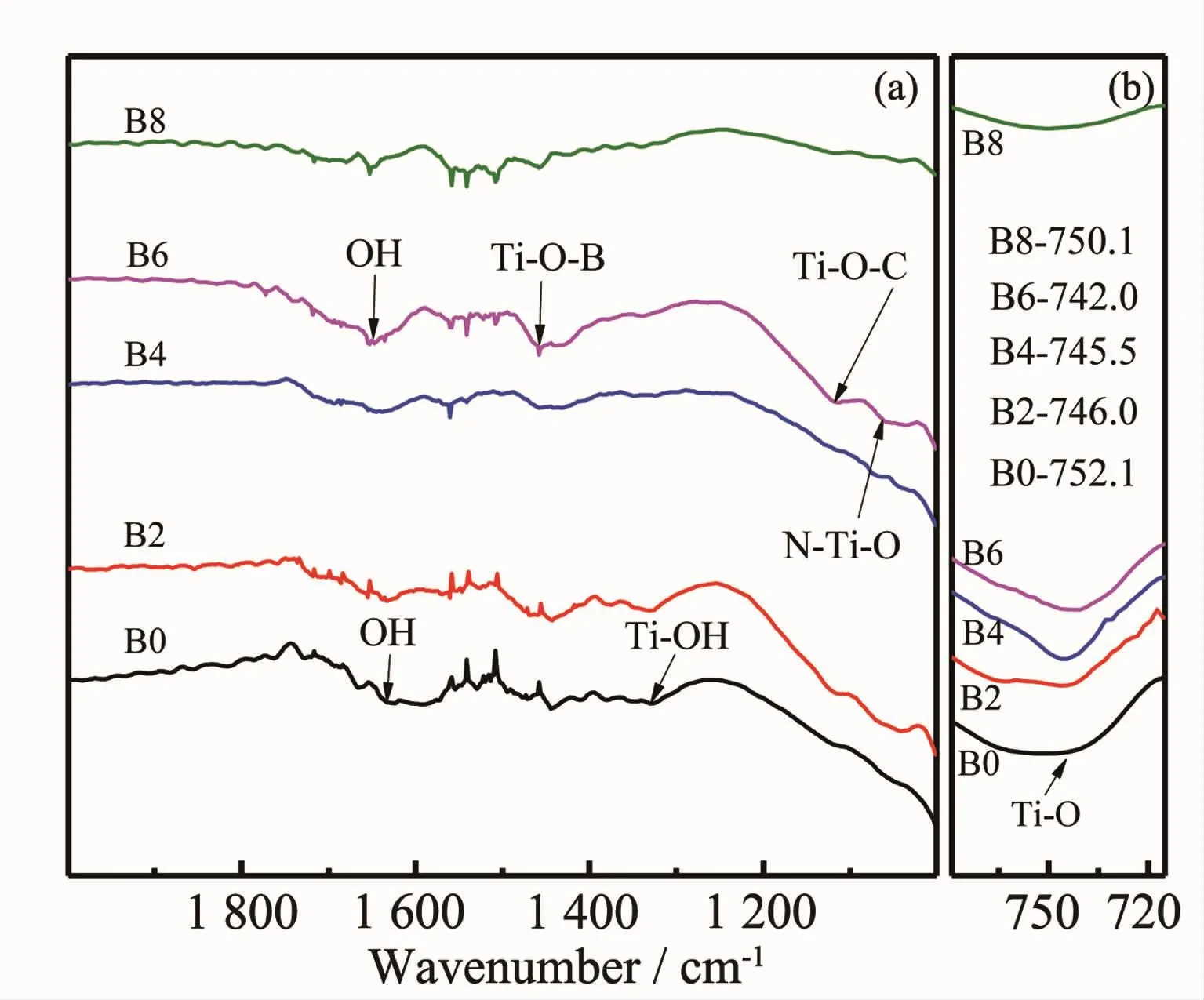
图7 添加不同量NaBF4制备样品表面的红外图谱Fig.7FTIR spectra of the samples with different NaBF4concentration
2.5 UV-Vis漫反射和带隙能分析
图8中的插图为各样品的UV-Vis漫反射图谱,图8为反射图谱经由Kubelka-Munk方程转换得到的谱线,图8中的插表列出了由谱线计算得出的各样品光学带隙值与光吸收阀值。未掺杂的TNTs(B0)光学带隙值为3.24 eV,与锐钛矿TiO2P25带隙值3.28 eV接近[14];随着NaBF4添加量的增加,B掺杂量先增加后减小(见XPS分析),光学带隙值和光响应阀值也相应变化,且B掺杂量越多变化越明显,如B4、B6样品的B掺杂量(原子百分数)分别为2.18%、2.24%,光学带隙值分别减小至3.05、3.01 eV,光吸收阀值分别红移至407、412 nm。
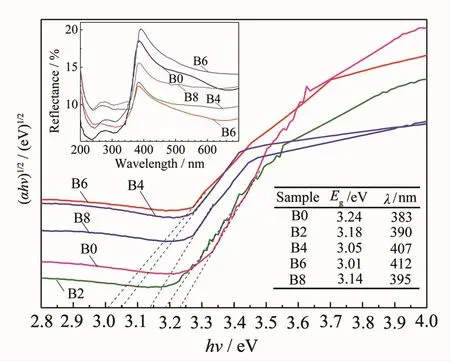
图8 添加不同量NaBF4制备样品的Kubelka-Munk转换谱线及UV-Vis漫反射图谱Fig.8Plots of the(αhν)1/2vs the energy of absorbed light and UV-Vis diffuse reflectance spectra of the samples with different NaBF4concentration
2.6 光催化结果分析
图9为各样品在可见光下的光催化活性及空白降解率(5%)。由图可见,B/TNTs样品的光催化活性呈先增加后减小趋势,B6光催化活性最高,达75.15%,比未掺杂样品高35.25%;除B2样品外,B/ TNTs样品的光催化活性均比未掺杂TNTs样品好。究其原因,一是B元素的缺电子特征,使TiO2表面的Lewis酸性增强,在光催化水溶液反应体系中,TiO2表面吸附的OH-数量增多,而OH-能捕获TiO2的光生空穴转化为·OH[28],从而提高TiO2的光催化活性[29-30],随着NaBF4添加量的增加,进入晶格的B含量先增大后减小,B6样品最多,表面活性基团Ti-OH所占比例也呈同样趋势(表1);二是B掺杂降低了B/TNTs的光学带隙值,特别是掺杂量比较大的B4和B6样品,带隙值降低较多,光吸收阀值红移,可见光的吸收能力增加,这也有利于提高光催化活性;三是B掺杂提高了B/TNTs锐钛矿相结晶度(见XRD分析),且B6样品最好,使得作为载流子复合中心的晶粒边界和非晶区减少了[31],这也有利于提高其光催化活性;四是纳米管的微观形貌,规则完好的微观形貌有利于光催化反应的进行,因而B6样品光催化活性最好。
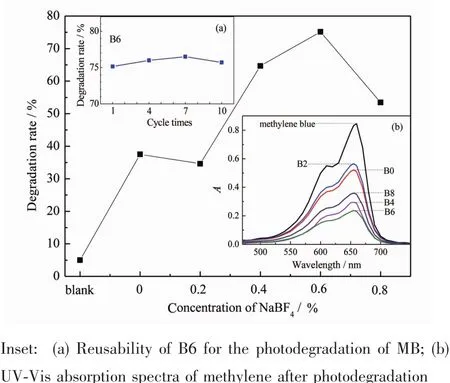
图9添加不同量NaBF4样品在可见光下光催化活性对比Fig.9Visible light photoactivities of the samples with different NaBF4concentration
图9 中的插图(a)为B6样品在可见光下降解MB 4 h的重复使用曲线。从图可以看出,B6纳米管重复使用10次后,其光催化降解能力基本保持在75%左右,同时其重量也没有明显损失,说明B/TiO2纳米管具有良好的重复使用性。图9插图(b)则为MB被不同B掺杂量样品降解前后的吸收光谱。由图可见,各样品降解MB前后溶液的吸收光谱的形状没有改变,只是峰强降低了,说明余下未降解的物质仍为MB,且未生成能在400~800 nm波长范围能检测到的有色中间产物。
图10为各样品在可见光下降解MB溶液的有机总碳量(TOC)与光照时间曲线。对比图8图和图9可见,溶液的矿化率与MB的降解率基本一致,说明MB降解后已完全矿化为无机小分子物质,没有生成其它有机中间产物。
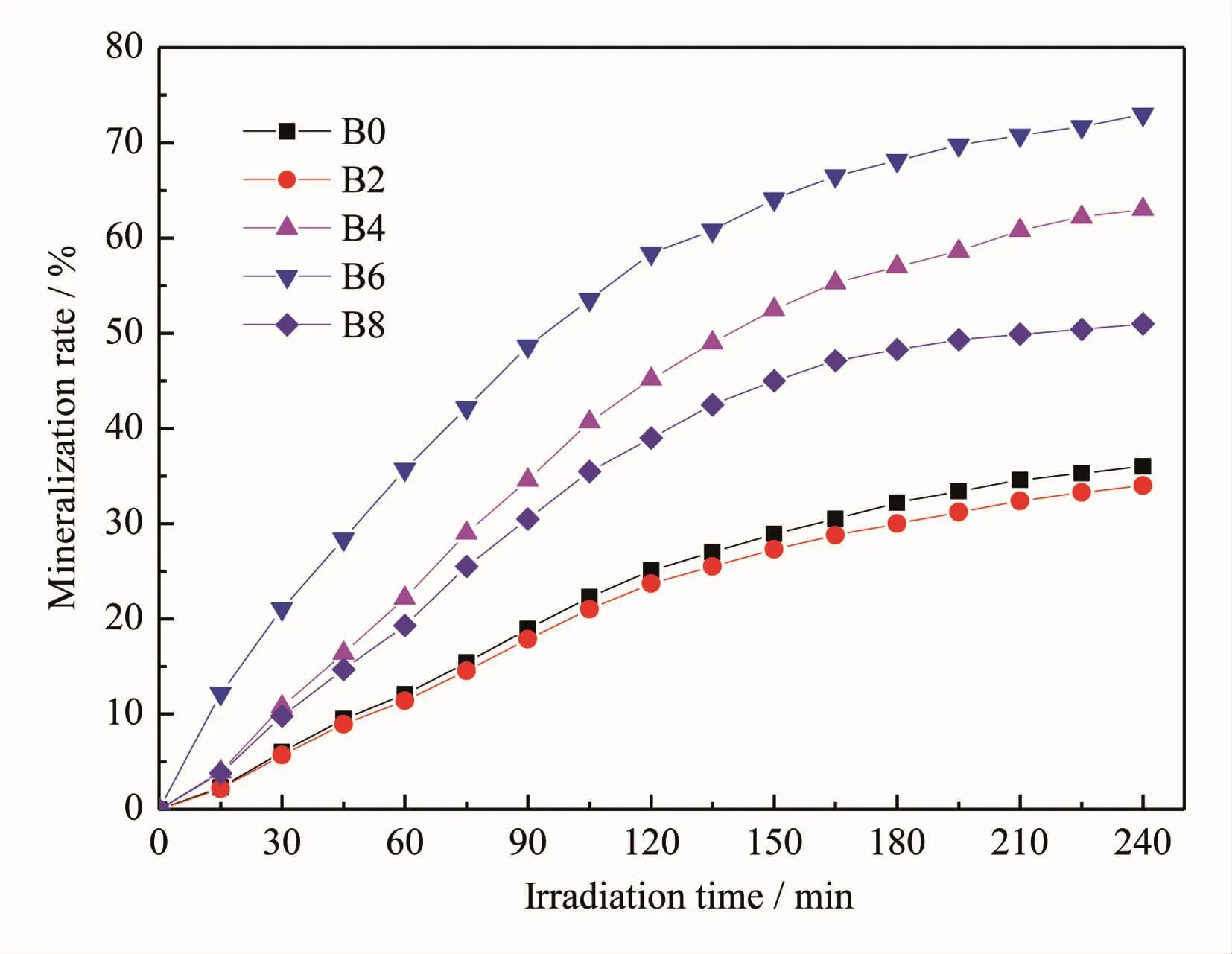
图10 添加不同量NaBF4制备样品在可见光下降解MB溶液的有机总碳量浓度变化Fig.10Total organic carbon(TOC)concentration changes for visible light photodegradation of MB by the samples with different NaBF4concentration
3 结论
(1)添加NaBF4后,B/TNTs表面形貌不同程度发生了变化;B掺入到TiO2晶格中形成B-O-Ti键;B掺杂使得B/TNTs表面羟基量增加、光学带隙能减小、光吸收阀值红移,且B掺杂量越多,其相应值的变化量越大;B掺杂能促进TiO2锐钛矿相的发育,B/ TNTs经550℃煅烧后仍保持未掺杂样品的锐钛矿相结构。
(2)NaBF4的最佳添加量为0.6%,光催化活性最佳,可见光下光催化降解MB 4 h的降解率由TNTs的39.90%提高至B/TNTs的75.15%,这是因为此条件下B/TNTs表面形貌最规则、表面B原子浓度最大、光学带隙能最小、光吸收阀值红移最多及表面吸附羟基量也最多。
(3)总有机碳(TOC)分析结果表明,MB在可见光下能被B/TNTs有效矿化;B/TNTs样品重复使用性能稳定,反复使用10次后光催化性能基本保持不变。
[1]Niraula M,Adhikari S,Lee D Y,et al.Chem.Phys.Lett., 2014,593(6):193-197
[2]HUAND Yi-Cao(黄益操),ZHAO Zhe-Fei(赵浙菲),LI Shi-Xiong(李世雄),et al.Chinese J.Inorg.Chem.(无机化学学报),2015,31(1):133-139
[3]So S,Hwang I,Schmuki P.Energy Environ.Sci.,2015,8(3): 849-854
[4]WANG Ying-Ying(王莹莹),CAI Jian-Huai(蔡健怀),SUN Lan(孙岚),et al.Chinese J.Inorg.Chem.(无机化学学报), 2012,28(4):647-656
[5]Asahi R,Morikawa T,Ohwaki T,et al.Science,2001,293 (5528):269-271
[6]Wu H J,Zhang Z H.Int.J.Hydrogen Energy,2011,36(21): 13481-13487
[7]Lin X X,Liu J,Fu D G.Adv.Mater.Res.,2014,860-863: 907-910
[8]Lu N,Zhao H M,Li J Y,et al.Sep.Purif.Technol.,2008, 62(3):668-673
[9]Parayil S K,Kibombo H S,Koodali R T.Catal.Today,2013, 199(1):8-14
[10]Hassan F M B,Nanjo H,Venkatachalam S,et al.J.Power Sources,2010,195(18):5889-5895
[11]Sun H Q,Wang S B,Ang H M,et al.Chem.Eng.J.,2010, 162(2):437-447
[12]Muhamed A E R,Rohani S.Energy Environ.Sci.,2011,4: 1065-1086
[13]Wu Y,Xing M,Zhang J,et al.Appl.Catal.B:Environ.,2010, 97(1/2):182-189
[14]Ratnawati,Gunlazuardi J,Dewi E L,et al.Int.J.Hydrogen Energy,2014,39(30):16927-16935
[15]Li H,Xing J,Xia Z,et al.Electrochim.Acta,2014,139(26): 331-336
[16]Nebergall W H,Translated by MA Wei(马维).General Chemistry(普通化学).Beijing:Peoples Education Press, 1979:286
[17]Zaleska A,Sobczak J W,Grabowska E,et al.Appl.Catal. B:Environ.,2008,78(1):92-100
[18]Gopal N O,Lo H H,Ke S C.J.Am.Chem.Soc.,2008,130 (9):27602761
[19]Zhao W,Ma W H,Chen C C,et al.J.Am.Chem.Soc., 2004,126(15),4782-4783
[20]hen D M,Yang D,Wang A Q,et al.Ind.Eng.Chem.Res., 2006,45(12):4110-4116
[2]Silversmit G,Doncker G D,Gryse R D.Surf.Sci.Spectra, 2002,9(1):21-29
[22]Liu Z L,Guo B,Hong L,et al.J.Phys.Chem.Solids,2000, 66(1):161-167
[23]Pang Y L,Abdullah A Z.Chem.Eng.J.,2013,214(1):129-138
[24]Liu G,Sun C,Cheng L,et al.J.Phys.Chem.C,2009,113 (28):12317-12324
[25]Parra R,Góes M S,Castro M S,et al.Agric.Biol.Chem., 2008,20(10):481-484
[26]Hu S,Wang A,Li X,et al.J.Phys.Chem.Solids,2010,71 (3):156-162
[27]YUAN Xin-Hua(袁新华),LIU Li-Ming(刘黎明),YING Wei-Bin(应伟斌).Chin.Spectrosc.Spectral Anal.(光谱学与光谱分析),2007,27(7):1355-1358
[28]Fujihira M,Satoh Y,Osa T.Bull.Chem.Soc.Jpn.,1982,55 (3):666-671
[29]SU Wen-Yue(苏文悦),CHEN Yi-Lin(陈亦琳),FU Xian-Zhi (付贤智),et al.Chin.J.Catal.(催化学报),2001,22(2):175-671
[30]Yeung K L,Yau S T,Maira A J,et al.J.Catal.,2003,219 (1):107-116
[31]Paulose M,Mor G K,Varghese O K,et al.J.Photochem. Photobiol.A:Chem.,2006,178(1):8-15
Effect of NaBF4Addition on the Preparation of TiO2Nanotubes Photocatalyst by Anodic Oxidation Method
WANG Zhu-MeiZHU Xiao-LingLI Yue-Ming*LIAO Run-HuaSHEN Zong-Yang
(China National Light Industry Key Laboratory of Functional Ceramic Materials,School of Materials Science and Engineering, Jingdezhen Ceramic Institute,Jingdezhen,Jiangxi 333403,China)
Visible light-active boron doped TiO2nanotube arrays(B/TNTs)were synthesized by adding NaBF4in anodic oxidation electrolyte.The photocatalytic properties to methylene blue(MB)solution were investigated under visible light irradiation.FE-SEM analysis showed that the morphology of B/TNTs was obviously different.EDS, XPS and FTIR analysis indicated that boron was incorporated into the TNTs lattice to form B-O-Ti bond.B doping could effectively promote the formation of active group Ti-OH on the surface of TiO2,decrease the band gap energy and make the absorption edges of the samples red-shifting.Such effect became stronger with the increase of the B doping concentration.XRD analysis indicated that B doping promoted the growth of anatase grains.The doped TiO2nanotubes can form anatase phase as pure one when calcined at 550℃.The B/TNTs with an optimal photocatalytic activity were fabricated with the NaBF4concentration of 0.6%(w/w).The photocatalytic degradation rate of MB in 4 h increased from 39.90%for TNTs without NaBF4addition to 69%for B/TNTs,and their photocatalytic degradation ability is basically unchanged after using 10 times.The total organic carbon(TOC) removal rates indicated that the MB can be efficiently mineralized under visible light illumination.
boron doping;TiO2nanotubes;visible light;photocatalytic activity
O643.36
A
1001-4861(2017)06-0970-07
10.11862/CJIC.2017.113
2016-12-02。收修改稿日期:2017-03-21。
国家自然科学基金(No.51462010)和江西省教育厅科学技术研究(No.51462010)资助项目。
*通信联系人。E-mail:lym6329@163.com
猜你喜欢
杂志排行
无机化学学报的其它文章
- CoAl2O4/蜂窝陶瓷催化剂的制备及其催化臭氧化性能
- Photocatalytic Hydrogen Production Based on Cobalt-Thiosemicarbazone Complex with the Xanthene Dye Moiety
- 两种金属-有机钙钛矿材料的负热膨胀性质
- Pyrazolate-Based Dipalladium(Ⅱ,Ⅱ)Complexes:Syntheses,Characterization and Catalytical Performance in Suzuki-Coupling Reaction
- 以滤纸为模板合成新型介孔生物活性玻璃微管材料
- Br-掺杂Bi2WO6的水热法合成及其可见光催化性能
