两株烟草黑胫病拮抗菌的筛选、鉴定和促生防病潜力评价
2017-07-05徐同伟周建云祖庆学文锦涛简胜义刁朝强曾庆宾陈德鑫
徐同伟,周建云,祖庆学,文锦涛,简胜义,胡 勇,刁朝强,曾庆宾,陈德鑫
(1.中国农业科学院烟草研究所,青岛 266100;2.贵州省烟草公司贵阳市公司,贵阳 550000;3.中国农业科学院研究生院,北京 100000;4.四川省烟草公司攀枝花市公司,四川 攀枝花 617026)
两株烟草黑胫病拮抗菌的筛选、鉴定和促生防病潜力评价
徐同伟1,3,周建云2,祖庆学2,文锦涛2,简胜义2,胡 勇2,刁朝强2,曾庆宾4,陈德鑫1*
(1.中国农业科学院烟草研究所,青岛 266100;2.贵州省烟草公司贵阳市公司,贵阳 550000;3.中国农业科学院研究生院,北京 100000;4.四川省烟草公司攀枝花市公司,四川 攀枝花 617026)
烟草黑胫病在我国烟区分布广泛,严重影响烟草的产量和质量。筛选出对烟草具有防病和促生作用的细菌是有效控制烟草黑胫病危害和提高烟草产量的重要途径。通过稀释涂布平板法、对峙培养法从烟草病株根际土壤中筛选出YBM-4和YJC-4两株细菌。根据分子形态学、最适生长条件和生理生化及16S rDNA基因序列分析比对结果,鉴定YBM-4是枯草芽孢杆菌(Bacillus subtilis),YJC-4是沙福芽孢杆菌(Bacillus safensis)。在对峙培养中,YBM-4和YJC-4细菌对烟草黑胫病菌丝的相对抑制率分别是85.34%和72.99%。在盆栽试验中,YBM-4和YJC-4对烟株生物量和农艺性状的促生作用明显,YBM-4、YJC-4和YBM-4+YJC-4混剂(比例1:1)对烟草黑胫病的平均防治效果分别是76.37%、80.06%和81.50%,病程进展曲线下面积(AUDPC)分别比对照降低265.01,281.58,287.32。表明细菌YBM-4和YJC-4具有潜在的利用和开发价值。
细菌;烟草黑胫病;拮抗;促生;生防潜力
病虫害是制约烟草产业可持续发展的重要因素,每年造成巨大的经济损失[1]。烟草黑胫病菌(Phytophthora parasitica var. nicotianae)是一种兼性寄生菌,喜高温高湿,主要危害烟株根部和茎基部,导致烟叶减产、品质降低,具有毁灭性危害[2]。目前对于该病的防控主要采用化学农药、抗病品种及一些栽培措施,但都有其缺陷性和局限性。采用拮抗菌也可以有效控制该病的危害[3-4],而且具有无污染、适应性强的特点,开发和利用潜力巨大,符合烟草根茎病害控制的发展方向。
芽孢杆菌在自然界中分布广泛,研究发现一些芽孢杆菌作为拮抗菌对烟草黑胫病具有良好的防治效果[5-6],作为促生细菌(PGPR)对烟株的产量有明显的提高作用[7-10]。其中枯草芽孢杆菌(B. subtilis)[11]、解淀粉芽孢杆菌(B. amyloliquefaciens)[12]和短小芽孢杆菌(B. pumilus)[13]等利用抗生、溶菌、竞争、重寄生作用抑制病原菌对植物的侵染和危害。短短芽孢杆菌(Brevibacillus brevis)[14]和多粘类芽孢杆菌(Paenibacillus polymyxa)[15]等通过改善烟株根际环境、平衡植物激素水平来促进烟叶的生长和发育。近些年拮抗菌的研究热度不减,但是针对烟草,既有抗病效果又有促生作用的研究较少,推广应用更是不足。
本研究从黑胫病病株的根际土壤中筛选出12株对黑胫病菌有较好防治效果的细菌。根据分子形态学、生理生化特性、基于16S rDNA序列构建的系统发育树,明确了生防效果最好的菌株YBM-4和YJC-4的系统分类地位,利用对峙培养和盆栽试验探究了两株细菌的生防和促生效果,以期为菌株的进一步开发利用提供理论指导。
1 材料与方法
1.1试验材料
供试烟草品种为红花大金元(易感品种),烟草黑胫病菌为0号小种,均由国家烟草改良中心提供。2015年7月从贵阳、攀枝花、西昌、潍坊、临沂、青岛等6烟区采集土壤87份,选取5~10 cm深处的黑胫病株根际土壤。其中YBM-4筛选自四川攀枝花烟区,YJC-4筛选自贵州贵阳修文烟区。
拮抗菌的培养和分离用NA和NB培养基;抑菌活性测定用燕麦培养基;生理生化性状测定用运动型培养基、柠檬酸盐琼脂培养基和葡萄糖肉汤培养基;Easy Pure Bacteria Genomic DNA Kit(北京全式金生物技术有限公司),革兰氏染色试剂盒(北京索莱宝科技有限公司);58%甲霜·锰锌可湿性粉剂(江苏灵宝化学有限公司),枯草芽孢杆菌可湿性粉剂(黑龙江德强生物股份有限公司)。
1.2试验设计
1.2.1 菌株的筛选和分离 参照Niemann的稀释涂布平板法[16],待测土壤除杂过筛后,称取5 g,加到100 mL锥形瓶中,用无菌水定容至50 mL,在恒温振荡培养箱中,28 ℃,200 r/min震荡1 h,使待测土样充分稀释均匀,静止沉淀后,取上清液1 mL梯度稀释至10-1~10-6倍,吸取各梯度溶液200 μL。用灭菌的涂布器均匀涂布在NA培养基上,37 ℃恒温培养48 h,空白对照用无菌水,3次重复。挑取生长性状不同的单菌落,多次平板培养和纯化,直到获得纯化的单菌落,甘油保存。
1.2.2 抑菌活性测定 采用对峙培养法[17],用直径5 mm的打孔器将烟草黑胫病菌接种到OA培养基的中点,在菌块离中心20 mm处对称两侧接种8 μL拮抗菌液(约1.0×106cfu/mL),倒置,在28 ℃恒温培养5 d,观察黑胫病菌周围有无抑菌带,并测量其抑菌直径大小d(mm),对照接种等量无菌水,其他均相同。相对抑菌率(%)=[(对照组菌落直径-处理组菌落直径)/对照组菌落直径]×100%。
1.2.3 分子形态学鉴定 (1)取样,将细菌分别接种到NB培养基中,28 ℃,120 r/min震荡培养48 h,取足量菌液3000 r/min离心。(2)固定:用2.5%的戊二醛和2%锇酸固定。(3)脱水处理:用乙醇的PBS溶液按30%,50%,70%,90%浓度梯度处理样品,后经100%乙醇和叔丁醇脱水处理。(4)冷冻干燥。(5)喷施Pt粉后,在电镜下观察YJC-4和YBM-4两种菌的分子形态结构。
1.2.4 生理生化特性鉴定 参照《植病研究方法》[18],利用革兰氏染色法检验细菌阳性/阴性,穿刺法检测运动性和明胶液化情况,1.5%二甲基对苯撑二胺检测细菌中的氧化酶,溴百里酚蓝(1.5%酒精溶液)检测柠檬酸盐,格里斯(Griess-llosvary)试剂法检测硝酸盐和N2,V-P试验检验细菌的阳性/阴性,甲基红试验检测糖代谢产酸的变化,溴百里酚蓝检测葡萄糖、果聚糖、淀粉的分解状况,观察7%氯化钠溶液中拮抗菌的生长状况。
1.2.5 分子生物学鉴定 (1)根据DNA提取试剂盒的步骤,取过夜培养的拮抗菌1 mL,经过细胞裂解、除杂和洗脱后,-20 ℃保存;(2)以799F(5'-AA CAGGATTAGATACCCTG-3')和R1492 (5'-GGTTA CCTTGTTACGACTT-3')为引物扩增菌株16S rDNA;(3)50 μL扩增体系:Template 1 μL,Reverse primer 1 μL,Forward primer 1 μL,2×Easy Tap®PCR Super Mix 25 μL,ddH2O 22 μL;(4)PCR反应体系:94 ℃,5 min;94 ℃,30 sec;55 ℃,30 sec;72 ℃,1 min;35个循环;72 ℃,10 min。(5)PCR产物序列测定后,利用BLAST软件进行同源性比较,用MEGA5.1的Neighbor-Joining法构建系统发育树。
1.2.6 促生盆栽试验 当红花大金元烟苗生长到5~6片叶时,取出后清水冲净,分别在两种拮抗菌液(约1.0×106cfu/mL)中浸根,30 min后取出并移栽到花盆中(上口径100 mm×高90 mm)。移栽后缓苗3 d,用同浓度的菌液对烟株灌根处理,10 mL/株,每次重复20株,3次重复,空白用等量的清水处理。在28 ℃,80%湿度的人工气候室中培养并观察。移栽后45 d,每个重复选取具有代表性的5株,测量整株鲜质量、干质量,根鲜质量、干质量,平均株高,平均根长,最大叶长,最大叶宽,分析拮抗菌对烟株生长量、农艺性状的促生效果。
1.2.7 盆栽试验防效 将配制好的两种菌液(约1.0×106cfu/mL)分成3个处理,处理1是YJC-4菌液、处理2是YBM-4菌液、处理3是YJC-4和 YBM-4菌液按体积比1∶1混合,分别对生长在盛有灭菌土壤的花盆(上口径100 mm×高90 mm)中的红花大金元烟苗(5~6片叶)灌根处理,同时接种黑胫病菌,每隔7 d,菌液灌根1次,共3次,用58%甲霜·锰锌和枯草芽孢杆菌作为对照,500倍液,对照用等量的无菌水,其他处理措施均相同。每个处理18株,3次重复。在第3次施药后7 d和 14 d调查发病率(%)、病情指数,相对防治效果(%)和病程进展曲线下面积(AUDPC)。分级标准严格按照中华人民共和国烟草行业标准(YC/T39—1996)规定执行。计算公式:病程进展曲线下面积(AUDPC)=∑[(Ai+Bi-1)/2](Ti-Ti-1),Ai和Bi-1表示病情指数,Ti和Ti-1表示两次调查结果的时间差[19]。
1.2.8 数据处理 采用DPS软件,Duncan新复极差法进行多重比较。
2 结 果
2.1拮抗菌的平板抑菌效果
图1可知,通过对峙培养法,YBM-4细菌对烟草黑胫病抑菌效果最明显,产生清晰的抑菌圈,菌丝稀疏,边缘受到抑制和溶解,最大抑菌直径是74.25 mm,相对抑制率为85.34%。其次为YJC-4,菌丝生长稀疏不均匀,最大抑菌直径是63.50 mm,相对抑制率72.99%,具有较好的抑菌效果。(其中A:对照组菌落直径d1=87.00 mm;B:YBM-4菌落直径d2=12.75 mm;C:YJC-4菌落直径d3=23.50 mm)。
2.2分子形态学鉴定
如图2所示,在扫描电子显微镜6×104倍下观察,YBM-4拮抗菌为椭圆柱状,内生芽孢,两头宽中间略窄,表面粗糙,灰暗不透明,大小为a1(0.38~0.66 μm)×b1(1.27~1.58 μm),YJC-4拮抗菌为圆柱状,内生芽孢,表面附有黏液,灰白色,大小为a2(0.31~0.47 μm)×b2(1.30~1.78 μm)。其中D为YBM-4,E为YJC-4拮抗菌。

图1拮抗菌YBM-4和YJC-4对烟草黑胫病菌的抑制作用Fig. 1 Inhibiting effects of stains YBM-4 and YJC-4 onPhytophthora nicotianae
2.3生理生化特性鉴定
如表1所示,YBM-4菌为革兰氏阳性菌,具有一定运动性,在V-P测验、甲基红试验显阳性,氧化酶、明胶液化呈阴性,可以利用柠檬酸盐和水解淀粉,在硝酸盐培养液中产生亚硝酸盐和N2,能够分解葡萄糖,不分解果聚糖,在7%氯化钠中生长良好。YJC-4菌为革兰氏阳性菌,具有运动性,在氧化酶、V-P试验和甲基红中显阳性,明胶液化显阴性,可以利用柠檬酸盐,不能水解淀粉,产生大量的亚硝酸盐和N2,分解葡萄糖、果聚糖,可以在7%氯化钠中正常生长。
2.4分子生物学鉴定
如图3所示,YBM-4和YJC-4菌的16S rDNA序列长度分别为635 bp、670 bp,将这两株菌的16S rDNA序列通过BLAST程序对比分析,YBM-4与枯草芽孢杆菌B. subtilis(KT985478.1)进化关系最近,同源性达99%,YJC-4与沙福芽孢杆菌B. safensis(JF411315.1)进化关系最近,同源性99%。根据分子形态学、生理生化特性和16SrDNA序列同源性分析,YBM-4鉴定为枯草芽孢杆菌,登录号为KX663829,YJC-4为沙福芽孢杆菌,登录号为KX663830。

表1 YBM-4和YJC-4两种菌株的生理生化特性Table 1 Physiological and biochemical characteristics of YBM-4 and YJC-4
2.5促生作用
2.5.1 两种拮抗菌对烟苗生物量的促生作用 如表2所示,移栽后45 d,2株细菌对烟株的整株鲜质量,整株干质量、根鲜质量、根干质量的促进作用明显。其中YBM-4细菌对干质量、根干质量的促进作用最明显,比对照分别增加59.93%、79.08%,茎部粗壮,叶色浓绿。YJC-4细菌处理的烟株促生作用也较好,整株鲜质量和干质量比对照分别增加48.66%和50%,根部鲜质量和根干质量分别增加31.62%和62.09%,根系比对照更浓密。YJC-4菌的整体促进效果略差于YBM-4,但差异不显著,与对照差异极显著,表明2株细菌可以有效促进侧根形成,烟苗的生长和物质的积累。
2.5.2 两种拮抗菌对烟株农艺性状的促生作用如表3所示,移栽后45 d,2株细菌对烟苗的株高、根长、最大叶长和最大叶宽的促进作用明显。其中YBM-4细菌对根长和株高的促进作用最明显,特别是促进主根系的生长,与对照相比,增长率分别是28.53%和12.41%,略高于YJC-4处理的烟苗2.94%和0.89%,两者差异不显著,与对照相比差异极显著。YBM-4细菌促进烟苗的叶长、叶宽增加6.85%和4.84%,略低于YJC-4处理的烟苗2.94%和0.89%,之间差异不显著,与对照相比差异显著。表明2株细菌可以有效促进烟苗的株高和主根系的伸长,增加叶片表面积。

图3拮抗菌YBM-4和YJC-4的16SrDNA序列系统发育树Fig. 3 Phylogenetic tree of strains YBM-4 and YJC-4 based on 16SrRNA gene sequence

表2拮抗菌对烟株生物量的促生作用Table 2 Antagonistic strains of tobacco biomass growth promoting effect

表3拮抗菌对烟株农艺性状的促生作用Table 3 Antagonistic bacteria on Agronomic Characters of tobacco plant growth promoting effect
2.6盆栽试验
如表4所示,施药后第7天调查表明,YBM-4、YJC-4和YBM-4+YJC-4混剂(比例1:1)与CK相比,防效分别为79.70%、81.17%和82.03%,与对照差异极显著。甲霜·锰锌处理的烟苗防效为84.67%,略好于3类细菌菌液,但差异性不显著,5组处理与对照相比差异性均显著。表明短时间内,5组处理对烟草黑胫病的防治效果均明显。第14天的调查表明,YBM-4+YJC-4混剂的防治效果最好,为80.97%,与甲霜·锰锌防治效果相当,差异不显著,其次为YJC-4和YBM-4,防效分别为78.94%和73.03%。甲霜·锰锌的病程进展曲线下面积比对照低288.78,表明甲霜·锰锌可有效推迟黑胫病的发生,有效缓解病情的加重和蔓延。其次为YBM-4+YJC-4混剂,比对照低287.32,两者差异不显著,枯草芽孢杆菌AUDPC最大,效果最差。综上所述,YBM-4+YJC-4混剂的防效明显,两种细菌混合后,相互作用,可有效增强对烟草黑胫病的防治效果,延缓和推迟病害的发生和扩散。
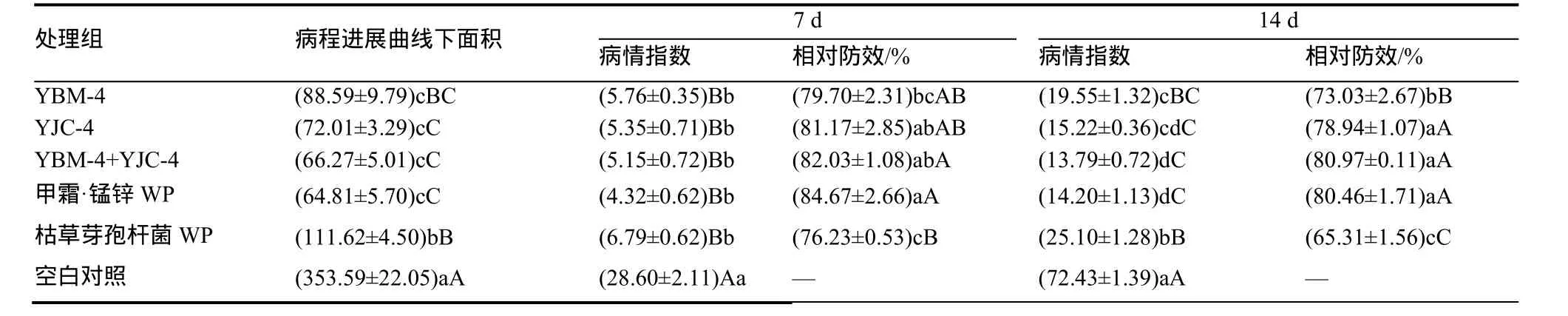
表4拮抗菌对烟草黑胫病的病程进展曲线下面积和盆栽试验防治效果Table 4 Control efficacy and AUDPC of strain YBM-4andYJC-4 on tobacco black shank in greenhouse
3 讨 论
枯草芽孢杆菌(B. subtilis)作为植物根际细菌,对烟苗的促进作用已有报道。易有金等[20]发现枯草芽孢杆菌B-001可有效定殖在根茎部,从而增加烟草幼苗根长、株高、叶长、叶宽和鲜质量。本试验研究表明,枯草芽孢杆菌YBM-4通过浸根、灌根2种方式侵入到烟苗根部周围,提高烟株根部的微生物活性,丰富菌群结构[21]。接种YBM-4细菌45 d后,与对照相比烟苗的根系发达、茎秆粗壮,有利于营养物质和所需矿质元素的吸收,从而提高烟叶的产量和品质。沙福芽孢杆菌此方面的研究鲜有报道,沙福芽孢杆菌YJC-4与枯草芽孢杆菌YBM-4相比,促进叶长叶宽、增加叶片表面积效果更好,但差异性不显著。YJC-4细菌应用潜力较大,具有深入研究的必要性。
与植物相关的芽孢杆菌,分为植物病原菌、生防菌和腐生菌三类。王进等[11]发现枯草芽孢杆菌21b对烟草黑胫病菌的抑制率达78.33%。本试验2次调查结果表明,在施药后第7 d,YJC-4和YBM-4作为单菌剂,YBM-4+YJC-4作为混合菌剂,甲霜·锰锌作为化学药剂,均可有效控制烟草黑胫病的发生和蔓延。施药后第14 d,防效均有所减弱,特别是枯草芽孢杆菌菌剂效果最差,防效只有65.31%。但YBM-4+YJC-4混合菌剂的防治效果较好,为80.97%,AUDPC比对照降低287.32,表明两种拮抗菌及其混剂的防效可在长时间内发挥作用,延缓黑胫病的发生和扩展,且防治作用明显。但是由于受复杂环境的影响,气候、雨水、温度等对拮抗菌的生长和定殖能力都会造成各种阻碍,因此,拮抗菌的大田应用效果需要进一步验证。
4 结 论
拮抗菌的应用和发展是生物防治的一种重要手段和方法,其中芽孢杆菌具有分布广、抵抗力强等特点。本研究筛选的两株芽孢杆菌,YJC-4和YBM-4能有效防治烟草黑胫病,促进烟苗的生长与发育等优点,效果持久,具有潜在的研究和应用价值,为烟草黑胫病的生物防治提供了新的资源。
[1] 陈云堂,郭东权,王娟娟,等. 辐照技术在我国烟草中的应用研究进展[J]. 中国烟草科学,2011,32(2):90-95.
[2] 中国农业科学院烟草研究所. 中国烟草栽培学[M]. 上海:上海科学技术出版社,1987:281-284.
[3] 汪汉成,王茂胜,黄艳飞,等. 烟草青枯病拮抗菌株X-60的分离鉴定及其表型组学分析[J]. 植物病理学报,2016(3):409-419.
[4] 舒晓玲,吴毅歆,周惠萍,等. 烟草疫霉生防细菌的筛选及鉴定[J]. 中国烟草科学,2012,33(4):60-64.
[5] SHEN S S, CHOI O H, PARK S H, et al. Root colonizing and biocontrol competency of serratia plymuthica A21-4 against phytophthora blight of pepper[J]. The Plant Pathology Journal, 2005, 21(1): 64-67.
[6] WELLER D M. Biological control of soil-borne plant pathogens in the rhizosphere with bacteria[J]. Ann Rev Phytopathol, 1998, 26: 397-407.
[7] FULCHIEIR M, LUCANGELI C, BOTTINI R. Inoculation withAzospirillum lipoferumaffect growth and gibberellin status on corn seedling roots[J]. Plant Cell Physiol, 1993, 34(8): 1305-1309.
[8] WELLER D M. Biological control of soil borne plant pathogens in the rhizosphere with bacteria[J]. Ann. Rev. Phytopathol., 1988, 26: 379-407.
[9] 田华,陈光勇,董瑜,等. 毁灭炭疽菌诱抗蛋白的分离纯化及对烟草抗病促生作用[J]. 中国烟草科学,2016,38(4):68-73.
[10] 杨珍福,吴毅歆,陈映岚,等. 烟草拮抗内生细菌的筛选与防病促生长效果[J]. 中国烟草科学,2014,35(6):48-53.
[11] 王进,黄艳飞,汪汉成,等. 烟草疫霉拮抗菌枯草芽孢杆菌21b菌株的分离鉴定及其生物学特性研究[J]. 微生物学通报,2014(12):2481-2487.
[12] 曾衡,徐迪红,冀志霞,等. 烟草黑胫病生防菌的筛选、定殖及应用评价[J]. 应用与环境生物学报,2015(4):672-677.
[13] 王静,常平,孔凡玉,等. 拮抗细菌AR03在烟草根部及根际土壤中的定殖与鉴定[J]. 中国烟草科学,2010,31(3):45-48,53.
[14] 朱忠彬,吴秉奇,丁延芹,等. 短短芽孢杆菌DZQ3对烟草的促生及系统抗性诱导作用[J]. 中国烟草科学,2012,33(3):92-96,106.
[15] 吴秉奇,梁永江,丁延芹,等. 两株烟草根际拮抗菌的生防和促生效果研究[J]. 中国烟草科学,2013,34(1):66-71.
[16] NIEMANN H, LOSEKANN T, et al. Novel microbial communities of the Haakon Mosby mud volcano and their role as a methane sink[J]. Nature, 2006, 443(5227):854-858.
[17] 冯志珍,陈太春,段军娜,等. 烟草黑胫病拮抗根际芽孢杆菌FB-16的筛选鉴定及其抑菌活性[J]. 植物保护学报,2012(3):224-230.
[18] 方中达. 植病研究方法[M]. 北京:中国农业出版社,1996:204-211.
[19] DANNON E A, WYDRA K. Interaction between silicon amendment, bacterial wilt development and phenotype ofRalstonia solanacearumin tomato genotypes[J]. Physiological and Molecular Plant Pathology, 2004, 64(5): 233-243.
[20] 易有金,肖浪涛,王若仲,等. 内生枯草芽孢杆菌B-001对烟草幼苗的促生作用及其生长动态[J]. 植物保护学报,2007(6):619-623.
[21] SANG M K, KIM D K. Plant growth-promoting rhizobacteria suppressive to blight affect microbial activities and communities in the rhizosphere of pepper (Capsicum annuum L.) in the field[J]. Applied Soil Ecology, 2012, 62: 88-97
Screening, Identification, Biocontrol and Growth-promoting Potential Evaluation of Two Bacterial Strains against Tobacco Black Shank
XU Tongwei1,3, ZHOU Jianyun2, ZU Qingxue2, WEN Jintao2, JIAN Shengyi2, HU Yong2, DIAO Chaoqiang2, ZENG Qingbin4, CHEN Dexin1*
(1. Tobacco Research Institute Chinese Academy of Agricultural Sciences, Qingdao 266100, China; 2. Guiyang Tobacco Company, Guiyang 550001, China; 3. Graduate School of Chinese Academy of Agricultural Sciences, Beijing 100081, China; 4. Panzhihua Branch of Sichuan Tobacco Company, Panzhihua, Sichuan 617026, China)
Tobacco black shank is widely distributed in tobacco growing areas in China and has serious effects on tobacco production and quality. One of the potential control approaches against tobacco black shank is to use antagonistic bacterial. Using the culture plate dilution method, YBM-4 and YJC-4, two bacterial strains were isolated from tobacco rhizosphere soil to have an antagonistic effect on tobacco black shank. Based on comprehensive analysis on morphology, biological traits and physiological and biochemical characteristics, and 16S rDNA gene sequence analysis, YBM-4 was identified asBacillus subtilisand YJC-4 was identified asBacillus safensis. The two strains of YJC-4 and YBM-4 had significant antagonism against tobacco black shank. In paired cultures, relative inhibition rate of YJC-4 and YBM-4 reached 85.34% and 72.99%. In the pot experiment, effects of YBM-4 and YJC-4 on tobacco agronomic traits and biomass growth promoting were obvious. The control effects on tobacco black shank of YBM-4, YJC-4 and YBM-4+YJC-4 mixture (1:1 ratio) were 76.37%, 80.06% and 81.50%, with the AUDPC lower than that of the control group by 265.01, 281.58, and 287.32 respectively. YBM-4 and YJC-4 have a potential in bio-control of tobacco black shank.
bacteria; tobacco black shank; antagonism; growth; biocontrol potential
S435.72
1007-5119(2017)03-0044-07 DOI:10.13496/j.issn.1007-5119.2017.03.008
贵州省烟草公司贵阳市公司重大专项“贵阳烟草主要病虫草绿色防控技术集成示范与推广”(201602);中国烟草总公司四川省公司科技项目“烟草主要病虫害绿色防控技术研究与应用”(SCYC201604)
徐同伟(1990-),男,硕士研究生,主要研究方向是植物病害防治。E-mail:xutongwei123@126.com。*通信作者,E-mail:13963973187@126.com
2016-11-22
2017-03-24
