刺五加多糖对Lewis荷瘤小鼠抗肿瘤免疫调节作用及机制的研究①
2017-07-05周丽菁龙婷婷鲍依稀
周丽菁 龙婷婷 周 星 鲍依稀
(重庆医科大学附属第二医院检验科,重庆400010)
·中医中药与免疫·
刺五加多糖对Lewis荷瘤小鼠抗肿瘤免疫调节作用及机制的研究①
周丽菁 龙婷婷 周 星 鲍依稀
(重庆医科大学附属第二医院检验科,重庆400010)
目的:探讨刺五加多糖(ASPS)对Lewis荷瘤小鼠TLR4信号转导通路的调控机制。方法:用C57BL/6建立Lewis实体型荷瘤小鼠模型,随机分为生理盐水组(NS组)、阿霉素组(ADM组)和ASPS低、中、高剂量组,灌胃给药25 d后,称重计算瘤重、抑瘤率、胸腺指数和脾脏指数。收集荷瘤小鼠眼球血,ELISA检测外周血中细胞因子TNF-α、IL-1β、IL-6和IL-12p70的分泌情况。采用实时荧光定量PCR(Q-PCR)和Western blot法分别检测荷瘤小鼠脾细胞中TLR4相关节点TLR4、MyD88、TRAM、TRAF6、NF-κB p65、AP-1基因和蛋白的表达水平。结果:与NS组相比,ASPS中剂量组荷瘤小鼠的瘤重明显降低,抑瘤率和免疫器官指数显著升高(P<0.05)。与NS组相比,ASPS显著促进荷瘤小鼠外周血TNF-α、IL-1β和IL-6的分泌(P<0.05),对IL-12p70的产生无显著影响(P>0.05)。ASPS显著上调TLR4信号通路中TLR4、MyD88、TRAF6、NF-κB p65、AP-1基因和蛋白在荷瘤小鼠脾脏中的表达(P<0.05),而对TRAM无显著作用(P>0.05)。结论:TLR4信号通路可能是ASPS在Lewis荷瘤小鼠体内发挥免疫调节及抑制肿瘤作用的通路之一。
刺五加多糖;肺腺癌;免疫调节;TLR4信号通路
据2000年世界卫生组织统计报告,肺癌成为当今世界对人类生命健康危害最大的恶性肿瘤。其中肺腺癌占据首位,且目前常用治疗手段的疗效不理想,5年生存率仅约10%左右[1,2]。抗肿瘤化疗药物毒副作用大,长期使用容易产生耐药,中药因其疗效好毒副作用少,在肿瘤的治疗中体现了独特的优势[3]。近年来,免疫类中药多糖因其具有调节机体免疫功能、抗肿瘤活性显著和毒副作用小等特点被广泛应用于临床辅助治疗[4]。刺五加为五加科五加属植物刺五加[Acanthopanax Senticosus(Ruper.Et Maxim)Harms]是一味珍贵的中国传统中药,《本草纲目》将其列为“本经上品”,具有益气健脾、补肾安神、益经壮骨等功效[5]。刺五加多糖(Acanthopanax Senticosus polysaccharides,ASPS)是中药刺五加的免疫活性成分,是由葡萄糖、果糖、木糖、阿拉伯糖等成分组成,它分为水溶性多糖和碱溶性多糖两大类[6]。ASPS具有免疫调节、抗肿瘤、抗氧化和降低血糖等广泛的生物活性作用以及低毒性等优点,以其为主要成分的药物已经广泛应用于临床[7]。
有研究表明,许多中药多糖的免疫调节作用与Toll样受体(Toll-like receptors,TLRs)信号通路有关[8-10]。其中TLR4在中药多糖主导的免疫调节和细胞因子释放等功能中发挥重要作用[11,12]。基于以上研究,本实验拟采用刺五加多糖作用于Lewis实体型肺腺癌荷瘤小鼠的体内实验,观察ASPS在荷瘤小鼠体内免疫调节和抗肿瘤活性,同时探讨其对TLR4信号通路的调节机制。
1 材料与方法
1.1材料
1.1.1仪器与试剂 ASPS(购自西安源森生物科技有限公司)纯度为80%,无菌生理盐水溶解后4℃保存备用。ELISA检测试剂盒购自北京四正柏生物科技有限公司;组织总RNA提取试剂盒,逆转录试剂盒RR047A以及SYBR Premix Ex TaqTMⅡ(TaKaRa公司);荧光定量PCR仪(Bio-Rad CFX96);兔抗小鼠TLR4、MyD88、NF-κB和AP-1抗体(Cell Signal Technology公司);兔抗小鼠TRAM和TRAF-6抗体(Abcam公司);辣根过氧化物酶标记的羊抗小鼠IgG(H+L)抗体、鼠抗β-actin抗体,羊抗兔IgG-HRP(博士德公司)等。
1.1.2实验动物与肿瘤 SPF级C57BL/6小鼠50只,6~8周龄,体重(20±2)g,购自重庆医科大学实验动物中心,许可证号SYXK(渝)2012-0001;Lewis鼠源性肺腺癌细胞株(Lewis lung carcinoma cells,LLC)由第三军医大学新桥医院中心实验室提供。
1.2方法
1.2.1Lewis实体型荷瘤小鼠模型构建 从液氮中取出冻存的Lewis肺癌细胞株,复苏后体外扩大培养。在无菌条件下,收集处于对数期生长的Lewis细胞,用灭菌生理盐水稀释成1×106个/ml细胞悬液,于每只小鼠的右侧腋窝下接种0.2 ml[13]。以造模5~7 d后,接种处肿瘤平均直径(MD)为5 mm为造模成功,成功率约为100%。
1.2.2模型动物分组及处理 将50只Lewis荷瘤小鼠随机分成5组,每组10只,分为生理盐水组(NS组),阿霉素组(ADM组),ASPS低剂量组[50 mg/(kg·d)],ASPS中剂量组[200 mg/(kg·d)]和ASPS高剂量组[600 mg/(kg·d)]。接种Lewis细胞后次日各组开始按剂量灌胃,每只每天灌胃体积均为0.2 ml。ADM组以4 mg/(kg·d)连续腹腔注射3 d后灌喂生理盐水,灌胃体积同上。给药后每天观察小鼠毛色、食欲、活动和排泄等一般状况。连续给药25 d后,称量各组小鼠体重,眼球取血,颈椎脱臼处死小鼠,于无菌环境下完整剥离肿瘤、脾脏及胸腺进行称重,液氮保存脾脏组织,分离的血清置于-20℃保存。计算胸腺指数、脾脏指数和抑瘤率。脏器指数(%)=脏器重量/体重×100%;抑瘤率(%)=(1-实验组平均瘤重/对照组平均瘤重)×100%。根据以上指标评估ASPS对肺癌小鼠的作用,并选择最适药物剂量。
1.2.3ELISA法检测荷瘤小鼠外周血中细胞因子的分泌水平 收集荷瘤小鼠眼球全血,3 000 r/min离心10 min,吸取上层血清,用ELISA法检测细胞因子的分泌水平,具体操作步骤参照ELISA试剂盒说明书进行操作。
1.2.4Q-PCR检测TLR4信号通路关键节点基因表达水平
1.2.4.1脾脏组织总RNA的抽提及cDNA的合成 取约20 mg脾脏组织,液氮研磨至细粉末状后加入含有50 DTT Solution的Buffer RL裂解液,用TaKaRa miniBEST总RNA提取试剂盒抽提小鼠脾脏组织总RNA。用紫外分光光度计(Beckman,DU730)检测RNA的浓度及纯度,用琼脂糖凝胶电泳检测其完整性。使用TaKaRa RR047A逆转录试剂盒将RNA逆转录成cDNA于-20℃保存。
1.2.4.2Q-PCR各引物最佳退火温度 实验所用引物由上海英骏生物技术有限公司设计合成(引物序列见表1)。采用温度梯度法摸索每对引物的最佳退火温度,整个Q-PCR采用10 μl反应体系:5 μl SYBR Premix Ex TaqTMⅡ;1 μl引物(上下游引物浓度均为500 nmol/L);1 μl的cDNA和3 μl的RNA-Free水。反应条件为95℃ 30 s,95℃ 5 s,T ℃(各引物的退火温度)30 s,共40次循环以及软件自带的溶解曲线检测程序(用以观察扩增产物的特异性和引物的有效性)。由于各引物在58℃都有较好的扩增效率,最终选定58℃为所有引物的退火温度。
1.2.4.3引物扩增效率的检测 将温度梯度扩增的cDNA产物用RNA-Free水稀释1 000倍后作为标准品,再按1∶10倍比稀释6份不同浓度的标准品。采用双复孔扩增后,由Bio-Rad CFX Manager software计算得出各引物的扩增效率,实验重复性在0.990以上。
每对引物经上述操作步骤后,其扩增效率由Bio-Rad Manager software自动算出,如表1所示,其中包括:扩增效率(E%)和可重复性(R2)。
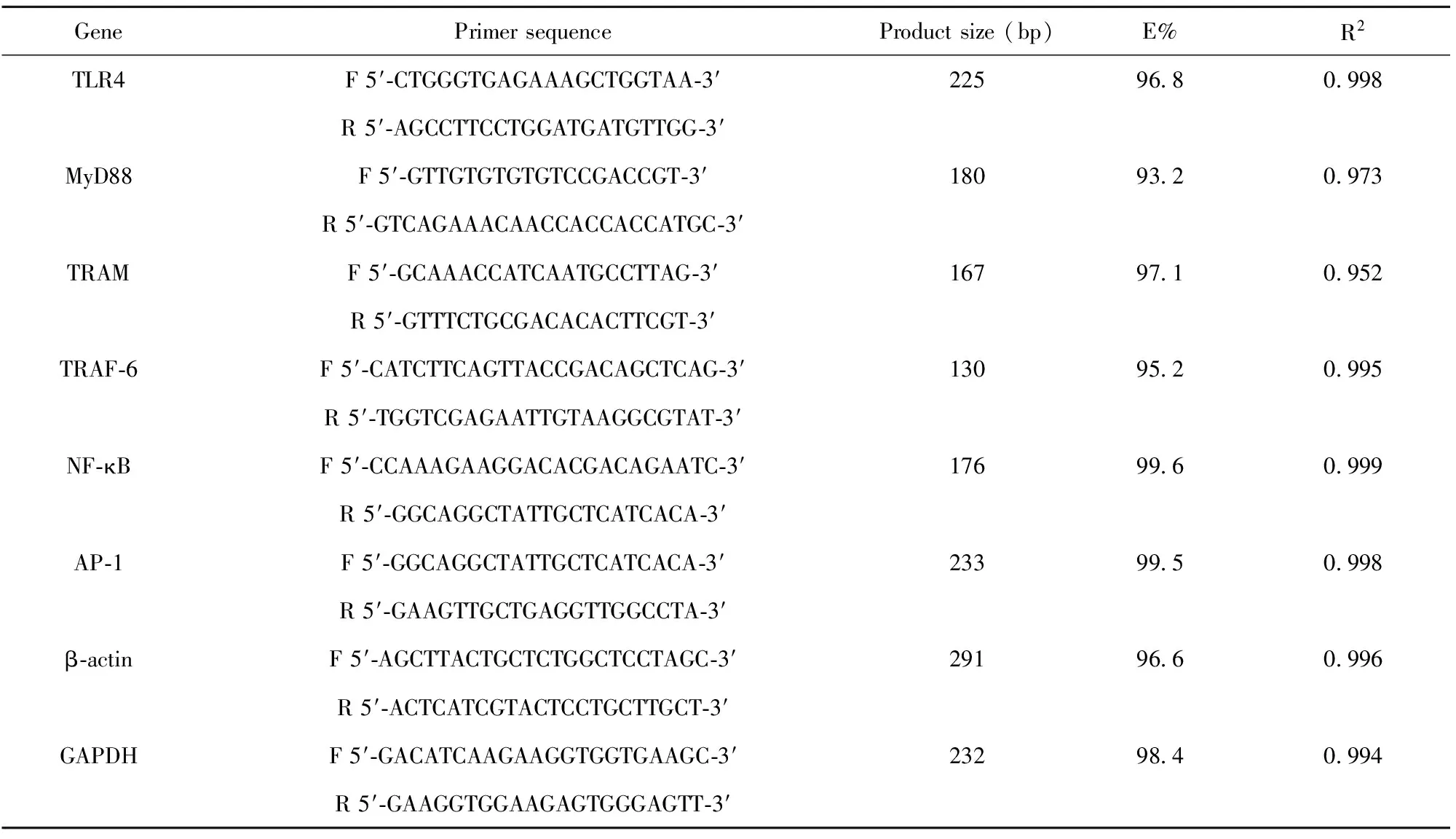
表1 Q-PCR使用的各引物序列及相关信息
1.2.4.4Q-PCR检测基因相对表达量 采用β-actin和GAPDH作为内参基因,按照上述反应体系和条件,在58℃退火温度下进行扩增,用Vandesompele双内参扩增效率法对目的基因的表达进行数据分析。
1.2.5Western blot法检测TLR4信号通路关键节点蛋白的表达 ①将脾脏组织置于研钵内加入液氮充分研磨,加入裂解液(含蛋白酶抑制剂和磷酸化酶抑制剂)充分裂解后,12 000 r/min离心10 min,取上清,测蛋白浓度;②经SDS-PAGE电泳并转膜后,用5%脱脂奶粉室温封闭1 h;③加入相应浓度的一抗,4℃过夜;④用TBST(TBS加0.1%的吐温20)洗涤PVDF膜3次加入相应二抗,37℃孵育1 h;⑤用TBST洗膜3次同上述步骤,用显色剂(Millipore公司)曝光。采用Quantity One 软件分析条带相对表达量。
2 结果
2.1Lewis荷瘤小鼠一般状况 于小鼠右侧腋窝下接种Lewis细胞造模成功之后,每天给药后观察小鼠状态,发现小鼠精神状态良好,活动、饮食、排泄物均未见异常,眼、耳、口、鼻处未见分泌物。
2.2ASPS对Lewis荷瘤小鼠瘤重及抑瘤率的影响 药物处理25 d后,各组小鼠瘤体完整剥离称重,结果如图1所示。ADM组、ASPS低剂量组[50 mg/(kg·d)]、ASPS中剂量组[200 mg/(kg·d)]和ASPS高剂量组[600 mg/(kg·d)]相对于NS组的抑瘤率分别为:66.15%、11.42%、37.19%和25.53%。ASPS各个剂量灌胃组相对于NS组,瘤重均有下降趋势。其中ASPS中剂量灌胃组相对于NS组肿瘤重量明显减小,差异有统计学意义(P<0.05)。ADM组作为抗肿瘤作用阳性对照组,与NS组相比,小鼠肿瘤质量(瘤重)明显减小,抑瘤效果显著(P< 0.01)。
2.3ASPS对Lewis荷瘤小鼠免疫器官脏器指数的影响 如图2A、B所示,ASPS各个剂量灌胃组的胸腺指数和脾脏指数相对于NS组,均表现出上升趋势;其中ASPS中剂量灌胃组[200 mg/(kg·d)]的胸腺指数和脾脏指数相对于NS组升高效果最为显著(P< 0.05)。基于ASPS中剂量组[200 mg/(kg·d)]瘤重、抑瘤率、胸腺指数和脾脏指数的综合情况,选择ASPS中剂量组为ASPS对Lewis荷瘤小鼠的最适剂量,进行深入研究。
2.4ASPS对Lewis荷瘤小鼠外周血中细胞因子分泌的影响 经过药物处理25 d后,收集小鼠眼球血,ELISA方法检测外周血中的细胞因子的分泌情况。结果显示(如图3所示),ASPS中剂量组小鼠血清中TNF-α、IL-1β和IL-6的分泌量显著高于NS组,差异有统计学意义(P<0.05),而对IL-12p70(Interleukin-12p70,IL-12p70)的分泌无显著影响(P>0.05)。
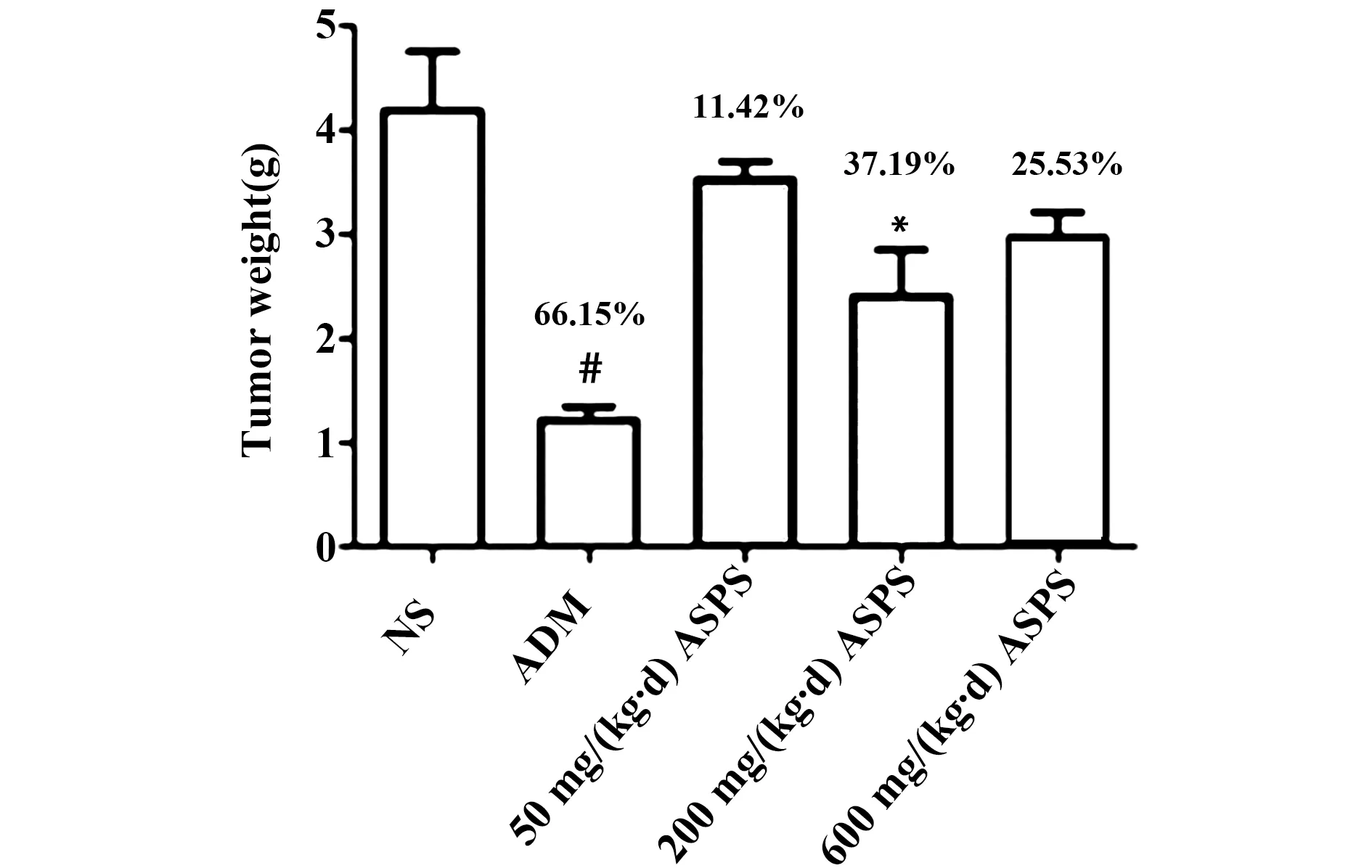
图1 ASPS对Lewis实体型荷瘤小鼠肿瘤的影响Fig.1 Effect of ASPS on tumor weight of Lewis tumor-bearing miceNote:Compared with NS group,*.P<0.05,#.P<0.01.
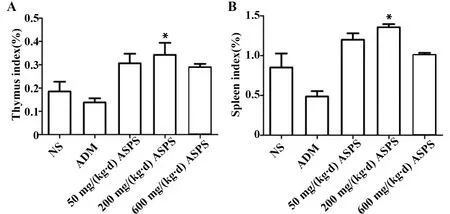
图2 ASPS对Lewis实体型荷瘤小鼠胸腺指数和脾脏指数的影响Fig.2 Effect of ASPS on immune organ indexes of Lewis tumor-bearing miceNote:Compared with NS group,*.P<0.05.
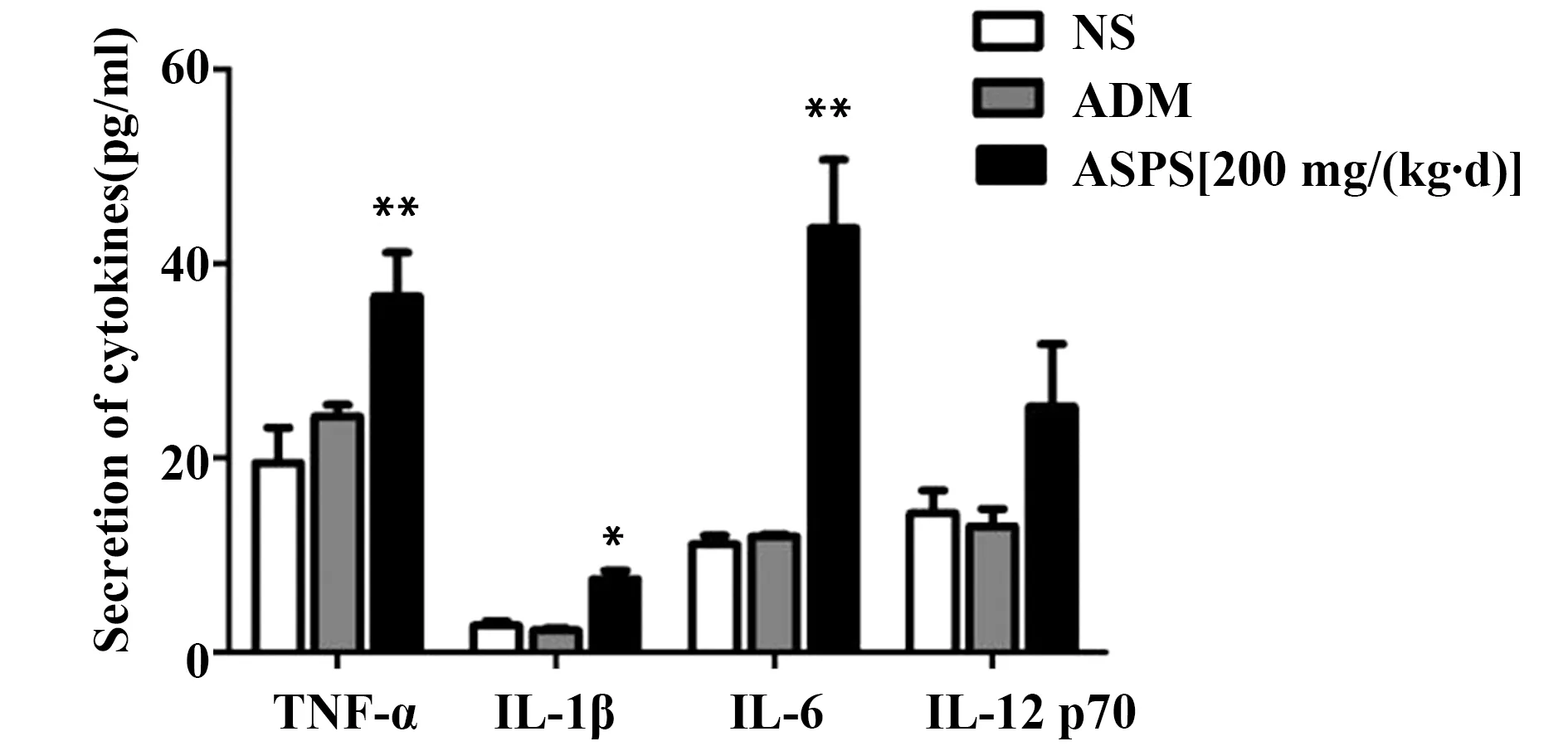
图3 ELISA检测NS组与ASPS中剂量组小鼠外周血中终端效应因子的分泌量Fig.3 Terminal effect factors secretion in tumor-bearing mice peripheral blood of NS and ASPS group detected by ELISANote:Compared with NS group,*.P<0.05,**.P<0.01.
2.5ASPS对Lewis荷瘤小鼠脾细胞中TLR4信号通路基因表达水平的影响 如图4所示,ASPS中剂量组[200 mg/(kg·d)]与NS组相比,荷瘤小鼠脾脏组织TLR4、TRAF6、MyD88、NF-κB的mRNA表达水平均明显增高(P<0.05),AP-1mRNA表达水平增高最为显著(P<0.01),而TRAM在两组中表达无明显差异(P>0.05)。相对于NS组,ASPS中剂量组中TLR4上调1.79倍,TRAF6上调1.55倍,MyD88上调1.59倍,NF-κB上调1.73倍,AP-1上调2.53倍。
2.6ASPS对Lewis荷瘤小鼠脾细胞中TLR4信号通路关键节点基因表达水平的影响 Western blot检测结果显示(图5),ASPS中剂量灌胃组小鼠与NS对照组相比,小鼠脾脏TLR4、TRAF6、MyD88、NF-κB p65、AP-1的蛋白表达水平显著增高(P< 0.05),而TRAM的蛋白表达量在两组间无显著差异(P>0.05)。
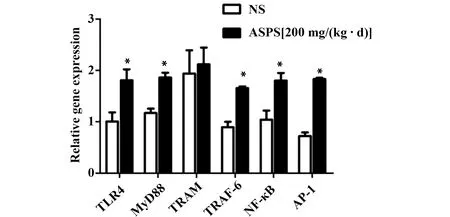
图4 Q-PCR检测荷瘤小鼠脾细胞中TLR4信号通路关键节点基因相对表达量Fig.4 Relative key nodes gene expression in splenocytes of NS group and ASPS group detected by Q-PCRNote:Compared with NS group,*.P<0.05.
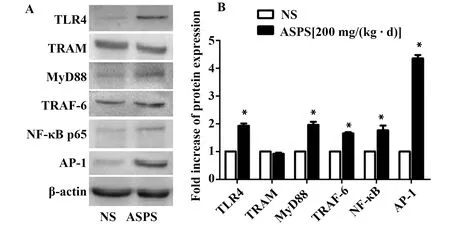
图5 Western blot检测荷瘤小鼠脾细胞中TLR4信号通路关键节点蛋白相对表达及光密度分析结果Fig.5 Relative protein expression of key nodes in splenocytes of NS and ASPS group detected by Western blotNote:A.The bands of Western blot;B.Quantification of Western blot for the key-node proteins as fold-changes relative to β-actin.Compared with NS group,*.P<0.05.
3 讨论
许多实验证实,ASPS在多种肿瘤辅助放化疗及抑制肿瘤增殖和转移中都有一定疗效。研究显示,ASPS通过上调Bax、p53,下调Bcl-2促进人肺癌细胞株H446细胞凋亡,对H446增殖有显著的抑制作用,并且呈现剂量依赖性[14]。另有实验证实,ASPS对小鼠腹水型肉瘤S180细胞和慢性骨髓型白血病K562均有显著的抑制作用[15]。本研究中,在Lewis荷瘤小鼠中同样观察到ASPS对实体型荷瘤小鼠瘤重的抑制作用,ASPS各个剂量组荷瘤小鼠的瘤重均低于NS组,其中ASPS中剂量组[200 mg/(kg·d)]瘤重降低最显著,抑瘤率达37.19%。
ASPS可以激活NK(自然杀伤细胞)和巨噬细胞,并对T、B细胞产生重要调节作用,增强机体免疫功能[16]。研究显示,ASPS能够促进豚鼠腹腔巨噬细胞系统的吞噬功能,增加正常小鼠及荷瘤小鼠巨噬细胞数量[17]。在本研究中,Lewis荷瘤小鼠经不同浓度ASPS灌胃处理25 d后发现,胸腺指数和脾脏指数相对于NS组均有不同程度的升高,其中ASPS中剂量组[200 mg/(kg·d)]升高最为显著。此外,经过ASPS灌胃处理的荷瘤小鼠,外周血中TNF-α、IL-1β和IL-6的分泌量显著升高;ASPS虽然对IL-12p70有刺激分泌的作用,但是效果不显著,无统计学差异。IL-6可以激活B细胞、T细胞和干细胞增殖,促进B细胞分泌抗体,促进CTL的分化[18]。IL-12p70则是典型的T细胞激活剂,促进T细胞增殖和功能成熟[19]。TNF-α主要由单核巨噬细胞分泌,对肿瘤细胞有直接的杀伤作用[20]。
Toll样受体(Toll-like receptors,TLRs)是一类天然免疫模式识别受体,属于Ⅰ型跨膜糖蛋白,在病原微生物免疫和诱导快速防御反应激活固有免疫系统中具有重要作用[21]。TLR4主要表达在免疫细胞表面,在介导固有免疫系统以及中药多糖主导的免疫力提升和细胞因子释放中发挥重要作用[11,12]。TLR4信号通路分为MyD88依赖途径和MyD88非依赖途径,TRAM 为MyD88非依赖途径特异性节点,TRAF-6是两条途径的交叉点,继而激活NF-κB和MAPK途径,调控相关节点和细胞因子的表达[22]。本研究为了进一步探索ASPS发挥免疫调节抗肿瘤作用的潜在机制,我们提取各组Lewis荷瘤小鼠脾脏组织的总RNA和蛋白运用Q-PCR和Western blot技术检测TLR4信号通路关键节点基因和蛋白的表达情况。结果显示,经过ASPS中剂量[200 mg/(kg·d)]灌胃的荷瘤小鼠脾细胞中TLR4、MyD88、TRAF6、NF-κB p65、AP-1的基因和蛋白的表达量相对于NS组都有明显上升;而TRAM基因和蛋白表达水平与NS组相比均未见显著变化。提示,ASPS可能促进Lewis荷瘤小鼠脾细胞中TLR4信号通路相关节点的表达,TLR4信号通路可能参与ASPS在Lewis荷瘤小鼠体内免疫调节抗肿瘤作用。但具体是MyD88依赖途径还是MyD88非依赖途径,亦或是两条途径共同参与ASPS在荷瘤小鼠体内免疫调节抗肿瘤作用,仍需更加严谨深入的研究去探索其具体机制。
[1] Shi Y,Au JS,Thongprasert S,etal.A prospective,molecular epidemiologystudy of EGFR mutation in Asian patients with advanced non-small-cell lung cancer of adenocarcinoma histology (PIONEER) [J].J Thorac Oncol,2014,9(2):154-162.
[2] Skarin AT,Herbst RS,Leong TL,etal.Lung cancer in patients under age 40 [J].Lung cancer,2001,32:255-264.
[3] 赵 瑛.中药抗肿瘤药理作用研究进展[J].现代中西医结合杂志,2012,21(33):3752-3753.
[4] Guo HR,Liu JX,Xu L,etal.Traditional Chinese Medicine Herbal treatment may have a relevant impact on the prognosis of patients with stage iv adenocarcinoma of the lung treated with platinum-based chemotherapy or combined targeted therapy and chemotherapy[J].Integr Cancer Ther,2011,10(2):127-137.
[5] 刘树明,张 娜.刺五加多糖的现在研究进展[J].中医药信息,2014,31(2):116-119.
[6] 杨吉成,刘静山,徐培君,等.刺五加苷及其多糖对S801白血病细胞系干扰素促诱生作用[J].中国免疫学杂志,1986,2(4):229-231.
[7] Huang L,Zhao H,Huang B,etal.Acanthopanax senticosus:review of botany,chemistry and pharmacology [J].Pharmazie,2011,66(2):83-97.
[8] Price LA,Wenner CA,Sloper DT,etal.Role for toll-like receptor 4 in TNF-alpha secretion by murinemacrophages in response to polysaccharide Krestin,a Trametesversicolormushroom extract [J].Fitoterapia,2010,81(7):914-919.
[9] Lei W,Browning JD Jr,Eichen PA,etal.Immuno-stimulatory activity of a polysaccharide-enriched fraction of Sutherlandia-frutescens occurs by the toll-like receptor-4 signaling pathway [J].J Ethnopharmacol,2015,172:247-253.
[10] Lin CC,Pan IH,Li YR,etal.The adjuvant effects of high-molecule-weight polysaccharides purified from Antrodiacinnam-omea on dendritic cell function and DNA vaccines [J].PLoS One,2015,10(2):e0116191.
[11] Yin X,Chen L,Liu Y,etal.Enhancement of the innate immune response of bladder epithelial cells by Astragalus polysaccharides through up regulation of TLR4 expression [J].Biochem Biophys Res Commun,2010,397(2):232-238.
[12] Liu Z,Xing J,Huang Y,etal.Activation effect of Ganodermalucidum polysaccharides liposomes on murine peritoneal macrophages[J].Int J Biol Macromol,2016,82:973-978.
[13] Han D,Cao C,Su Y,etal.Ginkgo biloba exocarp extracts inhibits angiogenesis and its effects on Wnt/β-catenin-VEGF signaling pathway in Lewis lung cancer [J].J Ethnopharmacol,2016,192:406-412.
[14] 赵俊霞,闫永鑫,赵 娟,等.刺五加多糖诱导人小细胞肺癌H446细胞凋亡[J].细胞生物学杂志,2008,30(2):239-242.
[15] 佟 丽,黄添友,梁 谋,等.刺五加多糖抗肿瘤作用与机理的实验研究[J].中国药理学通报,1994,10(2):105-109.
[16] Yoon TJ,Yoo YC,Lee SW,etal.Anti-metastatic axtivity of Acanthopanax senticosus extract and its possible immunological mechanism of action [J].J Ethnopharmacol,2004,93(2):247-253.
[17] Steinmann G,Esperester A,Joller P.Immunopharm acological in vitro effects of Eleutherococcus senticosus extracts [J].Araneimittelforschung,2001,51(1):76-83.
[18] Akira S,Hirano T,Taga T,etal.Biology of multifunctional cytokines,IL-6 and related molecules (IL-1 and TNF) [J].FASEB J,1999,4:2860-2867.
[19] Wang KS,Frank DA,Ritz J.Interleukin-2 enhances the response of natural killer cells to interleukin-12 through up-regulation of the interleukin-12 receptor and STAT4[J].Blood,2000,95(10):3183-3190.
[20] Hsu HY,Hua KF,Lin CC,etal.Extract of Reishi Polysaccharides induces cytokine expression via TLR4-modulated protein kinase signaling pathways [J].J Immunol,2004,173:5989-5999.
[21] Price LA,Wenner CA,Sloper DT,etal.Role for toll-like receptor 4 in TNF-alpha secretion by murine macrophages in response to polysaccharides Krestin,a Trametes versicolor mushroom extract [J].Fitoterapia,2010,81(7):914-919.
[22] Kawai T,Akira S.TLR signaling[J].Semin Immunol,2007,19(1):24-32.
[收稿2016-11-01 修回2017-01-09]
(编辑 倪 鹏)
ImmunomodulatoryeffectsofAcanthopanaxSenticosuspolysaccharidesonlewistumor-bearingmicethroughTLR4signalingpathway
ZHOULi-Jing,LONGTing-Ting,ZHOUXing,BAOYi-Xi.DepartmentofClinicalLaboratory,theSecondAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400010,China
Objective:To investigate the effects of Acanthopanax Senticosus polysaccharides (ASPS) on TLR4 signaling pathway in Lewis tumor-bearing mice,and to explore the immunomodulatory mechanism of ASPS.Methods:Lewis lung carcinoma cells and C57BL/6 mice were used to establish the animal model for solid tumor.The tumor-bearing mice were divided into five groups:normal saline (NS) group,Adriamycin (ADM) group,ASPS low-dose group,ASPS middle-dose group and ASPS high-dose group.After 25 d treatment,the weight of tumor,tumor inhibition rate and immune organ index were measured.ELISA were applied to detected the cytokines in peripheral blood of tumor-bearing mice.Quantitative real-time PCR (Q-PCR) and Western blot were selectively used to detect the gene and protein expression of TLR4 signaling pathway in splenocytes.Results:The tumor inhibition rate,immune organ index and the secretion of TNF-α,IL-1β and IL-6 were increased by ASPS,compared with NS group (P<0.05).The gene and protein expression of TLR4,MyD88,TRAF6,NF-κB p65 and AP-1 were also induced by ASPS (P<0.05).Meanwhile,ASPS had no obvious effects on the secretion of IL-12p70 and the expression of TRAM (P>0.05).Conclusion:TLR4 signaling pathway may be involved in the immunomodulatory effects of ASPS on Lewis tumor-bearing mice.
Acanthopanax Senticosus polysaccharides;Adenocarcinoma of lung;Immunomodulatory;TLR4 signaling pathway
10.3969/j.issn.1000-484X.2017.06.009
①本文受国家自然科学基金(81274144,81473388)资助。
周丽菁(1991年-),女,硕士,初级检验师,主要从事中药免疫和信号转导方面的研究,E-mail:LijingZhou1126@163.com。
及指导教师:鲍依稀(1967年-),女,博士,教授,硕士生导师,主要从事中药免疫机制方面的研究,E-mail:yixibao@163.com。
R285.5R392.5
A
1000-484X(2017)06-0849-06
