骨髓来源细胞表达的MMP-2/MMP-13在脉络膜新生血管发生发展中的作用
2017-07-03岳红云姚长江
吕 洋,李 红,岳红云,姚长江
·基础研究·
骨髓来源细胞表达的MMP-2/MMP-13在脉络膜新生血管发生发展中的作用
吕 洋,李 红,岳红云,姚长江
目的 探讨骨髓来源细胞(BMCs)基质金属蛋白酶(MMP)的动态表达及其与脉络膜新生血管(CNV)发生、发展的关系。方法 选取成功接受骨髓移植的24只C57BL/6J绿色荧光蛋白(GFP)嵌合体小鼠为观察组,未接受骨髓移植的48只C57BL/6J小鼠为对照组。两组均予激光光凝照射以诱发CNV,利用Western blot法及明胶酶谱法检测对照组在激光诱发前、诱发后1、3、5、7、10、14、28 d时MMP-2/MMP-13的表达情况,利用免疫荧光染色检测观察组CNV中GFP阳性细胞(即移植的骨髓细胞)是否表达MMP-2/MMP-13,并进行定量分析。结果 Western blot法、明胶酶谱法、免疫荧光均显示在激光诱发早期两组CNV中MMP-2的表达即开始快速增加,在诱导第3天表达量最高、活性最强,且观察组BMCs表达MMP-2也在此时达到高峰,占总表达量的63.21%,随后MMP-2表达量开始下降;在激光诱发早期两组CNV中MMP-13的表达缓慢增加,在诱导后第7天表达量最高、活性最强,且观察组BMCs表达MMP-13亦达最高峰,占总表达量的77.87%,随后下降。结论 BMCs可能作为调控靶点改变MMP-2/MMP-13的表达,进而影响血管细胞的出芽、移行、凋亡及CNV纤维化。
脉络膜新生血管化;骨髓来源细胞;基质金属蛋白酶
脉络膜新生血管(CNV)是来自脉络膜毛细血管的增殖血管,多位于黄斑部,是目前临床40余种眼病共同的病理过程,可造成严重的视力损害[1]。近年研究发现,基质金属蛋白酶(MMPs)在CNV形成过程中发挥重要作用,其参与细胞移行,降解细胞外基质,促进新生血管出芽,有利于骨髓来源细胞(BMCs)趋化参与新生血管形成[2]。CNV原位细胞表达MMPs是有限的,BMCs参与CNV生成可能是MMPs的重要来源[3-7]。本研究探讨参与CNV生成的BMCs是否为MMPs的重要来源及其对CNV发生、发展的影响。
1 材料与方法
1.1 试剂和仪器 兔抗小鼠MMP-2/MMP-13多克隆抗体(美国Abcam公司),羊抗兔IgG二抗(美国BioLab公司),DyLight594标记的羊抗兔抗体(美国Earth公司)。
1.2 动物来源及分组 采用6~8周龄绿色荧光蛋白(green fluorescent protein, GFP)雌性转基因小鼠作为骨髓移植供体,体重18~24 g,由第四军医大学神经生物学教研室惠赠;受体鼠为6~8周龄的野生型雌性C57BL/6J小鼠,体重18~24 g,由第四军医大学实验动物中心提供,其中接受骨髓移植的26只C57BL/6J GFP嵌合体小鼠为观察组,未接受骨髓移植的48只C57BL/6J小鼠为对照组。
1.3 骨髓移植及嵌合程度分析 ①骨髓移植:观察组行60Co照射,总剂量为8.0 Gy,1.0 Gy/min。照射后12 h内经尾静脉注射制备好的BMCs细胞悬液,每只300 μl[5];②嵌合程度分析:移植后28 d采用流式细胞仪分析血液样本中表达GFP的细胞在单核细胞中所占比例[8]。
1.4 激光光凝照射诱发CNV 对照组48只小鼠与观察组骨髓移植成功的24只小鼠均行激光光凝照射,波长532 nm,时间0.1 s,光斑直径75 μm,功率100 mw,每只眼6~8个激光斑,距视盘1~1.5个盘直径[9]。
1.5 Western blot法检测对照组CNV中MMP-2/MMP-13的表达 取24只小鼠,随机分为激光诱发前、诱发后第1、3、5、7、10、14、28天,每个时间点3只,将小鼠眼球的视网膜及脉络膜组织加入细胞裂解液制备的蛋白样品中,120 V电压下4℃电泳2 h。利用电转移法将蛋白转移至硝酸纤维素滤膜上,室温封闭2 h,将滤膜与兔抗鼠多克隆一抗MMP-2/MMP-13(浓度分别为1∶4000、1∶5000)混匀后于4℃下封闭过夜,后用TBST冲洗滤膜3次,将膜转移至羊抗兔IgG二抗(浓度为1∶1000)于37℃孵育2 h,TBST再次冲洗滤膜,使用化学发光显影检测器观察,应用UVP图像分析软件进行分析。
1.6 明胶酶谱法检测对照组CNV中MMP-2/MMP-13的表达 取24只小鼠,随机分为激光诱发前、诱发后第1、3、5、7、10、14、28天,每个时间点3只,将小鼠眼球的视网膜及脉络膜组织匀浆、离心制备成蛋白抽提液,取5 μl上样于含0.1%明胶的8%聚丙烯酰胺凝胶中进行SDS-PAGE电泳(血浆样品先经1∶40稀释后再上样)。电泳结束后将凝胶置于洗脱液(2.5% Triton X-100,50 mmol/L Tris-HCl,5 mmol/L CaCl2,1 μmol/L ZnCl2;pH 7.6)中振荡洗脱2次,每次45 min,再用漂洗液(除不含Triton X-100外其余同洗脱液)漂洗2次,每次20 min,以上均在4℃环境中进行,再将凝胶置于37℃的孵育液(50 mmol/L Tris-HCl,5 mmol/ L CaCl2,1 μmol/L ZnCl2,0.02% Brij-35;pH 7.6)中孵育42 h。孵育结束后经染色液(0.05% Coomassic亮蓝、30%甲醇、10%乙酸)染色3 h,脱色液A、B、C(甲醇浓度分别为30%、20%、10%,乙酸浓度分别为10%、10%、5%)分别脱色0.5、1及2 h,可见MMP-2和MMP-13位于蓝色背景的透亮带上。此凝胶成像以反转模式打印,使酶解活性表现为黑色条带,经图像分析系统读取条带面积和灰度。条带酶解量=条带面积×(条带灰度-背景灰度),比活=酶解量÷样品蛋白浓度,用以反映酶含量。
1.7 免疫荧光染色观察MMP-2/MMP-13的表达 取观察组、对照组各24只小鼠,随机分为激光诱发前、诱发后第1、3、5、7、10、14、28天,每个时间点3只。在-20℃环境下做垂直于视网膜8~10 μm的冰冻切片,经干燥、封闭后与兔抗小鼠MMP-2/MMP-13多克隆抗体(浓度分别为1∶200、1∶300)室温孵育过夜,洗涤后滴加红色荧光标记的山羊抗兔IgG抗体(浓度为1∶300),室温孵育3 h,洗涤、封片后在激光共聚焦显微镜下观察并拍照。以PBS代替一抗作空白对照。观察CNV中GFP阳性细胞(即移植的骨髓细胞)表达MMP-2/MMP-13的情况。显微镜下BMCs标记为绿色荧光,MMP-2/MMP-13为红色荧光,两者共同聚焦部分为黄色荧光。采用Image J测量BMCs表达的MMP-2/MMP-13的面积(黄色)和CNV表达MMP-2/MMP-13总面积(红色)(以像素为单位)。分析CNV中MMP-2/MMP-13的表达总量及BMCs表达构成比。

2 结果
2.1 骨髓移植后嵌合程度分析 观察组骨髓移植28 d后嵌合度>85%共24只,成功率为92.31%,其外周血单核细胞中GFP细胞所占比例平均(90.83±3.68)%,符合后期实验要求[7],见图1。

图1 流式细胞仪分析两组小鼠骨髓嵌合程度
1a.对照组骨髓细胞流式分析结果示:大部分骨髓细胞为阴性;1b.观察组骨髓细胞流式分析结果示:大部分骨髓细胞为阳性
2.2 Western blot法检测对照组CNV中MMP-2/MMP-13的表达 随着时间的延长,MMP-2/MMP-13的表达大体呈先升高后下降的趋势,均在激光诱发前表达量最低,MMP-2在激光诱发后第1天开始快速增加,第3天达高峰,随后下降;MMP-13在激光诱发后第1天缓慢增加,第7天达高峰,随后下降,见表1、图2。

表1 Western blot法检测对照组脉络膜新生血管在不同时间点MMP-2/MMP-13相对表达量的变化
2.3 明胶酶谱法检测对照组CNV中MMP-2/MMP-13的表达 随着时间的延长,MMP-2/MMP-13的表达大体呈先升高后下降的趋势。MMP-2在激光诱发前活性最低,激光诱发后第1天开始增加,第3天活性最强,随后开始下降;MMP-13在激光诱发后第1天活性最低,随后开始增加,第7天活性最强,随后开始下降,见表2、图3。
2.4 观察组MMP-2/MMP-13的水平变化 观察组免疫荧光图像显示,激光诱发后GFP阳性的BMCs在CNV区域聚集,同时表达MMP-2/MMP-13(图4)。采用Image J分析发现BMCs表达的MMP-2在诱发早期即开始快速增加,第3天到达高峰,占总表达量的63.21%,随后开始下降;MMP-13在诱发早期开始缓慢增加,第7天表达量达高峰,占总表达量的77.87%,随后开始下降,与不同时间点总表达趋势一致,见图5。对照组免疫荧光染色未见绿色荧光,说明绿色荧光确由供体鼠骨髓细胞发出。
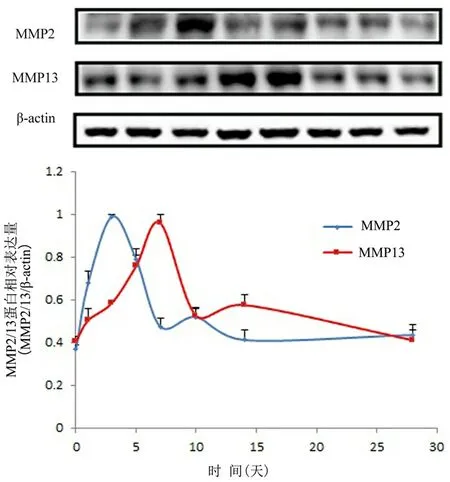
图2 Western blot法检测对照组脉络膜新生血管在不同时间点MMP-2/MMP-13相对表达量变化
2a为MMP-2/MMP-13代表性蛋白条带图,2b为MMP-2/MMP-13蛋白表达量比较

表2 明胶酶谱法检测对照组脉络膜新生血管在不同时间点MMP-2/MMP-13相对表达量的变化
3 讨论
因各种原因造成的视网膜缺血、缺氧,均可诱导来自脉络膜的病理性新生血管侵入视网膜,损伤正常的脉络膜及视网膜结构,导致出血,是进行性视力损伤的主要原因之一,严重影响生活质量。有研究证实,BMCs能移行至病变损伤部位,分化为多种细胞,参与CNV的发生、发展,还可作为载体,将药物、药物激活物质等带到损伤部位,起到靶向治疗作用[4,10]。

图3 明胶酶谱法检测对照组脉络膜新生血管在不同时间点MMP-2/MMP-13相对表达量的变化
3a为MMP-2/MMP-13代表性蛋白条带图,3b为MMP-2/MMP-13蛋白表达量比较
MMPs是CNV生成所必需的物质[4,7],是一类在结构上具有显著同源性锌离子依赖性内肽酶[4,7],可降解胶原活性,主要降解血管基底膜和细胞外基质。CNV生成时先在MMPs作用下分解基底膜与细胞外基质,后血管内皮细胞(VEC)方能分裂增殖形成幼芽,进而发展为CNV。因此,MMPs是CNV生成的基础,其中MMP-13主要降解Ⅰ、Ⅲ型胶原,MMP-2主要降解Ⅳ、Ⅴ型胶原。有研究显示碱性成纤维细胞生长因子(pigment epithelium-derived factor, PEDF)为MMP-2底物[4,7],是目前已知的功能最强大的内源性新生血管抑制因子,能促进VEC凋亡,抑制VEC增殖和移行,下调血管内皮生长因子(VEGF)的表达,阻止其与受体结合,减少VEGF诱发的血管渗漏并抑制炎症反应,且PEDF可阻止神经元凋亡,从而保护视网膜。
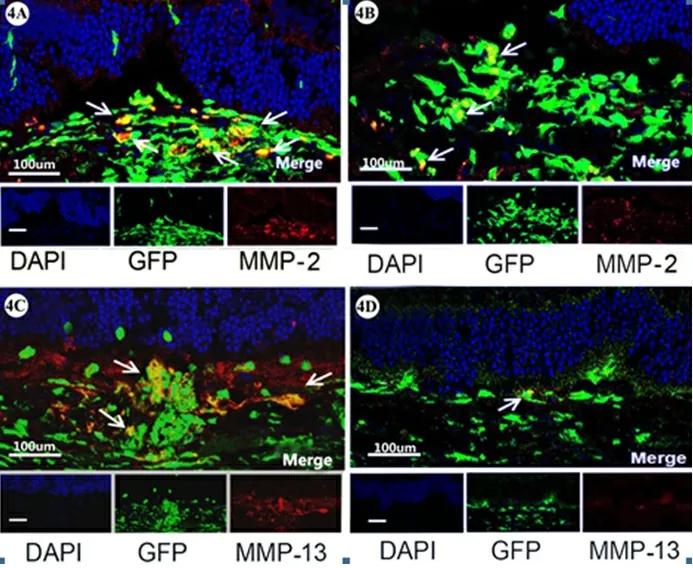
图4 免疫荧光检测观察组脉络膜新生血管MMP-2/MMP-13的表达情况(骨髓来源细胞为绿色,MMP-2/MMP-13为红色,两者共同表达区域为黄色)
4a为激光诱发后第3天MMP-2与骨髓来源细胞的表达,4b为激光诱发后第7天MMP-2与骨髓来源细胞的表达,4c为激光诱发后第7天MMP-13与骨髓来源细胞的表达,4d为激光诱发后第28天MMP-13与骨髓来源细胞的表达;GFP为绿色荧光蛋白;DAPI为细胞核特异性标志物

图5 观察组脉络膜新生血管在不同时间点骨髓来源细胞MMP-2/MMP-13的表达构成比
5a为激光诱发后各时间点MMP-2的总表达量及其构成比,5b为激光诱发后各时间点MMP-13的总表达量及其构成比
眼内的PEDF主要来源于视网膜色素上皮(RPE)细胞,CNV区域PEDF表达显著下调,而CNV的形成可发挥营养神经及保护作用,因此,PEDF是CNV相关疾病的理想治疗因子。本研究证明,在激光诱发后,MMP-2/MMP-13的表达大体呈先上升后下降的趋势,且MMP-2的表达升高更早。MMP-2与MMP-13的表达上调可降解CNV基底膜和细胞外基质Ⅰ、Ⅲ、Ⅳ及Ⅴ型胶原,为血管细胞的增殖、移行、出芽创造条件,促进CNV早期的快速发展。PEDF是CNV最强的内源性抑制因子,有研究发现处于活动期富含血管的CNV中VEGF和PEDF均高表达,而在静止的、纤维化的CNV中二者的表达均较弱[11],提示VEGF表达上调是CNV发生、发展的启动因素,且在VEGF诱导PEDF上调这一反馈机制的作用下,PEDF浓度亦升高。PEDF为MMP-2底物,其对PEDF的降解可促进CNV形成和视网膜损伤[12]。本研究发现激光诱发早期MMP-2表达迅速上调,对于打破VEGF与PEDF的平衡及激发新生血管的形成非常重要;在激光诱发后期,MMP-2表达下调,对PEDF的降解作用减弱,促使了血管膜纤维化。
激光诱发后7~14 d是CNV生长高峰期[13],BMCs在CNV早期即开始聚集[6],于激光诱发后第7天BMCs荧光强度最强[3],MMP-13的表达亦达高峰,占MMP-13总表达量的77.87%,与Lecomte等[7]结果一致,提示BMCs对CNV生成时MMP-13的迅速上调起主要作用,同样说明在MMP-2表达高峰期,大部分来自BMCs,说明BMCs对MMP-2的表达上调亦起主要作用。BMCs不但参与CNV的细胞构成,同时为CNV生成提供重要的分子基础。由此推测,BMCs可通过分泌MMP-2/MMP-13而作用于CNV发生、发展的多个环节,对CNV的病理过程产生影响,且MMP-2与MMP-13在BMCs参与CNV发生发展过程中可能扮演关键角色[14-15]。
在激光诱导小鼠CNV模型中,BMCs是MMP-2/MMP-13的重要来源,提示BMCs可能作为调控靶点以改变MMP-2/MMP-13的表达,进而影响血管细胞的出芽、移行、凋亡及CNV纤维化。本研究从BMCs参与CNV发生发展的角度探索CNV的发病机制,寻找一个新的、更高效的分子靶点,实现对CNV的多角度治疗,从而为临床工作提供新的理论依据。
[1] Li Calzi S, Neu M B, Shaw L C,etal. EPCs and pathological angiogenesis: when good cells go bad[J].Microvasc Res, 2010,79(3):207-216.
[2] Hoffmann S, He S, Ehren M,etal. MMP-2 and MMP-9 secretion by rpe is stimulated by angiogenic molecules found in choroidal neovascular membranes[J].Retina, 2006,26(4):454-461.
[3] Barnett J M, Penn J S, Jayagopal A. Imaging of endothelial progenitor cell subpopulations in angiogenesis using quantum dot nanocrystals[J].Methods Mol Biol, 2013,1026:45-56.
[4] Hou H Y, Liang H L, Wang Y S. Bone marrow-derived cells in neovascular age-related macular degeneration: contribution and potential application[J].Ophthalmic Res, 2011,45(1):1-4.
[5] Hou H Y, Wang Y S, Xu J F,etal. The dynamic conduct of bone marrow-derived cells in the choroidal neovascularization microenviroment[J].Curr Eye Res, 2006,31(12):1051-1061.
[6] Hou H Y, Wang Y S, Xu J F,etal. Nicotine promotes contribution of bone marrow-derived cells to experimental choroidal neovascularization in mice[J].Exp Eye Res, 2008,86(6):983-990.
[7] Lecomte J, Louis K, Detry B,etal. Bone marrow-derived mesenchymal cells and MMP13 contribute to experimental choroidal neovascularization[J].Cell Mol Life Sci, 2011,68(4):677-686.
[8] Espinosa-Heidmann D G, Caicedo A, Hernandez E P,etal. Bone marrow-derived progenitor cells contribute to experimental choroidal neovascularization[J].Invest Ophthalmol Vis Sci, 2003,44(11):4914-4919.
[9] 杨秀梅,王雨生.脉络膜新生血管的动物模型[J].国际眼科纵览,2006,30(3):166-170.
[10]侯慧媛,王雨生,徐建峰.骨髓来源细胞在脉络膜新生血管生成中的作用[J].中华眼底病杂志,2009,25(1):30-33.
[11]Tong J P, Yao Y F. Contribution of VEGF and PEDF to choroidal angiogenesis: a need for balanced expressions[J].Clin Biochem, 2006,39(3):267-276.
[12]Chung C, Shugrue C, Nagar A,etal. Ethanol exposure depletes hepatic pigment epithelium-derived factor, a novel lipid regulator[J].Gastroenterology, 2009,136(1):331-340.
[13]Hou H Y, Liang H L, Wang Y S,etal. A therapeutic strategy for choroidal neovascularization based on recruitment of mesenchymal stem cells to the sites of lesions[J].Mol Ther, 2010,18(10):1837-1845.
[14]高凡,王雨生,侯慧媛.两种缺氧模型对小鼠骨髓间充质干细胞中基质金属蛋白酶表达及其对促血管形成能力的影响[J].眼科新进展,2016,36(5):401-405.
[15]Gao F, Sun M, Gong Y,etal. MicroRNA-195a-3p inhibits angiogenesis by targeting Mmp2 in murine mesenchymal stem cells[J].Mol Reprod Dev, 2016,83(5):413-423.
Effect of MMP-2/MMP-13 Expression by Bone Marrow-derived Cells in Development of Choroidal Neovascularization
LYU Yang1, LI Hong1, YUE Hong-yun1, YAO Chang-jiang2
(1. Department of Ophthalmology, Lanzhou General Hospital of Lanzhou Military Area Command, Lanzhou 730000, China; 2. Department of Osteology, the Second Hospital of Lanzhou University, Lanzhou 730000, China)
Objective To investigate matrix metalloproteinase (MMP) dynamic expression by bone marrow-derived cells (BMCs) and its relationship with pathogenesy and development of choroidal neovascularization (CNV). Methods A total of 24 C57BL/6J green fluorescent protein (GFP) of allophenic mice, who underwent bone marrow transplantation successfully, were selected as observation group, while other 48 C57BL/6J mice without bone marrow transplantation were selected as control group. CNV was induced by irradiating with laser photocoagulation for all mice. In control group, MMP-2/MMP-13 expressions were detected by Western blot and gelatin zymography method before induction, and at 1st, 3rd, 5th, 7th, 10th, 14thand 28thd after induction; In observation group, immunofluorescence staining was used to identify whether or not MMP-2/MMP-13 was expressed by GFP -positive BMCs in CNV, and quantitative analysis was also performed. Results Western blot, gelatin zymography and immunofluorescence staining methods all showed that MMP-2 expressions were rapidly increased in the early laser stage of CNV patients in two groups, and the expressions of BMCs and MMP-2 reached the highest values and strongest activity at 3rdd after induction; the highest value of MMP-2 expression in observation group occupied 63.21% of the total expression; and then MMP-2 expression began to decline. MMP-13 expression showed slowly increases at the early laser stage of CNV patients in two groups, and the highest expression and strongest activity were found at 7thd after induction; the highest values of MMP-13 expression in CNV patients in two groups and in observation group occupied 77.87% of the total expression; and then MMP-13 expression began to decline. Conclusion BMCs can be used as target point to regulate MMP-2/MMP-13 expression, and it can further affect pullulation, transmigration, apoptosis and fibration of CNV.
Choroidal neovascularization; Bone marrow derived cells; Matrix metalloproteinase
国家自然科学基金资助项目(81500748);甘肃省自然基金项目(1308RJZA249)
730000 兰州,兰州军区兰州总医院眼科(吕洋、李红、岳红云);730000 兰州,兰州大学第二医院骨科(姚长江)
姚长江,E-mail:15117203811@163.com
R773.4
A
1002-3429(2017)06-0103-05
10.3969/j.issn.1002-3429.2017.06.036
2017-02-27 修回时间:2017-03-28)
