雄蚕益肾方对迟发性性腺功能低下症大鼠睾丸组织病理变化与超微结构的影响
2017-07-03何清湖
周 兴,周 青,何清湖*
(1.湖南中医药大学第一附属医院,湖南 长沙 410007;2.湖南中医药大学,湖南 长沙 410208)
雄蚕益肾方对迟发性性腺功能低下症大鼠睾丸组织病理变化与超微结构的影响
周 兴1,周 青1,何清湖2*
(1.湖南中医药大学第一附属医院,湖南 长沙 410007;2.湖南中医药大学,湖南 长沙 410208)
目的 探讨雄蚕益肾方对迟发性性腺功能低下症(late-onset hypogonadism,LOH)大鼠睾丸组织病理变化和超微结构的影响。方法 采用“退役种鼠(40周龄)+复合情志刺激+孤养”方法,建立LOH大鼠模型,随机分为模型组、睾酮组、雄蚕益肾方组(雄蚕组),另设立正常对照组(8周龄),药物干预4周,末次给药后24 h处死动物,检测血清睾酮水平、睾丸指数,分别以光学显微镜和透射电子显微镜观察睾丸组织的病理变化与超微结构。结果 模型组、睾酮组、雄蚕组之间睾丸指数比较,差异均无统计学意义(P>0.05),LOH大鼠睾丸组织出现曲细精管结构紊乱,精子大量减少,睾丸间质变少等病理变化以及线粒体数量明显减少,大量线粒体水肿等超微结构改变,雄蚕组病理变化和超微结构均得到改善。结论 LOH大鼠可出现睾丸组织器官水平和细胞水平的病理变化及超微结构改变,雄蚕益肾方可能能通过改善其病理变化和睾丸间质细胞超微结构而发挥作用。
雄蚕益肾方;迟发性性腺功能低下症;病理变化;超微结构
本文引用:周 兴,周 青,何清湖.雄蚕益肾方对迟发性性腺功能低下症大鼠睾丸组织病理变化与超微结构的影响[J].湖南中医药大学学报,2017,37(6):586-590.
迟发性性腺功能低下症(late-o nset hypogo nadism,LOH)发病主要由于增龄导致的睾酮水平进行性下降,睾酮补充替代治疗 (testosterone supplementation therapy,TST)被视为LOH治疗的金标准[1],但临床对TST疗效、疗程、安全性等问题仍存有争议[2]。中医通过辨证施治,可以综合运用补肾、疏肝、健脾、养心等多种治法,疗效肯定,为临床LOH治疗提供了新的思路。我院长期应用雄蚕益肾方治疗LOH,为探索其机制,本研究观察了该方对LOH大鼠睾丸组织病理变化和超微结构的影响,现将结果报道如下。
1 材料
1.1 动物
1.1.1 造模组大鼠 SPF级SD雄性大鼠 (退役种鼠),40 周龄,体质量(400±50) g,40 只。 购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2012-0001。
1.1.2 正常对照组(以下简称正常组)大鼠 SPF级SD雄性大鼠,8周龄,体质量230~250 g,15只。 购自湖南斯莱克景达实验动物有限公司,许可证号:SCXK(湘)2013-0004。均饲养在湖南中医药大学SPF级动物实验中心,SPF级动物专用饲料饲养,恒定温度(21±3) ℃、湿度(75±5)%,光-暗周期、动物摄食及饮水条件按造模需要设定。适应性喂养1周后进行试验。
1.2 药物及制备
雄蚕益肾方(雄蚕蛾30 g,淫羊藿15 g,熟地黄15 g,枸杞子 15 g,白芍 10 g,刺蒺藜 15 g),为科室协定方,由湖南中医药大学第一附属医院药剂科购买并鉴定。雄蚕蛾提取工艺流程:参照刘军等[3]提供的提取方法。乙醇提取雄蚕蛾营养活性成分的工艺条件为:乙醇体积分数45%,原料质量浓度50 g/L,提取时间30 min,提取温度70℃。将提取液浓缩至1 g/mL。乙醇提取后的雄蚕蛾残渣与淫羊藿、熟地黄、枸杞子、白芍、刺蒺藜合并,煎煮3次,水煎液浓缩制成含生药浓度为1 g/mL的药液,与乙醇提取后的雄蚕蛾液相混合,置4℃冰箱备用。
1.3 试剂及仪器
丙酸睾酮注射液:杭州动物药品厂,2 mL/瓶,批准文号:兽药字(2013)110201054。瑞典 LKB-III型超薄切片机,日立HT7700型透射电镜。
2 方法
2.1 模型制备
结合课题组前期研究基础[4],参考金光亮[5-6]、周力[7]、于琦[8]等的复合情志刺激造模法。选择造模用雄性SD退役种鼠(40周龄)40只,并每笼1只孤养,每日随机给予以下不良刺激中的一种:(1)禁水(24 h);(2)昼夜颠倒(8:00-18:00 将动物房门关上、拉下窗帘,置于黑暗环境;18:00-8:00 打开日光灯,并使房间内照度保持在 300 Lux);(3)禁食(24 h);(4)夹尾 (用25 mm长尾票夹在距尾端1 cm处夹住鼠尾,30 min);(5)噪音(70 分贝,持续 2 h)。 每日 1种,每种刺激不连续使用,每周随机休息2 d,连续4周。正常组大鼠正常条件饲养,自由摄食和饮水。
2.2 动物分组与给药
造模完成后,断尾采血 0.8~1.2 mL,离心管分装,3 000 r/min,离心 10 min,分离出血清,-80 ℃冰箱冷冻保藏,ELISA法检测血清睾酮浓度。参照参考何清湖[9]、周兴[10]等的方法,统计得出15只8周龄SD雄性大鼠血清睾酮10%位数为1.91 ng/mL,以此为切点值,凡是经复合情志刺激造模后,大鼠血清睾酮水平均低于该切点值的作为LOH大鼠模型,共有34只大鼠符合纳入标准。按随机分组原则,设为模型组6只,丙酸睾酮组(以下简称睾酮组)6只,雄蚕益肾疏肝组(以下简称雄蚕组)6只;从15只正常组大鼠中随机选取6只作为正常组。将各组大鼠分别编号标记,分笼饲养。
连续灌胃 4 周,1 次/d,上午 8:00-9:00。动物给药剂量按动物每公斤体质量占人体表面积的比值计算,各治疗组均按临床等效剂量给药。雄蚕组灌胃剂量为每次10 mL/kg;睾酮组每于大鼠股部肌肉注射丙酸睾酮,用量标准为7 mg/kg,每周注射3次,注射部位左右交替,共4周;模型组及正常组每次均以3 mL生理盐水灌胃并大鼠股部肌肉注射生理盐水,剂量按7 mg/kg。末次给药后24 h处死所有动物,进行各项指标检测。
2.3 样本采集与指标检测
乌拉坦腹腔注射麻醉,腹主动脉取血,静置并离心后取上清液分装,-80℃冻存待检。取一部分睾丸组织置4%多聚甲醛固定,另取适量睾丸组织置2.5%戊二酸PE管内固定。
2.3.1 睾丸指数测定 取双侧睾丸置于电子天平称质量,计算出睾丸指数。公式为:睾丸指数=双侧睾丸质量(g)/体质量(g)×100%。
2.3.2 睾丸组织病理变化 采用HE染色,光镜下观察各睾丸组织形态学改变。在湖南中医药大学病理教研室完成。
2.3.3 睾丸组织超微结构 用透射电子显微镜观察睾丸间质细胞超微结构改变,在中南大学湘雅医院电镜室完成。
2.3.4 血清睾酮测定 采用ELISA法,根据睾酮ELISA试剂全说明书操作,在湖南师范大学生命科学院完成。
2.4 统计学方法
3 结果
3.1 各组大鼠一般情况比较
模型组、睾酮组、雄蚕组实验前体质量比较,差异无统计学意义(P>0.05),具有可比性;以上各组试验后体质量比较、以及各组实验前后体质量比较,差异均无统计学意义(P>0.05)。说明针对LOH大鼠的药物干预,并不能影响其体质量。
模型组、睾酮组、雄蚕组各组睾丸指数比较,差异无统计学意义(P>0.05);与正常组比较,差异有统计学意义(P<0.01)。提示LOH大鼠的睾丸指数明显低于正常组大鼠,但药物干预并不能影响睾丸指数。见表1。
表1 4组大鼠实验前后体重变化及睾丸指数 (±s)

表1 4组大鼠实验前后体重变化及睾丸指数 (±s)
注:与本组治疗前比较※P<0.05;与正常组比较荭P<0.01。
组别 n体质量(g)实验前 实验后 睾丸指数(%)正常组模型组睾酮组雄蚕组66 66 FP 217.03±18.68 605.15±92.27 601.37±69.33 607.70±62.67 51.26 0.00 295.63±23.07※598.55±88.94 632.83±77.33 637.70±79.34 31.39 0.00 1.15±0.10 0.55±0.06荭荭0.53±0.07荭荭0.56±0.08荭荭90.07 0.00
3.2 各组大鼠血清总睾酮水平比较
模型组、睾酮组、雄蚕组实验前各组大鼠血清总睾酮水平比较,差异无统计学意义(P>0.05),具有可比性;以上各组与正常组比较,差异有统计学意义(P<0.01)。
试验后,睾酮组与模型组、雄蚕组、正常组比较,大鼠血清总睾酮水平,差异有统计学意义(P<0.01);雄蚕组与模型组、正常组比较大鼠血清总睾酮水平,差异有统计学意义(P<0.01)。
表2 4组大鼠实验前后血清睾酮变化情况 (±s)

表2 4组大鼠实验前后血清睾酮变化情况 (±s)
注:实验前血清总睾酮满足正态分布,但方差不齐(P=0.002),采用Tamhane’s T2检验。与试验后睾酮组比较**P<0.01;与试验后模型组比较▲▲P<0.01。
组别 n 血清总睾酮(ng/mL)实验前 实验后正常组模型组睾酮组雄蚕组6 6 6 6 FP 3.48±1.42 1.29±0.45 1.31±0.39 1.32±0.27 11.62 0.00 4.41±0.94※※1.35±0.29※※11.77±0.86▲▲2.74±1.27※※▲▲155.99 0.00
3.3 各组大鼠睾丸组织病理变化比较
正常组:各级生精细胞发育正常、层次清晰,睾丸间质正常。模型组:曲细精管结构紊乱,初级精母细胞数量减少,精子细胞坏死紊乱,大量吞噬细胞产生,精子大量减少,睾丸间质变少,细胞与细胞间分界不清。睾酮组:初级精母细胞体积变大、水肿,细胞核颜色变浅,分界不清,睾丸间质萎缩变少。雄蚕组:少量生精细胞脱落,曲细精管无萎缩,睾丸间质无水肿。见图1。
3.4 各组大鼠睾丸组织超微结构改变比较
正常组:线粒体数量多,线粒体聚集,形成线粒体鞘,线粒体体积大,线粒体嵴清晰,线粒体无水肿。模型组:线粒体数量明显减少,大量线粒体水肿,线粒体体积小,线粒体嵴不清晰,嵴水肿、扩张,出现空泡样变。睾酮组:与雄蚕组、正常组比较,线粒体数量减少,部分线粒体水肿,线粒体体积小,部分线粒体嵴清晰。雄蚕组:线粒体数量多,部分可看到线粒体鞘形成,线粒体体积较大,线粒体嵴尚清晰,线粒体水肿不明显。见图2。
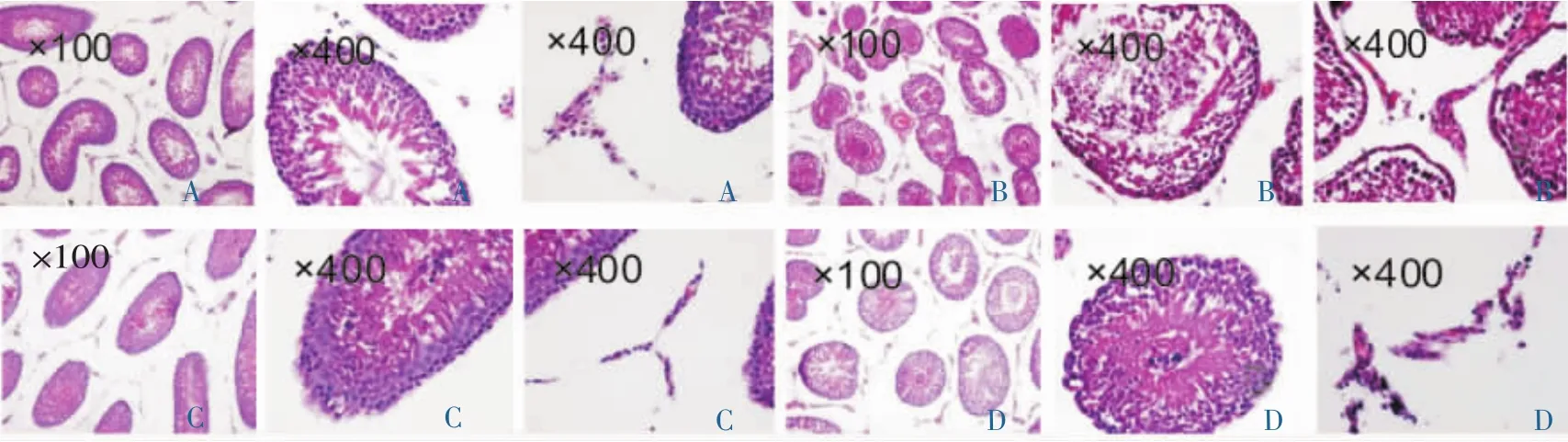
图1 HE染色观察睾丸组织形态光镜图

图2睾丸组织超微结构改变电镜图
4 讨论
LOH的发病主要与年龄相关的睾酮水平下降有关,作为睾酮合成的最关键细胞——睾丸间质细胞(Leydig cell),其合成功能随增龄衰退的调控是目前LOH研究重要方向之一。增龄影响的具体机制可能有[11]:(1)胆固醇转运蛋白减少,主要有类固醇激素合成急性调节蛋白(StAR)、外周型苯二氮卓受体转运蛋白(TSPO),进而影响游离胆固醇经线粒体外膜向线粒体内膜转运;(2)睾酮合成酶活性下降,包括位于线粒体内膜的细胞色素胆固醇侧链裂解酶(P450scc)和位于滑面内质网的3β-羟甾脱氢酶(3β-HSD)。也有证据表明,Leydig细胞睾酮合成功能衰退可能与增龄相关的超微结构改变有关。如李维仁等[12]证实,老年人睾丸间质细胞胞浆中,细胞器较少,可见大量肿胀线粒体,线粒体嵴消失,少见有脂滴;邵迎红等[13]研究证实,24月龄SD大鼠睾丸间质细胞线粒体、滑面内质网减少,线粒体肿胀,板状嵴模糊、消失,内质网扩张,有不同程度的局灶性到弥漫性囊泡变性,内质网广泛扩张的细胞呈筛状。本研究发现,模型组大鼠Leydig细胞线粒体数量明显减少、大量线粒体水肿等改变,与上述结果一致。睾酮合成过程中,Leydig细胞线粒体是最关键细胞器之一,因为关键限速酶StAR、P450scc,都存在于Leydig细胞线粒体内膜。线粒体水肿等上述改变是否与睾酮合成酶活性下降相关?又是哪些因素导致了Leydig细胞线粒体水肿的发生呢?
进一步文献研究,我们认为:一方面,Leydig细胞线粒体肿胀等超微结构改变,可能与增龄导致的活性氧簇(ROS)在Leydig细胞蓄积有关。真核细胞线粒体是产生ROS的最主要部位。根据目前较公认的“氧自由基衰老学说”,增龄相关的细胞衰老与细胞内ROS蓄积,氧化应激相关。已有的研究证实,在衰老进程中,ROS在Leydig细胞内蓄积,将导致Leydig细胞凋亡增加[14]、线粒体功能紊乱[15];同时,ROS还可通过介导c-Jun信号通路抑制Nur77转录,进而降低睾酮合成酶基因表达[16]。
另一方面,Leydig细胞线粒体肿胀等超微结构改变,可能与增龄导致的Leydig细胞自噬下降有关。自噬是细胞内某些物质成分被自身溶酶体包裹降解的过程,能净化自身多余或受损的细胞器,维持细胞自稳。早在上世纪80~90年代,国内有研究报道,生理情况下Leydig细胞自噬非常活跃,是研究自噬的很好细胞模型,并提出自噬可能对Leydig细胞睾酮的合成有调节作用[17]。近年来研究证实,与青年组(3月龄)大鼠比较,老年组(24月龄)大鼠睾酮水平下降、Leydig细胞自噬降低、StAR蛋白表达下调;进一步研究发现,敲除TM3 Leydig细胞自噬关键基因Beclin1后,Leydig细胞自噬显著降低,LC3-Ⅱ蛋白(LC3-磷脂酰乙醇胺共轭,自噬蛋白标志物)和StAR蛋白表达均下调[18]。说明自噬降低与老年大鼠Leydig细胞睾酮合成水平下降直接相关。
本研究证实,雄蚕益肾方能提高LOH大鼠血清睾酮水平,显著降低Leydig细胞线粒体水肿发生,是否与影响Leydig细胞ROS蓄积、增加自噬有关?具体机制仍需要进一步研究证实。因此,围绕Leydig细胞超微结构改变,探索雄蚕益肾方干预LOH的可能分子机制研究,将是研究团队下一步研究的重点。
[1]Comhaire F,Mahmoud A.The andrologist's contribution to a better life for ageing men:part 1.Andrologia,2016,48(1):87-98.
[2]Mascarenhas A.Khan S.Sayal R.et al.Factors that may be influencing the rise in prescription testosterone replacement therapy in adult men:a qualitative study.Aging Male,2016,19(2):1-6.
[3]刘 军,廖森泰,邹宇晓,等.雄蚕蛾营养活性成分的提取方法及工艺条件优化.蚕业科学,2013,39(1):146-151.
[4]周 兴,何清湖,周 青,等.肾虚肝郁证迟发性性腺功能减退症大鼠模型的建立与评价.湖南中医药大学学报,2016,36(3):30-35.
[5]金光亮,南 睿,郭霞珍.慢性应激肝郁证大鼠模型的建立.北京中医药大学学报,2003,26(2):18-21.
[6]金光亮,王胜兰.关于建立肝郁证动物模型的思考.山东中医药大学学报,2004,28(6):408-409.
[7]周 力,蒲 琴,申 理,等.利用不良情志刺激建立肝郁证动物模型初探.中药药理与临床,2008,24(3):114-115.
[8]于 琦,金光亮.四逆散、归脾汤与温胆汤对慢性应激肝郁模型大鼠行为学的影响.广州中医药大学学报,2009,26(2):148-151.
[9]何清湖,周 兴.环磷酰胺复制中老年男性雄激素部分缺乏综合征大鼠模型的研究.湖南中医药大学学报,2011,31(1):15-17.
[10]周 兴,何清湖,刘朝圣,等.天蚕壮阳散对中老年男性雄激素部分缺乏综合征模型大鼠睾丸间质细胞stAR蛋白表达的影响.中国中西医结合杂志,2011,31(4):542-546.
[11]Beattie MC,Adekola L,Papadopoulos V,et al.Leydig cell aging and ypogonadism.Exp Gerontol,2015,68:87-91.
[12]李维仁,韩勃萱,刘 涛,等.老年人睾丸间质细胞结构及StAR和P450scc蛋白表达的变化.北京大学学报 (医学版),2011,43(4):505-508.
[13]邵迎红,母义明,李江源,等.衰老大鼠睾丸间质细胞形态学观察.中国男科学杂志,2005,19(2):10-12.
[14]Ding X,Wang D,Li L,et al.Dehydroepiandrosterone ameliorates H2O2-induced Leydig cells oxidation damage and apoptosis through inhibition of ROS production and activation of PI3K/Akt pathways.Int J Biochem Cell Biol,2016,70:126-139.
[15]DiemerT,Allen JA,Hales KH,etal.Reactive oxygen disrupts mitochondria in MA-10 tumor Leydig cells and inhibits steroidogenic acute regulatory (StAR)protein and steroidogenesis.Endocrinology,2003,144(7):2882-2891.
[16]Lee SY,Gong EY,Hong CY,et al.ROS inhibit the expression of testicular steroidogenic enzyme genes via the suppression of Nur77 transactivation.Free Radic Biol Med,2009,47(11):1591-1600.
[17]汤雪明,张蕙心,易 静.睾丸间质细胞——研究自体吞噬的一种正常细胞模型.实验生物学报,1992,25(1):39-47.
[18]Li WR,Chen L,Chang ZJ,et al.Autophagic deficiency is related to steroidogenic decline in aged rat Leydig cells.Asian J Androl,2011,13(6):881-888.
(本文编辑 杨 瑛)
Effects of Xiongcan Yishen Prescription on Pathological Changes and Ultrastructure of Testicular Tissue in the Late-Onset Hypogonadism Rats
ZHOU Xing1,ZHOU Qing1,HE Qinghu2*
(1.The First Affiliated Hospital of Hunan University of Chinese Medicine,Changsha,Hunan 410007,China;2.Hunan University of Chinese Medicine,Changsha,Hunan 410208,China)
Objective To study the effects of Xiongcan Yishen formula on the pathological changes and the ultrastructure of the testicular tissue in the late-onset hypogonadism (LOH)rats.Methods The LOH rat models were established by using retired mated rats (40 weeks)which fed separately and given various emotional stimulation.The rats were randomly divided into model group,testosterone group,Xiongcan group,and establishment of control group (8 weeks),the medicine intervention was for 4 weeks.The rats were sacrificed 24 hours later after last medication.The serum testosterone and testicle mass index was detected,the ultrastructure and pathological changes of the testicular tissue were observed by opticalmicroscope and transmission electron microscope.ResultsThe rattesticularindexesbetween modelgroup,testosterone group,Xiongcan group were significantly different (P >0.05).The LOH model rats have the following pathological changes such as structure disturbance of seminiferous tubules,spermatogenesis loss,testis interstitial loss,and the ultrastructural changes such as mitochondria decreases and obvious edema of mitochondria.The pathological changes and the ultrastructures in Xiongcan group were improved.Conclusion LOH rats appear the pathological changes and the ultrastructural changes of the testicular tissue at the organic level and the cellular level.Xiongcan Yishen prescription could ameliorating its pathological changes and the ultrastructural changes of leydig cells.
Xiongcan Yishen prescription;late-onset hypogonadism;pathological changes;ultrastructure
R285.5;R588
A
doi:10.3969/j.issn.1674-070X.2017.06.002
2016-08-08
国家自然科学基金(81202706,81673984);湖南省教育厅优秀青年项目(16B200)。
周 兴,男,副主任医师,博士,从事中西医结合男科学专业研究。
* 何清湖,男,教授,博士研究生导师,E-mail:hqh1111@tom.com。
