正交试验结合综合评分法优化苗药了哥王的提取工艺Δ
2017-07-03吴增光郑传奇田小芳冷安碧天津中医药大学中药学院天津30093贵阳中医学院药学院贵阳55005贵州省贵阳中医学院院士工作站贵阳55005
冯 果,李 玮,何 新,吴增光,郑传奇,田小芳,冷安碧,李 月(.天津中医药大学中药学院,天津 30093;.贵阳中医学院药学院,贵阳 55005;3.贵州省贵阳中医学院院士工作站,贵阳 55005)
·民族医药·
正交试验结合综合评分法优化苗药了哥王的提取工艺Δ
冯 果1,2,3*,李 玮2,3,何 新1,吴增光1,郑传奇2,田小芳2,冷安碧2,李 月2(1.天津中医药大学中药学院,天津 300193;2.贵阳中医学院药学院,贵阳 550025;3.贵州省贵阳中医学院院士工作站,贵阳 550025)
目的:优化了哥王的提取工艺。方法:以了哥王的有效成分伞形花内酯、西瑞香素的含量和浸膏收率作为综合评价指标,以溶剂量、乙醇体积分数、渗漉速度为考察因素,采用单因素试验对了哥王的3种提取方法(渗漉法、煎煮法和回流提取法)进行比较,筛选最优提取方法;再用正交试验对最优提取方法的工艺条件进行优化并验证。结果:提取方法的综合评分排序为渗漉法>回流提取法>煎煮法,以渗漉法更优。渗漉法的最优工艺条件为渗漉溶剂70%乙醇,溶剂量为14倍药材量,渗漉速度为5 m L/(min·kg);验证试验中3次试验的综合评分分别为98.3、99.3、98.8(RSD=0.51%,n=3)。结论:了哥王有效成分的提取方法选用渗漉法,优选出的渗漉法提取工艺稳定、重现性好。
了哥王;提取工艺;正交试验;伞形花内酯;西瑞香素;渗漉法
了哥王[Wikstroemia indica(Linn.)C.A.Mey.]为瑞香科荛花属植物[1],为南方常用苗药,主要分布于广西、广东、江西、贵州等地[2],其根、茎、叶和果实均可入药。了哥王性寒、味苦、辛、微温、有大毒,归肺、肝经,具有清热解毒、消肿散结、止痛等功效。目前,从了哥王中分离得到的80多种化合物可分为十大类[3-12]:香豆素类、木脂素类、黄酮类、蒽醌类、甾族类、皂苷类、萜类、酰胺类、多糖和挥发油,此外,还含有大量的酯、酮、烯及醇类化合物等。了哥王具有抗菌、抗炎镇痛、抗病毒、抗肿瘤、抗疟、利尿、引产、镇咳袪痰等药理作用[13-15],临床广泛用于急性扁桃体炎、慢性支气管炎、颈淋巴结肿大、乳腺炎等疾病的治疗,另外对肝炎、肝硬化、肝腹水、肢体疼痛、带状疱疹、皮下剥离伤、坐骨神经痛等也有一定的疗效,还可用于治疗多种癌症如乳腺癌、恶性淋巴癌、肺癌及各种体表癌[16]。了哥王如得到合理开发利用,则有希望成为最有开发价值的民族药之一,市场潜力巨大。本研究主要以了哥王提取物主要有效成分西瑞香素和伞形花内酯含量为指标,对了哥王有效成分的提取方法进行筛选,再对最优提取方法的工艺条件进行优选,确定其最优提取工艺,为了哥王的深入开发提供基础。
1 材料
1.1 仪器
1260型高效液相色谱(HPLC)仪(美国安捷伦科技有限公司);粉碎机(浙江大鹏机械有限公司);LT1002E型电子天平(常熟市天量仪器有限责任公司);RE52-99型旋转蒸发仪(上海亚荣生化仪器厂);FA2004型电子分析天平(上海衡平仪器仪表厂);HH-S4型水浴锅(北京科伟永兴仪器有限公司);DZF-6020型减压真干燥箱(上海博迅实业有限公司医疗设备厂);KQ-3200DA型数控超声波清洗器(昆山市超声仪器有限公司)。
1.2 药材、药品与试剂
了哥王药材(2016年1月10日采购于广西壮族自治区玉林市玉州区玉林银丰国际中药港,经贵阳中医学院李玮副教授鉴定为正品);西瑞香素对照品(中国食品药品检定研究院,批号:111758,纯度:>98%);伞形花内酯对照品(北京坛墨质检科技有限公司,批号:BW 5534,纯度:>98%);乙醇等为分析纯,水为娃哈哈纯净水。
2 方法与结果
2.1 吸水率的测定
称取了哥王药材粗粉100 g,置于具塞广口瓶中,加水分别浸泡20、30、45m in与1、2、12 h后取出,称取湿药材的质量,计算其吸水率[(药材湿质量-药材干质量)/药材干质量×100%]。结果显示,各时间点吸水率分别为 320.13%、380.56%、388.11%、389.19%、390.15%、391.14%。药材粗粉在20min内吸水很快,吸水量为原药材的3.2倍;到30min,仍有较大的吸水率,吸水率从原药材的3.2倍增加到3.8倍;从30min到45min,增加的幅度较小,延长其浸泡时间到12 h,也未见明显吸水,吸收曲线呈直线,故选择该药材操作浸泡时间为30m in。
2.2 提取方法
2.2.1 渗漉法 取了哥王药材粗粉100 g,用2.5倍量70%乙醇浸润1 h,装筒、浸泡48 h,按3m L/(min·kg)的流速渗漉,用12倍量的70%乙醇渗漉至无色无味。收集渗漉液,混合,回收乙醇,浓缩,干燥成干浸膏,粉碎成细粉,得了哥王乙醇提取物浸膏粉。
2.2.2 煎煮法 称取了哥王药材粗粉100 g,置于煎煮容器中,第1次加12.8倍量水,浸泡30min,煎煮1.5 h;第2次加6倍量水,煎煮1.0 h;第3次加6倍量水,煎煮0.5 h;过滤,合并3次煎煮液,浓缩,干燥,粉碎成细粉备用。
2.2.3 回流提取法 取了哥王药材粗粉100 g,置于回流提取装置中,第1次加12.8倍量70%乙醇,浸泡30 min,回流提取1.5 h;第2、3次分别加6倍量70%乙醇,各回流提取1 h;过滤,合并3次提取液,回收乙醇,浓缩,干燥,粉碎成细粉备用。
2.3 伞形花内酯和西瑞香素的含量测定
2.3.1 对照品溶液制备 分别精密称取伞形花内酯、西瑞香素对照品33.00、21.00mg,置于50m L量瓶中,用甲醇溶解并稀释至刻度,摇匀,制成质量浓度分别为0.660、0.420mg/m L的对照品贮备液,4保存,备用。取贮备液稀释制成二者质量浓度分别约为0.330、0.210 mg/m L的混合对照品溶液,4保存,备用。
2.3.2 供试品溶液制备 精密称取了哥王提取物粉末约0.5 g,置于具塞三角烧瓶中,加甲醇30m L超声(超声功率:150W,超声频率:40 kHz)提取30m in,过滤,挥干滤液。残渣用甲醇溶解,溶液转移至10m L量瓶中,并稀释至刻度,摇匀,用0.45μm微孔滤膜过滤,取续滤液作为供试品溶液。
2.3.3 色谱条件与系统适用性试验 色谱柱:Diamonsil C1(8250mm×4.6mm,5μm);紫外检测器(波长:0~15min,324 nm;15~45min,346 nm);流动相:乙腈(A)-0.2%磷酸水溶液(B),梯度洗脱(0~5m in,22%~25% A;5~15m in,25%~25%A;15~20m in,25%~30%A;20~25m in,30%~33%A;25~30m in,33%~30%A;30~35m in,30%~28%A;35~40m in,28%~25%A;40~45 m in,25%~22%A);流速:1 m L/min;柱温:30;进样量:20µL。在此条件下分别取混合对照品溶液和供试品溶液(渗漉法提取物)注入色谱仪。结果表明,伞形花内酯和西瑞香素成分能与其他成分达到较好的分离,分离度均大于1.5,理论板数均不低于3 000,色谱图见图1。

图1 高效液相色谱图Fig 1 HPLC chromatogram
2.3.4 线性关系考察 分别精密吸取混合对照品溶液0.5、1.0、2.0、3.0、4.0、5.0、6.0、10.0m L至10m L量瓶中,甲醇定容,摇匀,用0.45μm微孔滤膜滤过,收集续滤液,进样测定峰面积,记录色谱图。以进样量为横坐标(x)、峰面积为纵坐标(y)绘制标准曲线,经计算得伞形花内酯回归方程为y=57.086x+37.736(r=0.999 7),西瑞香素回归方程为y=41.162x+2.962 8(r=0.999 2)。结果表明,伞形花内酯、西瑞香素分别在0.33~6.60μg、0.21~4.20μg进样量范围内与峰面积线性关系良好。
2.3.5 精密度、重复性、稳定性和准确度试验 按相关方法进行操作。结果,精密度试验中伞形花内酯和西瑞香素峰面积的RSD分别为1.73%、1.51%(n=6);重复性试验中二者含量的RSD分别为2.25%、0.73%(n=6);稳定性试验中48 h内二者峰面积的RSD分别为0.74%、1.30%(n=7);准确度试验中二者平均回收率分别为98.73%、99.98%(RSD分别为2.59%、1.84%,n=9)。2.3.6 含量测定 精密吸取供试品溶液20µL,按“2.3.3”项下色谱条件进样测定,计算各提取物中有效成分的含量。
2.4 浸膏收率测定
将“2.2”项下3种方法提取的浸膏置于蒸发皿中,干燥至恒质量,计算浸膏收率,浸膏收率(%)=浸膏质量/药材粗粉质量×100%。
2.5 3种提取方法结果比较
以伞形花内酯、西瑞香素的含量和浸膏收率为评价指标,其加权评分分别为30、30、40,综合评分(Y)=各方法样品中伞形花内酯的含量/3种方法样品中伞形花内酯含量的最大值×30+各方法样品中西瑞香素的含量/ 3种方法样品中西瑞香素含量的最大值×30+各方法样品中浸膏收率/3种方法样品中浸膏收率最大值×40,以综合评分值的大小评价提取方法,结果见表1。
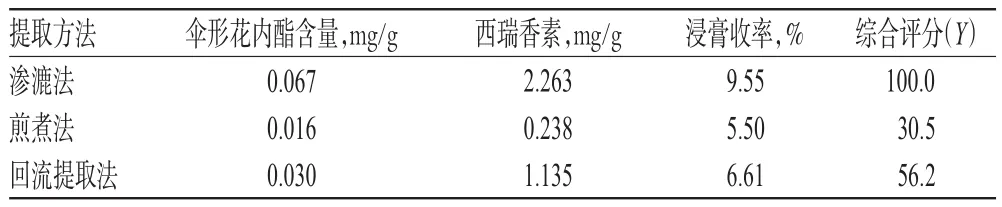
表1 不同提取方法评价结果(n=3)Tab 1 Evaluation results of different extraction methods(n=3)
由表1可知,在3种提取方法中,各单一及综合指标高低顺序均为渗漉法>回流提取法>煎煮法,即在这3种提取方法中以渗漉法的提取效果最好,选此方法进行提取工艺优化试验。
2.6 正交试验优化渗漉法提取工艺
2.6.1 因素与水平的确立 在渗漉法中,影响有效成分提取的因素主要有溶剂量(A)、乙醇体积分数(B)、渗漉速度(C),根据预试验结果,采用3因素3水平设计正交试验。因素与水平见表2。

表2 因素与水平Tab 2 Factorsand levels
2.6.2 正交试验设计与结果 称取了哥王粗粉30 g,共9份,按正交试验设计进行提取、溶液制备、测定并计算相关指标,结果见表3,方差分析结果见表4。
由表3直观分析表明,以综合评分为标准,由极差(R)的大小可知,影响因素A>B>C,其中A3>A2>A1、B2>B3>B1、C2>C1>C3,即提取工艺最优条件为A3B2C2;又由表4方差分析表明,A与B有显著影响(P<0.05)。考虑到实际提取过程中的成本及提取效率因素,综合后确定其最优提取工艺条件为A3B2C2,即加14倍量70%乙醇,以5m L/(min·kg)流速进行渗漉提取。
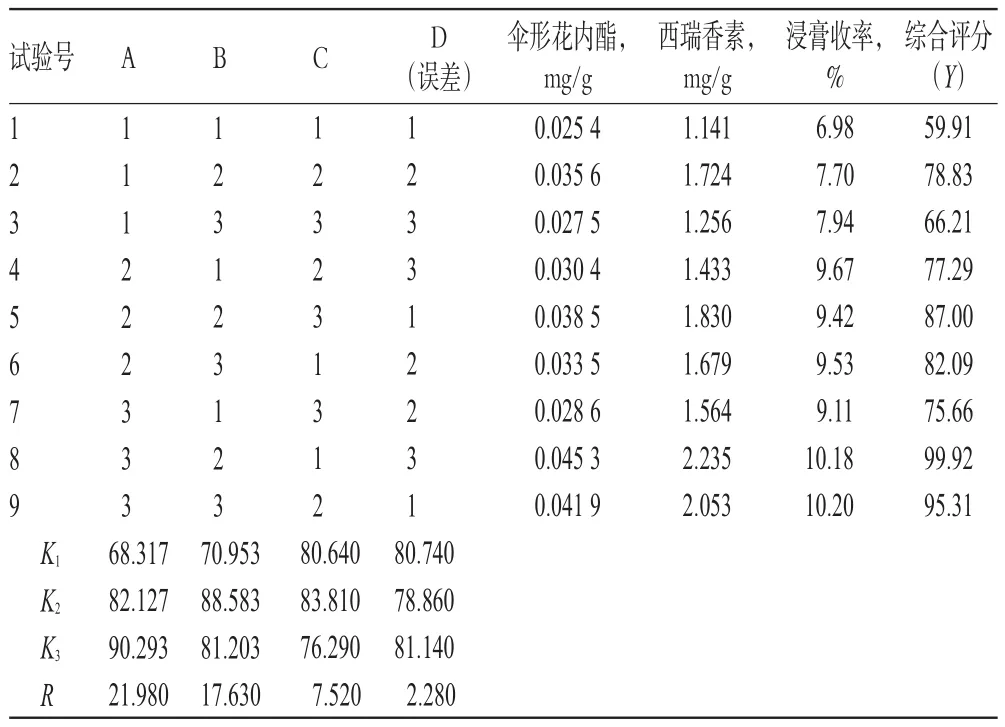
表3 正交试验设计与结果Tab 3 Design and resu ltsof orthogonal test

表4 方差分析结果Tab 4 Variance analysis results
2.7 提取液的浓缩干燥工艺的筛选
按优化的提取工艺参数分别提取2批药液,一批按常压浓缩干燥法(温度80),另一批采用低压真空浓缩干燥法(温度60,真空度0.07~0.08MPa),测定其浸膏收率和伞形花内酯、西瑞香素的含量,筛选浓缩干燥方法。结果两种方法下3个指标的平均值分别为9.57%、9.68%,0.044 9、0.045 2mg/g,2.226、2.312mg/g,性状分别为棕褐色块状固体和棕褐色疏松固体。这表明两种方法比较各指标差异不大,但采用低压真空浓缩干燥法所得浸膏干燥疏松,故选择其为了哥王提取液的浓缩干燥方法。
2.8 工艺验证
称取了哥王药材3批,每批10 kg,按优化的提取工艺条件,进行提取、浓缩、干燥,并测定其伞形花内酯、西瑞香素的含量和浸膏收率。结果,3次试验中伞形花内酯含量分别为0.044 3、0.044 0、0.045 0mg/g,西瑞香素的含量分别为2.248、2.285、2.257mg/g,浸膏收率分别为9.95%、10.14%、9.93%,综合评分分别为98.3、99.3、98.8(RSD=0.51%,n=3),提示优化的提取工艺重现性好、稳定、可行。
3 讨论
在前期进行的含量测定预试验中,对多种流动相组成(甲醇-水、甲醇-0.1%磷酸水、乙腈-水、乙腈-0.2%磷酸水溶液)及洗脱方式(等度、梯度)进行了考察,并对检测波长(324、350、346 nm)、流速(0.8、1.0m L/m in)、柱温(25、30、35)等进行了筛选,最后确定了乙腈-0.2%磷酸水溶液为流动相、梯度洗脱、不同时间切换波长(0~15min,324 nm;15~45min,346 nm)的条件,结果表明各峰间分离度较好、基线平稳、试验重复性较好、含量测定结果准确。
了哥王的根及茎非常坚硬,纤维性非常强,含糖、淀粉类及水溶性的成分少,大多数有效成分易溶于乙醇及有机溶剂,但在临床及药物生产过程中不可能大量使用有毒及对环境污染较大的有机溶剂,故在研究过程中大多使用水及不同体积分数的乙醇作为提取溶剂。在前期研究中,笔者用浸渍法提取了哥王的有效成分,但该方法提取周期长,提取过程中提取溶剂不易形成浓度差,故提取效率低;另外李姣姣等[17]采用超声波结合微波提取法对了哥王的黄酮类成分进行了提取,该方法也只是针对某一类有效部位的提取。了哥王的临床应用大多以煎剂为主,但在近几年的研究过程中,笔者发现了哥王的大多有效成分不仅不易溶于水,而且容易被热破坏,故结合实际,笔者对了哥王的常用提取方法煎煮法、渗漉法和回流提取法进行了筛选。结果表明,渗漉法的提取效果更好,有效成分及浸膏收率相对较高,加热对药物的破坏小,故选择渗漉法为了哥王药材有效成分的最优提取方法。
西瑞香素和伞形花内酯是了哥王香豆素类成分的主要有效成分,也是了哥王抗肿瘤、抗炎、抗真菌、抗病毒、抗焦虑的有效成分[9,16,18-19],故选择二者含量为提取工艺条件优化的主要指标。
了哥王为常用苗药,其疗效确切,但毒性较大[20],在《岭南采药录》《广西中药志》等著作中均有“大毒”“有毒”的记载。本研究为其后续毒性、药效、药理及炮制增效减毒机制的研究及进一步开发利用提供了一定的基础。
[1] 张庆荣,夏光成.有毒中草药彩色图鉴[M].天津:天津科技翻译出版公司,2006:131.
[2] 浙江植物志编辑委员会.浙江植物志:第四卷[M].杭州:浙江科学技术出版社,1999:255-256.
[3] 易文燕,刘明,陈敏,等.了哥王化学成分研究[J].时珍国医国药,2012,23(12):3001-3003.
[4] 国光梅,汪冶,李玮,等.了哥王石油醚提取部位化学成分研究[J].科学技术与工程,2014,14(21):187-190.
[5] 国光梅,李玮,汪冶,等.了哥王甾醇化合物的研究[J].山地农业生物学报,2012,31(1):77-79.
[6] 刘明,李玮,徐丹,等.了哥王脂溶性成分的气相色谱-质谱联用分析[J].时珍国医国药,2011,22(5):1102-1103.
[7] 国光梅,李玮,汪冶,等.了哥王中木脂素成分及生物活性研究[J].山地农业生物学报,2012,31(5):457-459.
[8] Wei L,Wang X,Mu S,et al.U ltra high performance liquid chromatography w ith electrospray ionization tandem mass spectrometry coupled w ith hierarchical cluster analysis to evaluate Wikstroem ia indica(L.)C.A.Mey.from differentgeographical regions[J].JSep Sci,2015,38(12):2093-2100.
[9] Lu CL,Zhu L,Piao JH,etal.Chemical compositions extracted from Wikstroemia indica and theirmultiple activities[J].Pharm Biol,2012,50(2):225-231.
[10]Wang GC,Zhang XL,Wang YF,etal.Four new dilignans from the roots of Wikstroemia indica[J].Chem Pharm Bull,2012,60(7):920-923.
[11] Li J,Lu LY,Zeng LH,etal.A new C-3/C-3″-biflavanone from the roots ofWikstroem ia indica[J].Molecules,2012,17(7):7792-7797.
[12] Ko YC,Feng HT,Lee RJ,etal.The determination of flavonoids in Wikstroem ia indica C.A.Mey.by liquid chromatography w ith photo-diode array detection and negative electrospray ionization tandem mass spectrometry[J].Rapid Commun MassSpectrom,2013,27(1):59-67.
[13] Shao M,Huang XJ,Liu JS,etal.A new cytotoxic biflavonoid from the rhizome ofWikstroem ia indica[J].Nat Prod Res,2016,30(12):1417-1422.
[14]HuangWH,Zhou GX,Wang GC,etal.A new biflavonoid w ith antiviralactivity from the rootsofWikstroem ia indica [J].JAsian NatProd Res,2012,14(4):401-406.
[15] 张金娟,熊英,李玮,等.了哥王炮制前后的药效比较研究[J].时珍国医国药,2015,26(5):1118-1120.
[16] 邵萌,黄晓君,孙学刚,等.了哥王根茎中的酚性成分及其抗肿瘤活性研究[J].天然产物研究与开发,2014,26(6):851-855、875.
[17] 李姣姣,李超.了哥王总黄酮的超声波协同微波提取工艺及其抗氧化活性研究[J].食品科学,2010,31(16):101-105.
[18] 段志富,陈建伟,李祥.伞形科药用植物中香豆素类成分及其药理作用研究现状[J].中国药房,2008,19(3):223-225.
[19] Ho WS,Xue JY,Sun SS,etal.Antiviral activity of daphnoretin isolated from Wikstroem ia indica[J].Phytother Res,2010,24(5):657-661.
[20] 张金娟,熊英,李玮,等.了哥王生品及2种炮制品的急性毒性比较研究[J].中国中药杂志,2011,36(9):1172-1174.
Extraction Technology Optim ization of M iao M edicine Wikstroem ia indica by Orthogonal Test and Com p rehensive Scoring M ethod
FENG Guo1,2,3,LIWei2,3,HE Xin1,WU Zengguang1,ZHENG Chuanqi2,TIAN Xiaofang2,LENG Anbi2,LIYue2(1. School of Chinese Medicine,Tianjin University of Traditional Chinese Medicine,Tianjin 300193,China;2. School of Pharmacy,Guiyang College of Traditional Chinese Medicine,Guiyang 550025,China;3.Academician Workstation,Guiyang College of Traditional Chinese Medicine in Guizhou,Guiyang 550025,China)
OBJECTIVE:To optim ize the extraction technology of Wikstroemia indica.METHODS:Using the active ingredient contents of umbelliferone and daphnoretin,and extraction yield as comprehensive evaluation indexes,solvent dosage,ethanol volume fraction,percolation rate as investigation factors,single factor testwas conducted to compare the 3 extractionmethods(percolation method,boiling method,reflux extraction method),and screen the optim ized one;and the technology conditions of optim ized method were optim ized and verified.RESULTS:The comprehensive score ordered as percolation method,reflux extraction method,boiling method,which was better by percolation method.The optimal technology conditions was as follow as percolation solvent of 70%ethanol,14-fold herbs at percolation rate of 5m L/(min·kg);the comprehensive scores in 3 testswere 98.3,99.3,98.8(RSD=0.51%,n=3).CONCLUSIONS:Percolation method is optim ized for extracting active ingredient of W.indica,which is stable and reproducible.
Wikstroemia indica;Extraction technology;Orthogonal test;Umbelliferone;Daphnoretin;Percolationmethod
R284.2
A
1001-0408(2017)16-2216-04
2016-09-20
2016-12-14)
(编辑:刘 萍)
国家科技支撑计划课题(No.2007BAI48B08-1);国家级大学生创新创业训练计划项目(No.201610662025);国家工程技术研究中心组建项目(No.2014FU125Q09);国家中医药管理局省(市)级中药炮制技术传承基地建设项目(No.国中医科技〔2015〕136号);贵州省高校工程技术研究中心建设项目(No.黔教合KY字〔2012〕021号)
*副教授,硕士。研究方向:中药新制剂与新技术、药动学。电话:0851-88233090。E-mail:453989352@qq.com
DOI10.6039/j.issn.1001-0408.2017.16.15
