血脂平胶囊对高血脂模型金黄地鼠血脂水平的影响及机制研究
2017-07-03张海晶杨明华孙晓波孙桂波哈尔滨商业大学生命科学与环境科学研究中心哈尔滨50076中国医学科学院北京协和医学院药用植物研究所北京0093
申 强,张海晶,杨明华,孙晓波,孙桂波#(.哈尔滨商业大学生命科学与环境科学研究中心,哈尔滨50076;.中国医学科学院北京协和医学院药用植物研究所,北京 0093)
血脂平胶囊对高血脂模型金黄地鼠血脂水平的影响及机制研究
申 强1*,张海晶2,杨明华1,孙晓波2,孙桂波2#(1.哈尔滨商业大学生命科学与环境科学研究中心,哈尔滨150076;2.中国医学科学院北京协和医学院药用植物研究所,北京 100193)
目的:研究血脂平胶囊对高血脂模型金黄地鼠血脂水平的影响及其可能机制。方法:将金黄地鼠随机分为正常对照组、模型组、阿托伐他汀组(3mg/kg)、联用组(血脂平胶囊1.3 g/kg+阿托伐他汀1.5mg/kg)和血脂平胶囊低、中、高剂量组(血脂平胶囊1.3、2.6、5.2 g/kg),每组10只。正常对照组地鼠给予普通饲料,其他组地鼠给予高脂饲料建立高血脂模型,2周后同时ig给予相应药物,正常对照组和模型组地鼠ig等体积的蒸馏水,每日1次,连续给药4周。末次给药后,检测各组地鼠血脂指标[总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、游离脂肪酸(FFA)],肝组织中脂质代谢相关基因(PPAR-α、CYP7A1、ACOX、SREBP-1c、ACC1)mRNA及蛋白表达。结果:与正常对照组比较,模型组地鼠血清TC、TG、LDL-C、FFA含量增加,HDL-C含量降低,PPAR-α、CYP7A1、ACOXmRNA及蛋白表达减弱,SREBP-1c、ACC1mRNA及蛋白表达增强(P<0.05)。与模型组比较,血脂平胶囊高剂量组、阿托伐他汀组和联用组地鼠上述指标均明显改善(血脂平高剂量组HDL-C除外)(P<0.05);血脂平胶囊中剂量组地鼠TC、TG、FFA含量和PPAR-α、CYP7A1、ACOX、ACC1mRNA及CYP7A1、SREBP-1c、ACC1蛋白表达均明显改善(P<0.05);血脂平胶囊低剂量组地鼠TC、TG含量和PPAR-αmRNA及CYP7A1、SREBP-1c蛋白表达均明显改善(P<0.05)。结论:血脂平胶囊具有降血脂作用,其机制可能与激活PPAR-α和抑制SREBP-1c信号通路有关。
血脂平胶囊;高血脂;降血脂;作用机制;金黄地鼠
由于不良生活方式的影响,在中国,高脂血症(Hyperlipidem ia,HLP)已成为一种常见的代谢性疾病。该疾病特点为脂代谢异常,包括总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白(LDL)异常升高和高密度脂蛋白(HDL)显著降低[1]。最新的流行病学研究发现,中国有30万年龄超过20岁的成年人TC高于5.18mmol/L,约20万人低密度脂蛋白胆固醇(LDL-C)高于3.37mmol/L[2]。HLP已被公认为动脉粥样硬化和冠心病的重要诱因[3-4]。降低LDL可有效减少HLP的发生[5],因此,降血脂对于治疗血管疾病起着至关重要的作用。
血脂平胶囊由刺梨、徐长卿、绞股蓝、山楂等常用中药组成,具有健脾除湿、消食化滞的功效,临床用于HLP的治疗。研究显示,血脂平胶囊可显著降低血脂,且具有促进血液循环、增强抗动脉粥样硬化的作用[6]。但是关于血脂平的降血脂机制尚未见文献报道,该药降低血脂的分子机制尚不明确。因此,本文通过研究血脂平胶囊对高血脂模型金黄地鼠血脂水平的影响及其作用机制,为血脂平胶囊对HLP的调节作用提供一定的理论依据。
1 材料
1.1 仪器
MQX200型酶标仪(帝肯上海贸易有限公司);AU480型全自动生化分析仪(贝克曼库尔特株式会社);A101439型电泳仪、CFX96型实时定量聚合酶链式反应(RT-PCR)仪和ChemiDOCTM型凝胶成像仪(伯乐生命医学产品上海有限公司)。
1.2 药品与试剂
血脂平胶囊[朗致集团贵州太和制药有限公司,批号:20150401,规格:0.3 g/粒,相当于1.2 g(生药)/粒];阿托伐他汀钙片(爱尔兰Pfizer公司,批号:L46448,规格:每片20mg);TC(批号:150721)、TG(批号:150821)、HDL-C(批号:150701)、LDL-C(批号:150781)检测试剂盒(北京中生北控生物科技股份有限公司);游离脂肪酸(FFA)超敏测定试剂盒(北京普利莱基因技术有限公司,批号:E1001);总RNA提取、反转录和RT-PCR试剂盒,(宝生物工程大连有限公司);胆固醇调节元件结合蛋白1c(SREBP-1c)抗体(美国 Abcam公司,批号:ab140483);过氧化物酶体增殖物激活受体α(PPAR-α)抗体、乙酰辅酶A羧化酶(ACC1)抗体(美国Proteintech公司,批号:15540-1、21923-1);胆固醇7-羟化酶(CYP7A1)抗体、过氧化物酶酰基辅酶A氧化酶(ACOX)抗体(美国Santa Cruz公司,批号:sc-25536、sc-98499);β-肌动蛋白(β-actin)、β-微管蛋白(β-tubulin)和羊抗鼠、羊抗兔二抗(北京康为世纪生物科技有限公司,批号:CW 0096M、CW 0098M、CW 0102M、CW 0103M)。
1.3 动物与饲料
金黄地鼠70只,♂,6~8周龄,体质量90~110 g,购自北京维通利华实验动物技术有限公司,合格证号为SCXK(京)2012-0001。金黄地鼠分笼养于中国医学科学院药用植物研究所SPF级动物房内,室温为22~25、湿度为50%~70%,昼夜12 h交替饲养,自由饮水及摄食。高脂饲料:15%猪油、0.2%胆固醇、84.8%基础饲料,由北京华阜康生物科技股份有限公司提供,生产许可证号为京饲证(2014)06057。
2 方法
2.1 分组与给药
金黄地鼠适应性喂养1周后随机分为正常对照组、模型组、阿托伐他汀组(3mg/kg)、联用组(血脂平胶囊1.3 g/kg+阿托伐他汀1.5mg/kg)和血脂平胶囊低、中、高剂量组(血脂平胶囊1.3、2.6、5.2 g/kg),每组10只。正常对照组地鼠给予普通饲料,其余组地鼠给予高脂饲料,2周后同时ig相应药物,正常对照组和模型组地鼠ig等体积的蒸馏水,每日1次,连续4周。
2.2 血清中血脂指标测定
末次给药后,地鼠禁食不禁水12 h,眼眶静脉取血,4 、3 000 r/m in(离心半径6.5 cm)离心10m in,取上清。采用全自动生化分析仪检测各组地鼠血清中TG、TC、HDL-C、LDL-C水平;酶联免疫吸附法(ELISA)检测FFA含量,试验按试剂盒要求操作。
2.3 肝组织中脂质代谢相关基因测定
使用Primer 5软件设计基因引物,Oligo7软件评价引物。PCR引物由北京睿博兴科生物技术有限公司合成。提取各组地鼠肝组织总RNA,测定RNA浓度及260、280 nm波长处吸光度比值(A260/A280),并将总RNA反转录为cDNA,配置PCR反应体系,SYBR Green RTPCR法检测各组地鼠肝组织中脂质代谢相关基因SREBP-1c、PPAR-α、ACC1、CYP7A1、ACOX mRNA表达。RT-PCR的反应条件:95预变性30 s,两步法进行扩增,即955 s、6030 s,40个循环。RT-PCR仪自动绘制融解曲线。以目标基因与内参(β-actin)的比值评价相关基因的表达。PCR引物序列见表1。

表1 PCR引物序列Tab 1 PCR primer sequence
2.4 肝组织中脂质代谢相关蛋白测定
提取肝组织中总蛋白,二喹啉甲酸(BCA)法测定其浓度后制样,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离目标蛋白,转移到聚偏二氟乙烯(PVDF)膜上,5%脱脂奶粉常温封闭后,将膜先后与相应的一抗、二抗室温孵育,并洗去未结合的抗体,增强化学发光试剂(ECL)曝光。检测各组地鼠肝组织中脂质代谢相关蛋白SREBP-1c、PPAR-α、ACC1、CYP7A1、ACOX的表达,分别以目标蛋白与内参(β-actin和β-tubulin)的比值评价蛋白表达。
3 结果
3.1 血脂指标测定结果
与正常对照组比较,模型组地鼠血清中TC、TG、LDL-C水平和FFA含量均增加(P<0.05或P<0.01),表明实验期间HLP模型造模成功。与模型组比较,血脂平胶囊高剂量组、阿托伐他汀组和联用组地鼠上述指标(血脂平胶囊高剂量组HDL-C除外)均明显改善(P<0.05或P<0.01);血脂平胶囊中剂量组地鼠血清中TC、TG、FFA均降低(P<0.01);血脂平胶囊低剂量组地鼠TC、TG均降低(P<0.05)。各组地鼠血脂指标测定结果见表2。
表2 各组地鼠血脂指标测定结果(±s,n=10)Tab 2 Determ ination results of blood lipid indexes in each group ofham ster(±s,n=10)
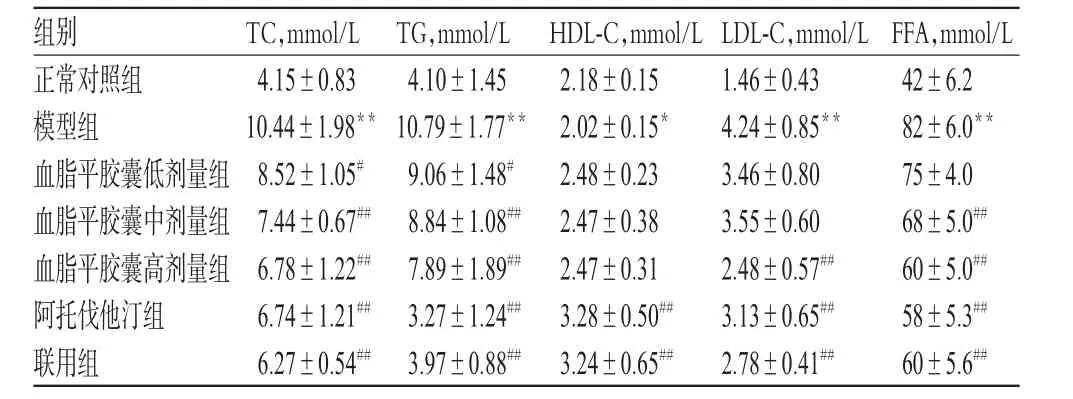
表2 各组地鼠血脂指标测定结果(±s,n=10)Tab 2 Determ ination results of blood lipid indexes in each group ofham ster(±s,n=10)
注:与正常对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01Note:vs.normal control group,*P<0.05,**P<0.01;vs.model group,#P<0.05,##P<0.01
正常对照组模型组血脂平胶囊低剂量组血脂平胶囊中剂量组血脂平胶囊高剂量组阿托伐他汀组联用组42±6.2 82±6.0**75±4.0 68±5.0##60±5.0##58±5.3##60±5.6##4.15±0.83 10.44±1.98**8.52±1.05#7.44±0.67##6.78±1.22##6.74±1.21##6.27±0.54##4.10±1.45 10.79±1.77**9.06±1.48#8.84±1.08##7.89±1.89##3.27±1.24##3.97±0.88##2.18±0.15 2.02±0.15*2.48±0.23 2.47±0.38 2.47±0.31 3.28±0.50##3.24±0.65##1.46±0.43 4.24±0.85**3.46±0.80 3.55±0.60 2.48±0.57##3.13±0.65##2.78±0.41##
3.2 肝组织中脂质代谢相关基因测定结果
与正常对照组比较,模型组地鼠肝组织中PPAR-α、CYP7A1、ACOX mRNA表达减弱,SREBP-1c、ACC1 mRNA表达增强(P<0.01)。与模型组比较,阿托伐他汀组、联用组和血脂平胶囊中、高剂量组地鼠上述指标(血脂平胶囊中剂量组SREBP-1c除外)均明显改善(P<0.05或P<0.01)。各组地鼠肝组织中脂质代谢相关基因mRNA表达的测定结果见表3。
表3 各组地鼠肝组织中脂质代谢相关基因mRNA表达的测定结果(±s,n=10)Tab 3 Determ ination resultsof lipidmetabolism related genes m RNA expressions in liver tissue in each group of ham ster(±s,n=10)
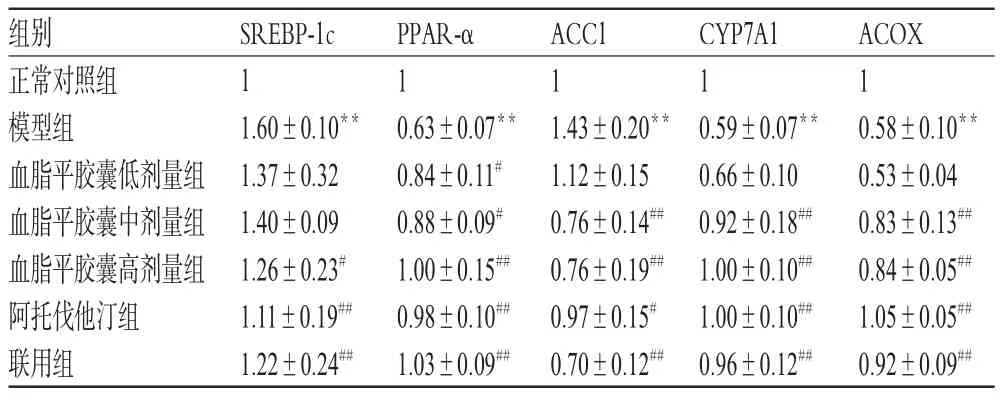
表3 各组地鼠肝组织中脂质代谢相关基因mRNA表达的测定结果(±s,n=10)Tab 3 Determ ination resultsof lipidmetabolism related genes m RNA expressions in liver tissue in each group of ham ster(±s,n=10)
注:与正常对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01 Note:vs.normal control group,**P<0.01;vs.model group,#P<0.05,##P<0.01
组别正常对照组模型组血脂平胶囊低剂量组血脂平胶囊中剂量组血脂平胶囊高剂量组阿托伐他汀组联用组ACOX 1 0.58±0.10**0.53±0.04 0.83±0.13##0.84±0.05##1.05±0.05##0.92±0.09##SREBP-1c 1 1.60±0.10**1.37±0.32 1.40±0.09 1.26±0.23#1.11±0.19##1.22±0.24##PPAR-α 1 0.63±0.07**0.84±0.11#0.88±0.09#1.00±0.15##0.98±0.10##1.03±0.09##ACC1 1 1.43±0.20**1.12±0.15 0.76±0.14##0.76±0.19##0.97±0.15#0.70±0.12##CYP7A1 1 0.59±0.07**0.66±0.10 0.92±0.18##1.00±0.10##1.00±0.10##0.96±0.12##
3.3 肝组织中脂质代谢相关蛋白测定结果
与正常对照组比较,模型组地鼠肝组织中PPAR-α、CYP7A1、ACOX蛋白表达减弱,SREBP-1c、ACC1蛋白表达增强(P<0.01)。与模型组比较,其余各组地鼠肝组织中SREBP-1c、ACC1(血脂平胶囊低剂量组除外)蛋白表达减弱(P<0.05或P<0.01),血脂平胶囊高剂量组、阿托伐他汀组和联用组地鼠肝组织中PPAR-α、ACOX(联用组除外)、CYP7A 1蛋白表达增强(P<0.05或P<0.01)。各组地鼠肝组织中脂质代谢相关蛋白表达的电泳图见图1,表达结果见图2。

图1 各组地鼠肝组织中脂质代谢相关蛋白表达的电泳图Fig 1 Electrophoresis chart of lipid metabolism related protein expressions in liver tissue in each group of ham ster
4 讨论
PPAR-α是配体激活的转录因子过氧化物酶体增殖物激活受体(PPARs)的亚型之一,属于核受体亚家族,参与调控FFA转运、脂质氧化和脂蛋白合成组装等相关基因的表达[7]。PPAR-α高表达于代谢活跃的组织,研究发现,PPAR-α可维持正常脂肪酸稳态,预防酒精性脂肪肝的发生[8]。同时,有研究发现,PPAR-α通过对其下游基因CYP7A1的调控,可促进胆固醇向胆汁酸转化,并通过增强胆汁酸的有效排出而降低血液TC水平[9]。ACOX为PPAR-α调控的下游基因,是脂肪细胞与脂肪酸的氧化相关酶,同时也是过氧化酶体内β-氧化系统的起始酶[10]。本研究发现,血脂平胶囊可通过上调PPAR-α表达促进其下游基因ACOX1表达,进而调节细胞中的脂肪酸代谢,同时促进CYP7A1的mRNA及蛋白表达,起到降低TC的作用。
肝脏脂肪酸从头合成是体内脂质合成的重要来源之一,肝细胞自身合成TG的三分之一是通过脂质从头合成途径的,其余三分之二来自于外源性FFA的合成[11]。SREBP-1c是调节脂肪酸和TG合成相关酶表达的转录因子[12]。高脂饮食可上调SREBP-1c,进而使其下游脂肪酸合成关键酶ACC1高表达,引起肝脏脂质合成增多,导致脂肪变性[13-14]。本研究结果发现,血脂平胶囊均通过下调SREBP-1c表达,而降低其下游的ACC1表达以达到调节血脂的目的,且对于ACC1的调节作用优于阿托伐他汀。当阿托伐他汀剂量减半与血脂平胶囊合用时,其药效与阿托伐他汀相当甚至更优,还可以降低他汀类药物长期用药的不良反应风险。
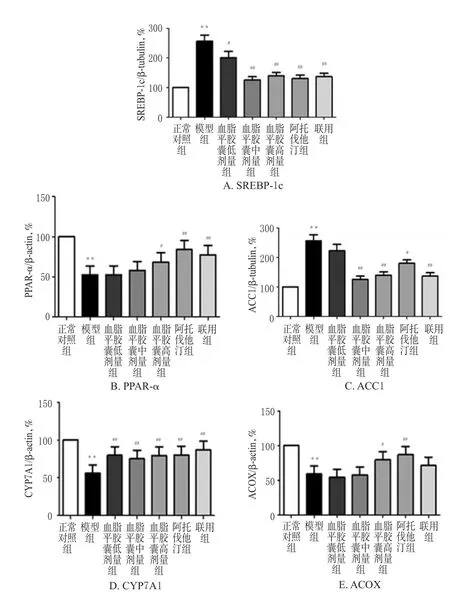
注:与正常对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01Note:vs.normal control group,**P<0.01;vs.model group,#P<0.05,##P<0.01
综上所述,血脂平胶囊具有良好的降血脂作用,其降脂机制可能与激活PPAR-α和抑制SREBP-1c信号通路有关。而血脂平胶囊具体通过什么分子机制激活PPAR-α与SREBP-1c,有待进一步研究。
[1] Liu TN,Wu CT,He F,et al.Relationship between the
G75A polymorphism in the apolipoprotein A1(ApoA1) gene and the lipid regulatory effects of pravastatin in patients w ith hyperlipidemia[J].Genet Mol Res,2016,15(2):1-6.
[2] YangW,Xiao J,Yang Z,etal.Serum lipids and lipoproteins in Chinese men and women[J].Circulation,2012,125(18):2212-2221.
[3] Jacobson TA,Ito MK,MakiKC,etal.National lipid association recommendations for patient-centered management of dyslipidem ia:part 1:executive summary[J].Clin Lipidol,2014,8(5):473-488.
[4] 罗海东,李振中.辛伐他汀联合非诺贝特对比单用辛伐他汀治疗高脂血症疗效与安全性的系统评价[J].中国药房,2015,26(12):1658-1661.
[5] Cholesterol Treatment Trialists’(CTT)Collaboration.Lack of effectof lowering LDL cholesterol on cancer:metaanalysis of individual data from 175 000 people in 27 random ised trials of statin therapy[J].PLoSOne,2012,7(1):e29849.
[6] 李泽荣,丘栋.辛伐他汀联合血脂平胶囊治疗高脂血症的临床疗效[J].中国卫生产业,2012,9(19):88-89.
[7] Piccinin E,Moschetta A.Hepatic-specific PPARα-FGF21 action in NAFLD[J].Gut,2016,65(7):1075-1076.
[8] Montagner A,PolizziA,FouchéE,etal.Liver PPARαis crucial for whole-body fatty acid homeostasis and is protective againstNAFLD[J].Gut,2016,65(7):1202-1214.
[9] Rui J,Zhang ZS,Yu HJ,etal.Hypocholesterolemic activity of grape seed proanthocyanidin ismediated by enhancement of bile acid excretion and up-regulation of CYP7A1 [J].JNutr Biochem,2010,21(11):1134-1139.
[10] 武俊紫,牛世伟,贾亚敏,等.艾塞那肽通过调控PPARα及ACOX1改善大鼠非酒精性脂肪肝病症状[J].基础医学与临床,2014,34(4):464-469.
[11] Sozio MS,Liangpunsakul S,Crabb D.The role of lipid metabolism in the pathogenesis of alcoholic and nonalcoholic hepatic steatosis[J].Semin Liver Dis,2010,30(4):378-390.
[12] Postic C,Girard J.Contribution of de novo fatty acid synthesis to hepatic steatosis and insulin resistance:lessons from genetically engineered m ice[J].JClin Invest,2008,118(3):829-838.
[13] Tappy LLe KA,Metabolic effects of fructose and theworldw ide increase in obesity[J].Physiol Rev,2010,90(1):23-46.
[14]何卫美,宋育林,方芳,等.MEK/ERK通路在高脂饮食诱导NAFLD大鼠SREBP-I表达中的作用[J].胃肠病学和肝病学杂志,2010,19(5):427-431.
Study on the Effect and M echanism of Xuezhiping Capsu le on Blood Lipid Levels of H igh Blood Lipid M odel Golden Hamsters
SHEN Qiang1,ZHANG Haijing2,YANG M inghua1,SUN Xiaobo2,SUN Guibo2(1.Center of Research and Development on Life Sciences and Environmental Sciences,Harbin University of Commerce,Harbin 150076,China;2. China Institute of Medicinal Plant Development,Peking Union Medical College,Chinese Academy of Medical Sciences,Beijing 100193,China)
OBJECTIVE:To study the effect and its possible mechanism of Xuezhiping capsule on blood lipid levels of high blood lipid model golden hamsters.METHODS:Golden hamsterswere random ly divided into normal control group,model group,atorvastatin group(3 mg/kg),combination group(Xuezhiping capsule 1.3 g/kg+atorvastatin 1.5 mg/kg),Xuezhiping capsule lowdose,medium-dose,high-dose groups(Xuezhiping capsule 1.3,2.6,5.2 g/kg),10 in each group.Hamsters in normal control group
normal diet,the other groups were given high-fat diet to establish high blood lipid model.Then relevant drugs were intragastrically given 2 weeks later.Normal control group and model group were intragastrically given equal volume of distilled water,once a day,for 4 weeks.After last administration,blood lipid indexes(TG,TC,HDL-C,LDL-C,FFA),mRNA and protein expressions of lipid metabolism related genes(PPAR-α,CYP7A1,ACOX,SREBP-1c,ACC1)were detected.RESULTS:Compared w ith normal control group,serum contents of TC,TG,LDL-C,FFA in model group increased,HDL-C content decreased;PPAR-α,CYP7A1,ACOX mRNA and protein expressions were weakened,SREBP-1c,ACC1 mRNA and protein expressions were enhanced(P<0.05).Compared w ith model group,above-mentioned indexes were obviously improved in Xuezhiping capsule high-dose group,atorvastatin group and combination group(except for HDL-C in Xuezhiping capsule high-dose group)(P<0.05);TC,TG,FFA contents,and PPAR-α,CYP7A1,ACOX,ACC1 mRNA,and CYP7A1,SREBP-1c,ACC1 protein were obviously improved in Xuezhiping capsulemedium-dose group(P<0.05);TC,TG contents,and PPAR-αmRNA,and CYP7A1,SREBP-1c protein were obviously improved in Xuezhiping capsule low-dose group(P<0.05).CONCLUSIONS:Xuezhiping capsule has a prom ising effect of lowering blood lipid,the mechanism may be related to activating PPAR-αand inhibiting SREBP-lc signaling pathway.
Xuezhiping capsule;High blood lipid;Lowering blood lipid;Mechanism;Golden Hamster
R965
A
1001-0408(2017)16-2212-04
2016-09-20
2016-11-13)
*硕士研究生。研究方向:心血管药理。电话:010-51873226。E-mail:qshen666@126.com
#通信作者:研究员,博士生导师。研究方向:心血管药理。电话:010-51873013。E-mail:sunguibo@126.com
DOI10.6039/j.issn.1001-0408.2017.16.14
