以证据为基础的超药品说明书用药指导规范的制订
2017-07-03顾国煜陈耀龙翟晓梅张幸国赵青威羊红玉王融溶洪东升饶跃峰吴佳莹姜赛平俞慧群国家卫生计生委医疗管理服务指导中心北京1000浙江大学附属第一医院药学研究中心杭州1000兰州大学循证医学中心GRADE中国中心兰州70000中国药科大学国家药物政策与医药产业经济研究中心南京11198北京协和医学院人文和社会科学学院北京1000宁波市北仑区人民医院药剂科浙江宁波1800
赵 靖,顾国煜,陈耀龙,邵 蓉,翟晓梅,张幸国#,赵青威,羊红玉,王融溶,柳 琳,楼 燕,洪东升,饶跃峰,吴佳莹,李 菌,姜赛平,俞慧群,赵 昕,叶 云(1.国家卫生计生委医疗管理服务指导中心,北京 1000;.浙江大学附属第一医院药学研究中心,杭州 1000;.兰州大学循证医学中心/GRADE中国中心,兰州 70000;.中国药科大学国家药物政策与医药产业经济研究中心,南京 11198;.北京协和医学院人文和社会科学学院,北京 1000;.宁波市北仑区人民医院药剂科,浙江宁波 1800)
以证据为基础的超药品说明书用药指导规范的制订
赵 靖1*,顾国煜2,陈耀龙3,邵 蓉4,翟晓梅5,张幸国2#,赵青威2,羊红玉2,王融溶2,柳 琳2,楼 燕2,洪东升2,饶跃峰2,吴佳莹2,李 菌2,姜赛平2,俞慧群6,赵 昕6,叶 云6(1.国家卫生计生委医疗管理服务指导中心,北京 100044;2.浙江大学附属第一医院药学研究中心,杭州 310003;3.兰州大学循证医学中心/GRADE中国中心,兰州 730000;4.中国药科大学国家药物政策与医药产业经济研究中心,南京 211198;5.北京协和医学院人文和社会科学学院,北京 100032;6.宁波市北仑区人民医院药剂科,浙江宁波 315800)
目的:探讨如何应用循证医学方法学制订我国超药品说明书用药指导规范的方法和流程。方法:确定制订指导规范的7个步骤,即组建“规范”制订工作组;调查和遴选超药品说明书使用现状;确定临床问题;检索、评价和综合证据;应用GRADE进行证据质量分级;形成推荐意见并达成共识;同行评审和结果发布。据此步骤最终形成指导规范,并以风湿免疫学科为例进行示范研究。结果与结论:利用循证评价体系并依据7个步骤制订了一套综合行政、法律、临床医学、药学等多学科共同参与的风湿免疫学科超药品说明书用药相关指导规范的方法和流程。以证据为基础的超药品说明书用药指导规范的制订,充分体现了工作组的多学科性、流程的先进性、证据的全面性、分级的严谨性及共识的规范性,为进一步建立起一整套覆盖临床各专科病种超药品说明书用药的评价和管理体系提供了方法学借鉴,从而促进我国超药品说明书用药管理的规范化、法制化。
循证;超药品说明书用药;指导规范;制订
超药品说明书用药又称“药品说明书外用法”“药品未注册用法”,是指药品使用的适应证、剂量、疗程、途径或人群等未在药品监督管理部门批准的药品说明书记载范围内的用法。目前,超药品说明书用药在全球普遍存在。有研究显示,在常用药品处方中,约有21%属于超说明书用药,其中仅27%有循证医学证据支持其用药的有效性和安全性[1]。而未基于循证医学证据的超药品说明书用药方案可能存在严重的用药隐患。2005年4月至2008年10月1日,美国FDA共收到38例使用硫酸奎尼丁引起严重不良事件(永久性肾损害、血小板减少性紫癜、溶血性尿毒症综合征、血栓性血小板减少性紫癜等,其中2例死亡)的报告,其中仅有1例为适应证用药,37例为超药品说明书用药[2]。在现阶段,基于新药评审和药品说明书审批相关法律法规要求,使得药品说明书的信息更新往往滞后于临床实践,而临床疾病防治又是一个实践的过程,临床研究日新月异,因此,超药品说明书用药现象具有一定的合理性和不可避免性,尤其是对于某些特殊人群及难治性疾病。因此,对超药品说明书用药只能加强管理而不能禁止[3]。
然而,目前国内外对上市后超药品说明书的使用尚未建立公认的评价体系和管理规范,世界各国对超药品说明书用药的管理程度各有不同,没有统一的准则。同时,超药品说明书用药存在巨大的法律风险。目前,全球有与药品超说明书使用相关立法的国家共7个,分别是美国、德国、意大利、荷兰、新西兰、印度和日本。除印度禁止超说明书用药外,其余6国均允许合理的超说明书用药。另外,仅英国和爱尔兰明确规定了超说明书处方权[4]。而国内现行规章对药品说明书的法律定性较模糊,法律界和医疗界对超药品说明书用药法律地位的认识存在一定分歧,这也给医务人员带来了重大的风险隐患[5-6]。因此,超药品说明书用药指导规范的制订对于完善我国超药品说明书用药领域的立法显得刻不容缓。
循证医学的出现及其方法学的发展,为解决该问题提供了重要的思路与途径[7]。由于超药品说明书用药的临床决策还涉及伦理、经济、法律等多方面因素[8-10],因此,科学、规范、客观的超药品说明书用药评价体系和指导规范,需要多学科协作共同构建,从而为临床超药品说明书用药提供有效、可信的证据,促进我国超药品说明书用药管理的规范化、法制化。有鉴于此,从2013年初开始,由国家卫生和计划生育委员会(以下简称卫生计生委)委托中华医学会,并由浙江大学医学院附属第一医院牵头具体落实这项工作,旨在确定我国超药品说明书用药管理共识,建立一套基于循证、融合多领域专家共识的超药品说明书用药行业(推荐)标准,即“超药品说明书用药规范”;同时,形成我国超药品说明书用药推荐意见及评价体系,以此推动我国超药品说明书用药的规范化进程。笔者在本文中仅以风湿免疫学科超药品说明书用药为例,探讨如何应用循证医学制订相关指导规范的方法和流程。
1 制订方法与过程
超药品说明书用药指导规范的整体设计参考《世界卫生组织指南制定手册》[11],同时,结合超药品说明书用药评价的工作特性进行补充完善。该规范的制订流程分为7个步骤:(1)组建“规范”制订工作组;(2)调查和遴选超药品说明书使用现状;(3)确定临床问题[解构为PICO(患者:Patients,干预措施:Interventions,对照措施:Comparison,结局指标:Outcomes)格式];(4)检索、评价和综合证据;(5)应用GRADE(卫生系统中证据推荐分级的评估、制订与评价,The grading of recommendations assessment,developmentand evaluation)进行证据质量分级;(6)形成推荐意见并达成共识;(7)同行评审和结果发布。
1.1 组建“规范”制订工作组
项目组确认首批开展3个学科(风湿免疫学科、肿瘤学科和儿科)的工作,并建立多学科工作组。本研究以风湿免疫学科的3个病种(系统性红斑狼疮、类风湿关节炎、皮肌炎/多发性皮炎)为例进行阐述。风湿免疫学科超药品说明书用药管理规范制订工作组专家成员涵盖了风湿免疫学、临床药学、流行病学、循证医学、伦理学和法律方面的专家并成立由循证医学和文献检索专家组成的证据评价工作组。
1.2 调查和遴选超药品说明书使用现状
在风湿免疫领域开展超药品说明书用药情况的调研,调研范围包括药品名称、用法用量、主要治疗用途和临床用药依据。
1.3 确定临床问题,解构为PICO格式
根据上述筛选出来的超药品说明书用药的情况,经规范制订工作组和证据评价工作组讨论,按照系统评价的原则,解构为患者、干预措施、对照措施、结局指标。PICO解构问题举例见图1。

图1 PICO解构问题举例Fig 1 The exam p le of deconstructing prob lem w ith PICO
1.4 检索、评价和综合证据
通过检索临床实践指南相关数据库如NGC、NICE、SIGN、Medline、Embase数据库获取相关指南,明确指南中是否已有相关用药方案的推荐意见,并应用软件AGREEⅡ工具[12-13]对纳入指南的方法学质量进行评估和应用GRADE系统[14-15]对证据质量进行评价。通过检索Medline、Embase、Cochrane图书馆确定是否已有相关系统评价。对于已经存在的系统评价,需评估是否符合要求,评估流程见图2。

图2 评估系统评价证据的流程Fig 2 The procedure of evaluating the system atic review
如果纳入的证据和系统评价均不符合要求,则根据其质量考虑更新或重新制作系统评价。如果需要制作新的系统评价,则检索Medline、Embase、Cochrane图书馆等基本数据库。建议系统评价小组遵循Cochrane手册[16]中的相应标准执行并参考PRISMA[17]进行报告,具体案例见图3。

图3 系统评价制作过程举例Fig 3 Theexam pleofmaking systematic review
1.5 应用GRADE进行证据质量分级
根据GRADE将证据质量分为高、中、低、极低4个等级(证据质量等级定义——高质量:非常确信预测值接近真实值;中等质量:对预测值有中等把握,预测值有可能接近真实值,但也有可能差别很大;低质量:对预测值把握有限,预测值可能与真实值有很大差别;极低质量:对预测值几乎没有把握,预测值和真实值极有可能存在很大差别),并形成推荐意见。证据质量分级结果举例见表1。
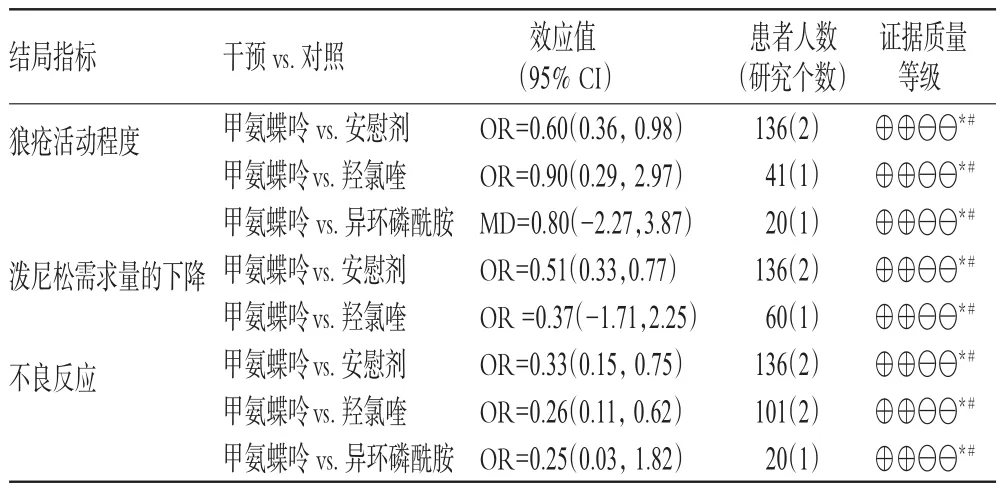
表1 证据质量分级结果举例Tab 1 Theexam p le for resultof evidencequality grading
注:“*”,针对患者和实施者的盲法未实施,随机方法不明确;“#”,样本量不足,可信区间较宽;CI,可信区间;OR,比值比;MD,均数;“⊕⊕——”,低
Note:“*”,the blind method is not implemented that pointed to the patient and the implementor,the random method is not clear;“#”,the sample size is insufficient,the confidence interval is w ide;CI,confidence interval;OR,odds ratio;MD,mean;“⊕⊕——”,low
1.6 形成推荐意见并达成共识
根据前期工作结果,项目组以举办超药品说明书用药管理项目推荐意见共识会议的形式进行推荐意见的制定。共识专家小组基于GRADE对证据质量进行评价,利用改良的德尔菲法,通过前后三轮投票表决,就推荐意见达成相应的共识并以GRID网格法规范。系统性红斑狼疮推荐意见共识举例见表2。

表2 系统性红斑狼疮推荐意见共识举例Tab 2 The exam p le for recomm endations consensus of system ic lupuserythem atosus
1.7 同行评审和结果发布
将形成的超药品说明书用药专家推荐意见试行稿交由中华医学会风湿免疫同行专家,对推荐意见进行审定,对存在的重要问题进行修订和完善后,最终形成指导规范,进行发布。
2 循证制订超药品说明书用药管理规范的意义
本例超药品说明书用药指导规范的制订由国家卫生计生委和中华医学会共同主导,过程不仅由一线临床医学、药学学科等医药专业学科介入,更有法律、伦理等学科的深度参与,同时还有行政管理层面的监督,充分保证了该指导规范专家小组的多学科性、流程的先进性(WHO标准)、证据的全面性(均基于系统评价)、分级的严谨性(GRADE分级)及共识的规范性(GRID网格法),为管理该规范下一步在临床的实施提供了保障,同时也为下一步其他临床专科超药品说明书用药管理规范的制订奠定了理论和实践基础,由此可进一步建立起一整套覆盖临床各个专科病种超药品说明书用药的循证评价体系和管理体系,在充分考虑法律和伦理因素的情况下,持续推进我国超药品说明书合理用药工作,切实保障医药护患多方的合法权益。
此外,以本规范为基础制订的超药品说明书用药管理标准不仅可用于指导和管理医疗机构超药品说明书的临床用药,也有望为相关医疗过失的法律责任界定提供参考,同时可为卫生行政部门对药品的使用监管以及药品再注册提供依据。
[1] 张幸国.我国超药品说明书用药临床管理现状分析[J].中华医学信息导报,2015,30(10):16.
[2] 赵常军,贾东岗,雷招宝.“超说明书用药”的现状、危害性及对策[J].医学理论与实践,2012,25(8):984-986.
[3] 黄亮,申向黎,陈力,等.正确认识并有效规范超说明书用药行为[J].中国医院药学杂志,2009,29(11):949-951.
[4] 张伶俐,李幼平,曾力楠,等.15国超说明书用药政策的循证评价[J].中国循证医学杂志,2012,12(4):426-435.
[5] 张波,郑志华,李大魁.超药品说明书用药参考[M].北京:人民卫生出版社,2013:1-459.
[6] 赵志刚,费宇彤.药品超说明书使用循证评价[M].北京:中国协和医科大学出版社,2015:1-562.
[7] Djulbegovic B,GuyattGH.Progress in evidence-based medicine:a quarter century on[J].Lancet,2017,doi:10.1016/S0140-6736(16)31592-6.
[8] 黄瑾.超说明书用药的伦理研究[J].中国医学伦理学,2011,24(1):6-8.
[9] 唐蕾,韦炳华,何秋毅,等.超说明书用药的现状及其法律风险[J].中国药房,2014,25(45):4225-4228.
[10] 邢沫,郑秋实,张良辉,等.超说明书用药法律评价标准探讨[J].中国医院管理,2015,35(3):47-48.
[11] 世界卫生组织.世界卫生组织指南制定手册[M].杨克虎,译.兰州:兰州大学出版社,2013:9-74.
[12]BrouwersM,Kho ME,Browman GP,etal.AGREEⅡ:advancing guideline development,reporting and evaluation in healthcare[J].J Clin Epidemol,2010,63(12):1308-1311.
[13] 韦当,王聪尧,肖晓娟,等.指南研究与评价(AGREEⅡ)工具实例解读[J].中国循证儿科杂志,2013,8(4):316-319.
[14] Atkins D,BestD,Briss PA,etal.Grading quality of evidence and strength of recommendations[J].BMJ,2004,328(7454):1490.
[15] Guyatt GH,Oxman AD,Kunz R,et al.What is“quality of evidence”and why is it important to clinicians?[J]. BMJ,2008,336(7651):995-998.
[16] Higgins JPT,Green S.Cochrane handbook for systematic reviews of interventions version5.1.0[S].Birmingham,UK:The Cochrane Collaboration,2011.
[17] Moher D,Liberati A,Tetzlaff J,et al.Preferred reporting items for systematic reviews and meta-analyses:the PRISMA Statement[J].Open Med,2009,3(3):e123-e130.
(编辑:刘 萍)
Guideline Formulation of the Off-label Use of Drugs Based on Evidences
ZHAO Jing1,GU Guoyu2,CHEN Yaolong3,SHAO Rong4,ZHAIXiaomei5,ZHANG Xingguo2,ZHAO Qingwei2,YANG Hongyu2,WANG Rongrong2,LIU Lin2,LOU Yan2,HONG Dongsheng2,RAO Yuefeng2,WU Jiaying2,LI Jun2,JIANG Saiping2,YU Huiqun6,ZHAO Xin6,YE Yun6(1.The Medical Management Center of National Health and Family Planning Comm ission of People’s Public of China,Beijing 100044,China;2.Dept.of Pharmacy,the First Affiliated Hospital of Zhejiang University,Hangzhou 310003,China;3.Evidence-Based Medicine Center/ Chinese GRADE Center of Lanzhou University,Lanzhou 730000,China;4.The Research Center of National Drug Policy&Ecosystem of CPU,Nanjing 211198,China;5.The Humanities and Social Science Institute of Peking Union Medical College Hospital,Beijing 100032,China;6.Dept.of Pharmacy,Ningbo Beilun People’s Hospital,Zhejiang Ningbo 315800,China)
OBJECTIVE:To explore an effectivemethod to formulatemanagement-related strategies for off-lable use of drugs by the evidence-based medicine.METHODS:The process of guideline formulation included seven procedures,i.g.establishment of“guidelies”formulation workgroup;investigation and selection of the status quo on off-label drug use;identification of the clinical problems;retrieval and evaluation and comprehensing of evidence;applification of GRADE in evidence quality grading;formation of the recommendations consensus;peer review and result publication.And eventually guidelines were formed based on the steps. This study took off-label use of rheumatoid immunoprotective subjects as a case to explore.RESULTS&CONCLUSIONS:Based on the evidence evaluation system and above 7 steps,themethods and process of guideline formulation on off-label use of rheumatoid immunoprotective subjects that integrated adm inistration,law,clinicalmedicine,pharmacy subjects were made.The process of guideline formulation fully reflects multidisciplinary characteristics of the workgroup,the advanced nature of the process,the comprehensiveness of evidence,the rigor of evidence quality grading,and the normalization of consensus.It provides reference in methodology for establishing a comprehensive evidence-based evaluation and management system of off-label use of drugs for all clinical specialist disease.Therefore,this scientific research resultsmay promote the standardization and legalization of the off-label use of drugsmanagement in China.
Evidence-based;Off-label drug use;Guidelines;Formulation
R95
A
1001-0408(2017)16-2167-04 DOI 10.6039/j.issn.1001-0408.2017.16.02
2017-05-02
2017-05-16)
*讲师。研究方向:医院管理。电话:010-68792826。E-mail:731855182@qq.com
#通信作者:主任药师,博士生导师,博士。研究方向:临床药学。电话:0574-86786003。E-mail:xgzhang666@163.com
*副主任药师,硕士。研究方向:医院药事管理、药学服务。电话:0516-85537717。E-mail:wastlx@163.com
#通信作者:主任药师,教授。研究方向:医院药事管理、药学服务。电话:0516-85537717。E-mail:3134535564@qq.com
