LAIR—1与TGF—β在口腔扁平苔藓患者外周血中表达的相关性研究
2017-07-01葛志强梁歌之廖程
葛志强+梁歌之+廖程
【摘要】 目的:观察LAIR-1与TGF-β在口腔扁平苔藓(OLP)患者外周血中的表达情况,并探讨其是否存在相关性。方法:选取笔者所在医院2010年1月-2015年1月收治的80例OLP患者为甲组,同期选取40例健康体检者为乙组,均采用流式细胞术检测LAIR-1在OLP患者与健康体检者外周血Treg上的表达水平,并选用ELISA检测两组外周血中TGF-β水平。结果:甲组患者外周血CD4+Foxp3+Treg细胞中LAIR-1阳性表达率与TGF-β表达水平均要显著高于乙组(P<0.05),且两者呈现出正相关性(r=0.43,P<0.05)。结论:在OLP患者外周血中,其LAIR-1与TGF-β表达水平均高于健康者,故认为OLP发病可能同LAIR-1与TGF-β有关。
【关键词】 口腔; 扁平苔藓患者; 外周血表达; 相关性
doi:10.14033/j.cnki.cfmr.2017.17.009 文献标识码 B 文章编号 1674-6805(2017)17-0020-03
LAIR-1 Correlation with TGF-β Expression in the Peripheral Blood of Patients with Oral Lichen Planus/GE Zhi-qiang,LIANG Ge-zhi,LIAO Cheng.//Chinese and Foreign Medical Research,2017,15(17):20-22
【Abstract】 Objective:To observe the expression of LAIR-1 and TGF-β in peripheral blood of patients with oral lichen planus(OLP),and to explore whether there is correlation.Method:From January 2010 to January 2015,80 OLP patients admitted in our hospital were selected as group A,and 40 healthy subjects were selected as group B.Flow cytometry was used to detect LAIR-1 in OLP patients and healthy subjects of Treg in peripheral blood,the levels of TGF-β in peripheral blood were measured by ELISA.Result:The positive expression rate of LAIR-1 and the expression of TGF-β in CD4+Foxp3+Treg cells of group A patients were significantly higher than those in group B(P<0.05),and there was a positive correlation between them(r=0.43,P<0.05).Conclusion:The expression of LAIR-1 and TGF-β in OLP patients is higher than that in healthy patients.Therefore,the incidence of OLP may be related to LAIR-1 and TGF-β.
【Key words】 Oral; Lichen planus; Peripheral blood expression; Correlation
First-authors address:Yulin Traditional Chinese Medicine Hospital,Yulin 537000,China
在临床上,OLP病症属于口腔黏膜一种多见病症,发病原因可能同机体免疫能力、精神、感染情况与内分泌情况等有关,而对于该病症的具体病理机制,就成为了临床相关研究的重点所在,而且有大量研究發现,它是自身免疫性病症的一种,多因患者本身对自体形成的抗原发生了免疫反应,进而诱发自体组织损伤而诱发的,并有着反复发作与慢性迁延的特点。本研究观察LAIR-1与TGF-β在OLP患者外周血中的表达情况,文章抽选笔者所在医院收治的80例OLP患者作为观察对象,现报告如下。
1 资料与方法
1.1 一般资料
选取笔者所在医院于2010年1月-2015年1月收治的80例OLP患者作为甲组,所有患者均为初诊,男30例,女50例,年龄27~65岁,平均(36±4)岁,且甲组均为OLP初诊患者,并满足以下标准:均经临床表现和组织病理学检查被确诊,即均为非溃烂期OLP患者,病程超过1年,就诊前至少2个月未接受任何治疗,如应用激素等免疫抑制剂,未合并全身性疾病,如消化系统疾病、糖尿病等,并排除同时合并盘状红斑狼疮或是白斑等其他类型的口腔黏膜疾病;同期选取40例健康体检者作为乙组,男15例,女25例,年龄28~64岁,平均(35±5)岁,均自愿参与本次研究。两组患者一般资料比较差异无统计学意义(P>0.05),有可比性。
1.2 方法
1.2.1 主要试剂与仪器 FITC、PE-CY5与PE标记的小鼠抗人Foxp3、CD4与LAIR-1单克隆抗体(mAb)及同型对照抗体(由美国BD Pharmingen公司提供),破膜试剂盒(由美国eBioscience公司提供),Ficoll人淋巴细胞分离液(由天津灏洋生物制品科技有限公司提供),HumanTGF-β预包被ELISA试剂盒(由深圳达科为生物技术有限公司提供),流式细胞仪(由美国Beckman公司提供),全自动酶标仪(由美国Multiskan MS提供)[1]。
1.2.2 流式细胞术检测法 利用该检测法检测LAIR-1在CD4+Foxp3+Treg上的表达情况,即有效采集两组人员的新鲜外周血进行肝素抗凝,后用PBSA(含有0.6%抗凝剂的ACD-A的PBS)以1∶1的比例对采集到的外周血进行稀释处理,并用Ficoll密度梯度法来分离出采集外周血的单个核细胞;进行细胞计数,并将其细胞密度调整到1.2×106细胞/ml,同时灭活血清,封闭FcR,而后分别应用PE-CY5-CD4与PE-LAIR-1mAb与同型对照抗体实施表面荧光染色处理,并于室温下避光孵育约20 min[2];将PBS洗涤之后,对细胞进行固定破膜,同时选用FITC-Foxp3 mAb与同型对照抗体实施膜内染色处理,同样于室温下避光约孵育30 min,最后在洗涤破膜缓冲液之后,加入500 μl固定液,并借助上流式细胞仪实施相应检测[3]。
1.2.3 ELISA检测法 采用ELISA檢测法对采集外周血中TGF-β水平进行检测,即借助EDTA抗凝采血管采取两组人员的1 ml外周血,对其进行离心处理,后取其血浆放于-70 ℃的温度下进行保温处理,然而参照HumanTGF-β预包被ELISA试剂盒的说明书所说进行操作,借助ELISA双抗体夹心法来对细胞因子TGF-β表达水平进行有效检测,并采用全自动酶标仪450 nm处检测其A值[4]。
1.3 结果判定
LAIR-1与TGF-β均以细胞浆内不同程度棕黄色颗粒的出现情况来判定其阳性反应,并参照Bresalier半定量公式对其染色结果进行有效判定,具体为:随机抽选5个典型高倍镜视野(×400),确保每视野内随机拥有100个细胞,细胞计数为500个,其中,阴性“-”(0分),代表无显著阳性细胞,弱阳性“+”(1分),代表阳性细胞计数少于5%,中度阳性“++”(2分),代表阳性细胞计数在6%~25%,强阳性“+++”(3分),代表阳性细胞计数在26%~50%,极强阳性“++++”(4分),代表阳性细胞计数大于50%[7-8]。
1.4 统计学处理
选用统计学软件SPSS 18.0对本次数据加以处理,计量资料以(x±s)表示,采用t检验,计数资料以率(%)表示,采用字2检验,P<0.05为差异有统计学意义。
2 结果
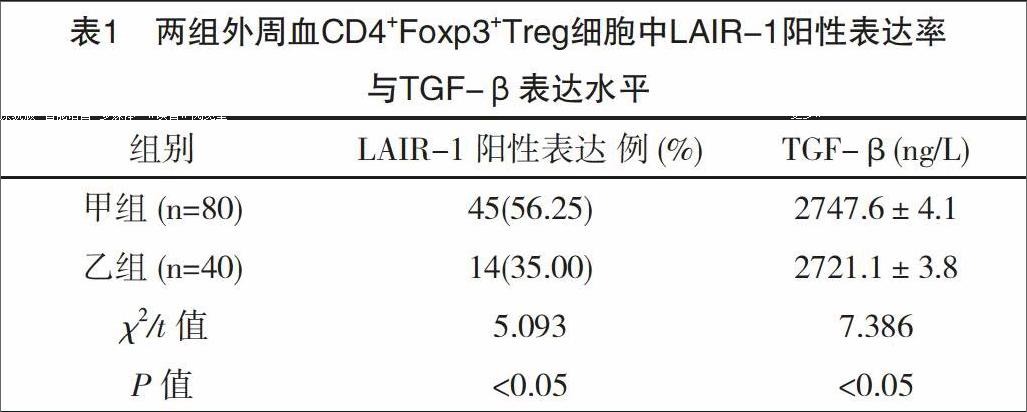
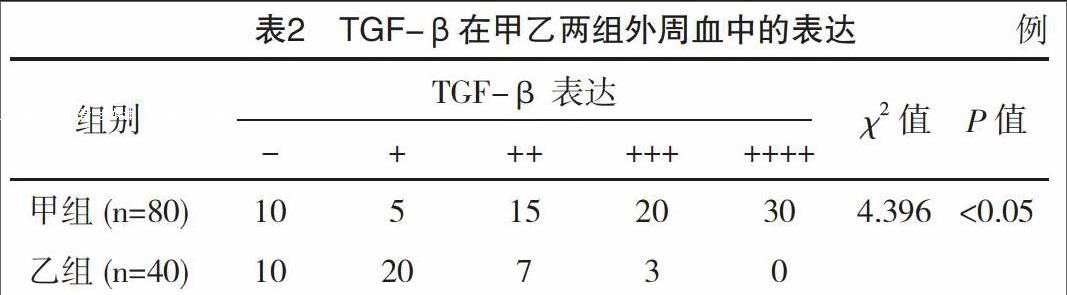
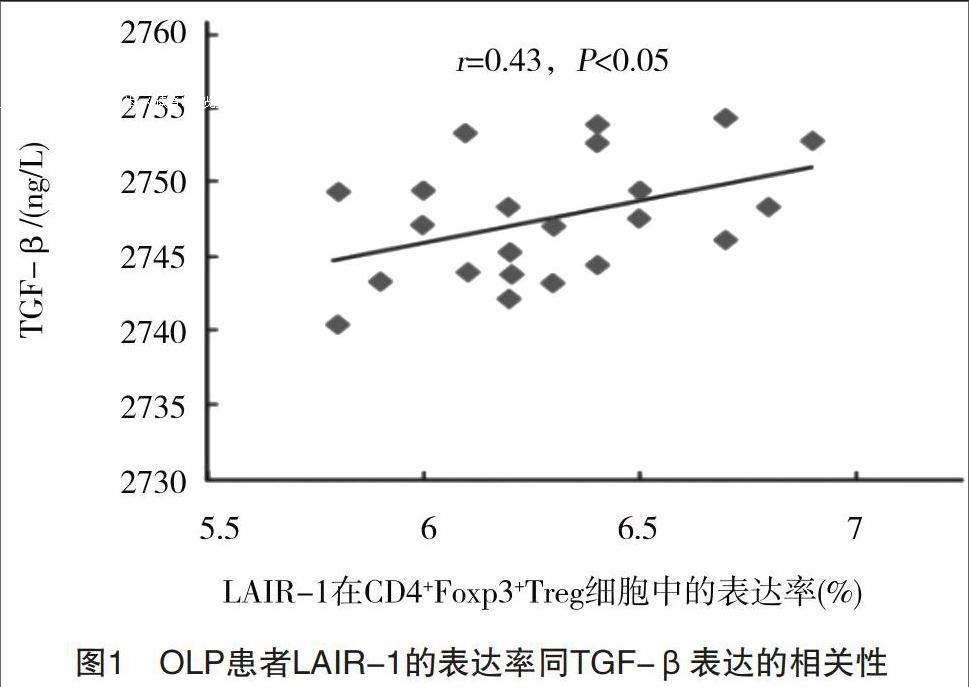
通过分析流式细胞术检测发现,甲组患者外周血中CD4+Foxp3+Treg细胞中LAIR-1阳性表达率要显著高于乙组,差异有统计学意义(P<0.05);而从ELISA检测结果发现,甲组患者外周血中TGF-β表达水平也要显著高于乙组,差异有统计学意义(P<0.05),见表1、表2。同时,经分析发现,对于OLP患者,其外周血中LAIR-1在CD4+Foxp3+Treg细胞中的表达率同TGF-β表达呈现出正相关的关系(r=0.43,P<0.05),见图1。
3 讨论
LAIR-1作为一种免疫抑制性的受体,于“第8届国际人白细胞分化抗原讨论会”上获得了“CD305”的编号,并发现LAIR-1分子可能在免疫应答过程中参与比较广泛[5]。Treg作为一类有着较好免疫抑制作用的T细胞,在维持自身耐受性中作用重大,而CD4+Foxp3+Treg则被公认为是调节性T细胞中一个最重要的表型特征,有大量研究发现,在众多自身免疫性病症中,如青少年原发性关节炎、系统性红斑狼疮与自身免疫性肝炎中等,患者外周血中Treg细胞水平均呈现出一个下降趋势,而这也说明,患有自身免疫性病症的患者,其免疫抑制多表现不足。而OLP同样作为一种自身免疫性病症,据相关学者研究表示,OLP患者外周血中的CD4+Foxp3+Treg细胞水平要显著高于健康组,而这也就表示,OLP患者的免疫抑制能力虽看起有所强化,但这可能仅仅只是机体出现的一种免疫调节机制[6]。在患有自身免疫性病症患者体内,其效应性T细胞对Treg所具有的敏感性会有所下降,从而使得Treg细胞无法全面发挥它的抑制作用,进而出现了T细胞抵抗情况,而这也就较好的解释“为什么OLP患者外周血中的Treg水平会有所升高”这个问题[7]。同样的,本次研究结果也证实,OLP患者中外周血中,其异质性的受体LAIR-1在CD4+Foxp3+Treg细胞上的表达水平,要显著高于健康体检者,而这也就表示,LAIR-1极有可能是Treg细胞发挥出其免疫抑制功能的一个重要介质,且LAIR-1也可能是借助影响OLP患者的Treg细胞功而参与到OLP发病当中的[8]。
TGF-β作为一种有着多种生物学活性功能的细胞因子,日渐引起研究者的重视,且其生物学功能也比较广泛,在细胞分化增殖、创伤组织修复与胚胎发育以及炎症产生等方面均有涉及,更为重要的是,TGF-β还有着有效抑制免疫功能的作用[9-10]。而为研究其在OLP发病发展中所其的作用,有学者就是借助ELISA法对网状型或糜烂性OLP患者中TGF-β1、Cyclin D1与Smad4的表达情况进行了研究,结果显示,OLP患者TGF-β1表达水平要显著高于正常黏膜组织表达[11]。而本研究得出,同乙组健康人员相比,甲组OLP患者外周血中的TGF-β水平,有明显升高趋势,而这也就说明了Treg细胞极有可能是借助刺激TGF-β的大量分泌来起到抑制患者免疫功能作用的[12]。另外,本研究结果还显示,OLP患者外周血中LAIR-1在CD4+Foxp3+Treg细胞中的表达率同TGF-β表达水平,有着正相关性,也就是说,LAIR-1与TGF-β均可能参与到了OLP发生过程中。
参考文献
[1]严昌建.糜烂性口腔扁平苔藓给予糖皮质激素冲击疗法的综合效果评析[J].中外医学研究,2016,14(17):23-24.
[2]张立荟,李言君,于平,等.LAIR-1与 TGF-β在口腔扁平苔藓患者外周血中表达的相关性研究[J].实用口腔医学杂志,2014,30(6):760-763.
[3]宫尚红,王婧姣,漆明,等.IL-17、IL-23在口腔扁平苔藓患者外周血中的表达及相关性[J].实用口腔医学杂志,2014,30(1):78-81.
[4]王冬平,姜旺展,蔡扬,等.口腔扁平苔藓患者免疫功能状况与临床特征相关性分析[J].实用口腔医学杂志,2014,30(5):680-683.
[5]徐晓满,詹渊博,穆森,等.牙周基础治疗对口腔扁平苔藓患者外周血TNF-α及IL-6水平的影响[J].口腔医学研究,2014,30(9):854-857.
[6]韩佳桐,翟爱荣,漆明.TL1A和IDO在口腔扁平苔藓患者外周血中的表达研究[J].口腔医学,2015,35(4):278-281.
[7]姜梦雨,姚辉,杜芳,等.口腔扁平苔藓患者外周血相关炎症因子表达分析[J].临床口腔医学杂志,2013,29(4):204-206.
[8]江华珍.糜烂型口腔扁平苔藓患者予他克莫司治疗分析研究[J].中外医学研究,2013,11(9):23-24.
[9]王一敏,周军,傅升,等.Th1型和Th2型细胞因子在口腔扁平苔藓患者外周血中的表达及临床意义[J].现代生物医学进展,2014,14(35):6877-6879.
[10]邓志华.糜烂性口腔扁平苔癣实施糖皮质激素冲击疗法的疗效评价[J].当代医学,2014,21(28):20-21.
[11]陈冶.白细胞相关免疫球蛋白样受体-2和转化生长因子-β在口腔扁平苔藓患者外周血表达及意义[J].口腔医学研究,2016,32(5):513-516.
[12]张弘,张英.口腔扁平苔藓组织中STATs家族表达与外周血PD-1、PD-L1表达及免疫功能的相关性[J].海南医学院学报,2016,22(24):3101-3104.
