宫颈微偏腺癌伴双卵巢粘液性肿瘤2例报告
2017-07-01崔雨萌
崔雨萌,石 红
(1.大连医科大学附属大连市妇产医院 大连市妇幼保健院 妇产科,辽宁 大连 116011;2.大连医科大学附属第一医院 妇产科,辽宁 大连 116011)
病例报告
宫颈微偏腺癌伴双卵巢粘液性肿瘤2例报告
崔雨萌1,2,石 红2
(1.大连医科大学附属大连市妇产医院 大连市妇幼保健院 妇产科,辽宁 大连 116011;2.大连医科大学附属第一医院 妇产科,辽宁 大连 116011)
宫颈微偏腺癌;卵巢肿瘤;诊断
1 临床资料
病例1:患者,49岁,以“间断下腹痛5个月,发现盆腔包块4天伴腹痛加重1天”为主诉于2014年12月15日急诊入大连医科大学附属第一医院。患者5个月前无明显诱因出现下腹部针扎样疼痛,无放散痛,进行性加重,以右下腹为重,夜间明显,加重时自服止痛药对症处置,未就医;4天前于本院门诊就诊,行超声检查示盆腔右侧液性占位(203 mm×187 mm×120 mm),囊壁薄,见分隔,周边见血流;1天前患者腹痛加重,伴腹胀,少量阴道流血,色鲜红,无血块,量少于月经量,伴轻度呼吸困难,遂于本院急诊以“盆腔包块性质待查”收入院。
患者入院后行妇科检查示外阴、阴道发育正常,已婚已产式;阴道通畅,黏膜光滑,无充血,少量血性阴道分泌物;宫颈质硬呈桶状,宫颈柱状上皮外移Ⅱ度,触之少量出血;子宫后位,宫体触诊不清,右侧附件区压痛明显、无反跳痛及肌紧张。三合诊示主韧带略缩短,尚软,盆底未及异常结节。肿瘤标记物检测:CEA 9.75 ng/mL,AFP 1.64 IU/mL,CA125 987.7 U/mL,CA19-9 >1000 U/mL,NSE 8.14 ng/mL;复查盆腔超声示:子宫前位,大小为60 mm×63 mm×68 mm,轮廓清,形态欠规则,肌壁回声不均匀,见强光点反射,栅栏样,后壁明显;子宫内膜单层厚2 mm,宫腔线分离2 mm;于子宫前方见巨大液暗区,上缘达脐剑之间,左侧至腋后线,右侧至腋前线,下缘达耻上三横指,包膜较厚,见分隔,隔上见血运,RI 0.30;盆腔积液:前穹窿58 mm,后穹窿14 mm,透光度较差;超声提示:盆腹腔液性占位(卵巢肿瘤可能)子宫腺肌症盆腔积液宫腔积液。行腹部超声提示:左肾积水伴左输尿管上段扩张,CDFI未见异常血流,考虑为肿瘤压迫所致。行盆腔MRI示:盆腔内可见巨大类圆形病灶,T1W1低信号,T2W1呈明亮高信号,其内信号尚均匀,其内可见分隔,较大囊径约5.59 cm,部分囊内可见子囊,Gd-DTPA增强扫描后包膜及其内分隔有强化,边界尚光滑,与右卵巢分界欠清楚,子宫大小及形态未及异常,子宫后壁可见类圆形异常信号影,T1W1低、T2W1高信号影,增强未见异常强化,子宫底部另见类圆形异常信号,等T1W1、等T2W1信号,增强可见轻度强化,T2W1可见子宫体联合带弥漫性增厚,厚径约3.06 cm,子宫内膜显示欠清,宫颈内可见环壁增厚异常信号影,T2W1呈稍高信号,T1W1呈等低信号,增强可见轻度强化,结合带显示不清,盆腔内可见大片状积液影。影像诊断及建议:子宫内膜不规整,请结合临床;子宫后壁囊肿,子宫底肌瘤;盆腔内巨大囊性灶,考虑卵巢来源囊腺癌可能;盆腔积液。为除外消化系统病变行胃镜提示:慢性非萎缩性胃炎,球溃疡。行肠镜检查提示:结肠多发息肉。宫颈液基薄层细胞学检查,结果提示:无上皮内病变或恶性病变(NILM)。
患者入院时离子紊乱(低钾),入院后给予补钾、补液等支持治疗后身体状况好转,于2014年12月24日以“盆腔巨大肿物恶性不除外”为手术指征行“全子宫+双附件+大网膜+盆腔淋巴结+阑尾切除术”,术中探查见腹腔内有淡黄色粘稠腹水,子宫如孕2个月大小,双卵巢实性肿物,左侧约25 cm×15 cm×12 cm,右侧约为15 cm×15 cm×10 cm。左侧肿瘤与乙状结肠系膜部分致密粘连,直肠子宫陷窝腹膜毛糙充血水肿,腹腔脏器、腹腔腹膜、乙状结肠、直肠表面未见转移结节。标本大体观:左卵巢囊肿:多房性肿物,大小24 cm×16 cm,囊壁厚0.2 cm,灰白色,外壁光滑,内壁散在多个灰白色赘生物,质脆,囊壁外附输卵管,长6 cm,直径0.3 cm,伞端不明显;右卵巢囊肿:大小为12 cm×11 cm,内容物已流失,内壁不光滑,可见散在多个灰白色赘生物,囊壁外附输卵管,长6 cm,直径0.3 cm,伞端开放;全子宫:大小为11 cm×10 cm×5 cm,内膜厚0.1 cm,光滑,肌壁厚2.3~3.5 cm,宫颈光滑。术中冰冻病理回报:卵巢肿物部分取材均示双卵巢交界性粘液性囊腺瘤;宫颈见粘液性腺癌,侵及>1/2全层。加行大网膜、盆腔淋巴结、阑尾切除术。术后病理回报:左右卵巢粘液性囊腺癌(高分化),大小分别为24 cm×16 cm,12 cm×11 cm;宫颈微偏腺癌,侵及>1/2全层,累及子宫内膜及子宫壁达宫底部,未见明确脉管神经侵犯;左右输卵管未见癌累及;送检阑尾及大网膜未见确切癌转移;左闭孔淋巴结转移(1/4),盆腔各组淋巴结均未见癌转移,左右卵巢血管未见癌栓,切片结果见图1。术后诊断为宫颈微偏腺癌Ib1期,双卵巢粘液性囊腺癌IIb期。建议患者术后辅助放化疗治疗,但患者由于经济因素未行放化疗,随诊并于术后半年复查CT未见复发迹象。

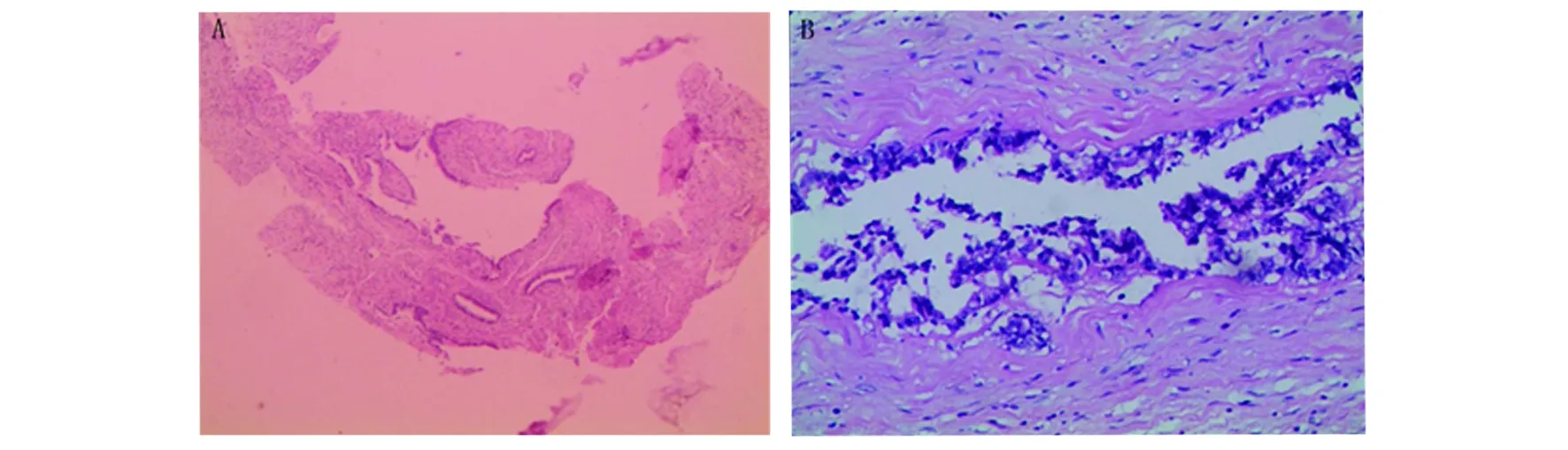
A、C、D:宫颈微偏腺癌。镜下所见:异型细胞排列呈极不规则的腺管状,细胞有粘液分泌,细胞核略增大,大小较一致,明显浸润性生长,D图中箭头所指处可见微浸润。A(HE ×200)、C(HE ×400)、D(HE ×400)。B:卵巢粘液性囊腺癌。 镜下所见:肿瘤为囊性,囊壁上皮为粘液性柱状上皮,核位于基底部,部分上皮核增大深染,胞浆嗜酸,可见细胞簇及复杂乳头状结构(HE ×100)图1 病例1患者术后病理切片结果Fig 1 Results of case 1 patient postoperative pathological sections
病例2:患者38岁,以“盆腔包块伴下腹痛3个月”为主诉于2013年9月18日就诊,患者3个月前无明显诱因出现右下腹绞痛,可自行扪及一鸡蛋大小包块,未在意,未诊治;1个月前患者腹痛加重,于当地诊所抗炎治疗无效,遂就诊于大连医科大学附属第一医院,于门诊行妇科检查示阴道前壁质硬增厚,子宫右上方可及囊性肿物,大小约7~8 cm,余正常;行超声检查示:内膜单层厚2 mm,宫腔内见液暗区,大小39 mm×40 mm×30 mm,右侧见液暗区71 mm×64 mm×54 mm,超声提示宫腔积液右卵巢囊肿;行宫颈病理活检示:慢性子宫颈炎伴HPV感染组织学像;血清肿瘤标志物检查:CA125 148.5 U/mL、CA19-9>1000 U/mL、SCC1.26 mg/mL,遂以“盆腔包块性质待查”收治本院。
入院后追问病史:患者半年前体检时宫颈柱状上皮外移II度,质硬,接触性出血(+),宫颈增大,行TCT、HPV均为阴性。于门诊2次行阴道镜下宫颈活检示宫颈呈慢性炎症改变。查体:外阴阴道正常、通畅,阴道前壁上1/2广泛质硬增厚,宫颈偏向右上方,暴露困难,触诊宫颈质硬,穹窿变硬,子宫前位,正常大小,三合诊右侧主骶韧带明显变厚增粗,实性肿物起自宫颈向上生长,未达盆壁,肿物直径约10 cm。复查肿瘤标记物:CA125 167.6 U/mL、CA19-9>1000 U/mL、CEA 3.47 ng/mL;行盆腔超声:子宫前位,大小为63 mm×62 mm×62 mm,轮廓清,形态规则,子宫肌层回声均匀,内膜清晰,单层厚6 mm,回声不均匀,宫腔线分离最宽25 mm,盆腔左侧未见明显异常,宫体右上方见液暗区85 mm×83 mm×59 mm,内伴细小强光点,无血流,宫颈大小31 mm×36 mm×37 mm,回声不均质,血流较丰富;超声提示:宫颈病变可能右卵巢囊肿子宫内膜增厚 宫腔积液。盆腔MRI示:直肠上段直乙交界处肠壁明显环形增厚,最厚处约2.02 cm,增强可见强化,病变向外延伸,与右侧附件及子宫后壁分界不清,增强扫描可见宫颈后唇强化程度较其他部分低,且与直肠肿物无明显分界,病灶约4.37 cm×4.30 cm,余子宫形态饱满,信号未见异常,宫腔略增宽,其内呈液性信号,右侧附件区可见一类圆形病灶,大小约为7.69 cm×5.56 cm×8.85 cm,T1WI低信号,T2WI呈明亮高信号,DWI呈稍高信号,增强扫描后病灶无明显强化,信号尚均匀,边界光滑,与周围组织分界清楚,双侧附件区未见异常;影像诊断及建议:考虑直肠癌累及宫颈后唇可能性大,请结合临床;右侧附件区囊性病灶,考虑为卵巢囊肿;宫腔积液。胃镜:慢性非萎缩性胃炎。肠镜:直肠黏膜活检组织示炎性改变。HPV-DNA检测报告(HPV-HC2):17.07 pg/mL;HPV-DNA检测报告(分型):16、33、52、53型阳性; TCT示:未见恶性依据;宫颈细针穿刺活检病理结果:宫颈组织见腺上皮异型增生,见图2A。
因患者强烈要求尽快手术治疗,为进一步明确诊断,于2013年10月14日以“右卵巢囊肿+宫颈病变不除外恶性”为手术指征,行“腹腔镜下右附件切除术+腹膜活检术”,术中见子宫球形饱满,表面布满细小黄白色水泡状物,膀胱子宫反折腹膜粘连于子宫前壁近宫底部,子宫右后壁与肠管粘连,子宫直肠窝半封闭,直肠壁僵硬、增厚,右侧圆韧带增粗变短接近右侧盆壁。右卵巢形成直径约8 cm灰白色囊肿,表面见直径约1 cm破口,右侧输卵管拉长附于其上,左侧附件区未见明显异常,盆腔腹膜水肿、增厚状,表面布满细小黄白色水泡状结节,结肠侧沟、横膈、肝脏表面见同性质结节以右侧为重,大网膜挛缩,盆腔见淡黄色腹水约300 mL。于右卵巢及腹膜取活检送冰冻病理,结果回报:右卵巢部分取材初步考虑为交界性粘液性囊腺瘤,确诊待石蜡广泛取材,腹壁结节见肿瘤种植;腹水病理:见肿瘤细胞;行右附件切除术,术后病理:右卵巢交界性粘液性囊腺瘤伴多灶状微浸润,见图2B,右卵管未见累及,盆腔腹膜结节见浸润性种植性肿瘤结节(呈高分化粘液癌形态)。将术前宫颈穿刺活检结果加行免疫组化检查,结果提示宫颈微偏腺癌,术后诊断右卵巢交界性黏液性囊腺瘤Ⅱa,宫颈微偏腺癌Ⅱb。患者于中国医学科学院肿瘤医院病理切片会诊也为宫颈微偏腺癌,并行化疗治疗4次,病情未见好转,于2015年9月死亡。
A:宫颈组织见腺上皮异型增生。镜下所见:纤维性间质中见少许腺管,腺上皮单层柱状,排列拥挤,细胞核增大深染(HE×40); B:卵巢交界性粘液性囊腺瘤。镜下所见:卵巢囊壁衬附肠型粘液柱状上皮,部分细胞中度异型增生,间质及囊壁多灶微浸润(HE×200)图2 病例2患者病理切片结果Fig 2 Results of case 2 patient postoperative pathological sections
2 讨 论
宫颈微偏腺癌 ( minimal deviation adenocarcinoma of cervix, MDA ) 又称恶性腺瘤( adenomamaligmum) ,即宫颈恶性腺癌,是宫颈粘液性腺癌的一种,发病率极低,既往对本病的认识不清,因而有多个别名,早在1870年Gusserrow 就提出了“宫颈恶性腺癌”这一概念,随后Silverberg和Hurt在1975年一起提出“宫颈微偏腺癌”的概念。宫颈微偏腺癌在病理组织学上是由黏蛋白、分化完好的腺体组成,分化程度高,其镜下特征与正常腺体极相似,病灶常位于宫颈基质的深部,经常被成纤维细胞包绕[1],因此宫颈微偏腺癌的病理诊断如仅依靠形态学诊断漏诊率高。因宫颈微偏腺癌是宫颈粘液性腺癌的一种,因而宫颈微偏腺癌的患者多以阴道流液为主要表现,且常合并粘液性疾病,如卵巢粘液性肿瘤、消化道粘液性疾病(Peutz-Jeghers综合征)等。现在研究显示宫颈微偏腺癌细胞形态、免疫表型与胃黏膜相似,HPV检测常为阴性,并有良性病变的组织学特征[2-3],2014年WHO将其分类更改为高分化的胃型粘液癌(gastric-type adenocarcinoma,GAS)的一种。
2.1 可能的发病机制
关于宫颈微偏腺癌的发病机制有多种学说,但目前尚无统一结论。尽管宫颈微偏腺癌与宫颈粘液性腺癌有很多共同点,并且被WHO定义为宫颈粘液性腺癌的一种高分化亚型,但是并没有阐述清楚宫颈微偏腺癌是否由宫颈粘液性腺癌分化而来,有研究发现二者在遗传学上有一定的相关联。虽然宫颈微偏腺癌属粘液性腺癌的一种,且约80%的宫颈粘液性腺癌的患者HPV检测阳性,但是宫颈微偏腺癌的HPV检测却为阴性,这与小叶性宫颈内膜腺体增生(lobular endocervical glandular hyperplasia,LEGH)相同,因此有学者认为宫颈微偏腺癌和其所属的宫颈胃型腺癌可能共同起源于LEGH,且宫颈胃型腺癌可能来源于宫颈微偏腺癌的去分化[4-5]。其中,宫颈胃型腺癌是2014年WHO新定义的一种黏蛋白状腺癌亚型,小叶性宫颈内膜腺体异型增生又称叶状宫颈内膜腺体增生,是1999年Nucci等[6]提出的概念,用于描述一组良性病变,该组病变的共同特点是宫颈小腺体的小叶性增生。
此外,宫颈微偏腺癌也常与Peutz-Jeghers综合征相伴发。Peutz-Jeghers综合征(Peutz-Jeghers syndrome,PJS)是常染色体显性家族性黏膜皮肤色素沉着胃肠道息肉病,根据一般流行病学统计,Peutz-Jeghers综合征患者有很高的患恶性肿瘤的风险[7]。有研究发现p16可能与合并Peutz-Jeghers综合征的宫颈微偏腺癌有关[8]。也有研究显示宫颈微偏腺癌的发生可能由染色体19p13.3带上的D19S216区上的抑癌基因突变所致[9]。
2.2 与卵巢粘液性肿瘤关系
本组病例1、2均为宫颈微偏腺癌合并卵巢粘液性肿瘤的病例,Gilks等[2]报道宫颈微偏腺癌合并卵巢粘液性肿瘤比例为50%(13/26)。虽然有学者认为宫颈微偏腺癌与卵巢粘液性肿瘤相伴发属偶然事件[10],但宫颈微偏腺癌、Peutz-Jeghers综合征、卵巢粘液性肿瘤均为粘液性疾病,其可能源自同一基因的突变,因而临床上这几种疾病常伴发。STK11基因是一种抑癌基因,已证实其突变会导致Peutz-Jeghers综合征的发生,Kuragaki等[11]研究发现STK11基因突变在宫颈微偏腺癌的发生中也起重要作用,这也印证了共同起源的猜测。尽管没有研究明确显示宫颈微偏腺癌、Peutz-Jeghers综合征、卵巢粘液性肿瘤之间的关系,但是一些研究认为Peutz-Jeghers综合征、卵巢粘液性肿瘤的发生为宫颈微偏腺癌的发生提供了促进肿瘤发生的微环境。
另有报道认为宫颈微偏腺癌与卵巢肿瘤并非伴发关系,而系转移所致。Goedhals等[12]于2008年报道了1例经二次手术,最终确诊为卵巢粘液性囊腺癌伴输卵管及宫颈转移的病例。郑益红等[13]也报道了2例宫颈微偏腺癌发生卵巢转移的病例,该病例病理经免疫组化诊断为宫颈微偏腺癌伴双卵巢转移,这为宫颈微偏腺癌与卵巢粘液性肿瘤的关系提出新启发,并为病理科医生带来挑战。卵巢粘液性囊腺癌与微偏腺癌病理特征相似,如发生转移,病理很难仅依靠形态学区分原发灶与转移灶,因此宫颈微偏腺癌伴发卵巢粘液性囊腺癌时,需加行免疫组织化学有助于宫颈微偏腺癌的诊断。Guo等[14]分析了60例宫颈微偏腺癌的病例,总结出CEA、p53、CA125、Ki-67、SMA、CA19-9、MU66、HIK-1083、CK7、CK19均对宫颈微偏腺癌的诊断有特异性。Yang等[15]通过对20例病例的研究发现,在宫颈微偏腺癌中ER、PR均不表达,该研究还发现FOXP1(Forkhead box protein P1)表达对本病诊断有帮助。此外,单克隆抗体HIK-1083也被证实对宫颈微偏腺癌的诊断有帮助,但是,在子宫内膜腺体增生、幽门腺体中也可以检测到HIK-1083阳性,因此特异性不高。
2.3 临床特点
宫颈微偏腺癌的临床表现缺乏特异性,以阴道排液(早期)、阴道不规则流血(晚期)最常见。对宫颈微偏腺癌患者行妇科检查时早期多不易发现异常[16],晚期宫颈可增大、质地变硬,宫颈表面可有结节。本组病例1患者无阴道异常排液及不规则流血等症状,TCT也未见异常,仅妇科检查时见宫颈质硬,宫颈柱状上皮外移1/3~2/3,最终诊断为宫颈微偏腺癌早期病例,可见宫颈微偏腺癌临床表现多种多样,早期仅凭妇科检查诊断不易,但当年轻妇女因反复阴道流(粘)液而就诊时,如可排除阴道炎诊断,应警惕宫颈微偏腺癌可能。有研究报道了1例宫颈微偏腺癌伴重度低钾血症的病例,其认为低钾可能与阴道大量失液所致电解质失衡有关[17],因此提示我们当有电解质失衡合并宫颈异常排液时可考虑本病。病例1患者术前顽固性低钾原因不明,不除外与阴道隐性排液有关。
2.4 诊 断
有研究发现宫颈鳞状细胞癌的HPV阳性率为100%(52/52),宫颈腺癌的阳性率为60%(38/63),而宫颈微偏腺癌和LEGH的HPV阳性率均为0%(0/20、0/72)[10,18],细胞学检查诊断宫颈微偏腺癌的诊断率只有32.7%[19], HPV检查常为阴性。有个案报道显示抗HPV-18型感染治疗可能对治疗宫颈微偏腺癌意义重大[20]。宫颈微偏腺癌在超声上的表现是宫颈增大,有多房性、囊性病灶,或是回声不均的低回声区,部分可有实性部分组成[16],彩色多普勒超声检查均提示病灶处有血流改变。宫颈微偏腺癌在MRI上的典型表现是多房性囊性病灶,很多个小囊灶组成类似不规则的“花朵型”多房囊性灶,可有实性部分成分,实性部分常位于宫颈间质深部,T1WI图像上呈中到高信号,T2WI图像上呈略增强信号,其中T2WI信号对宫颈微偏腺癌的诊断更敏感[21]。Mceachern等[22]总结出宫颈微偏腺癌在CT上常表现为缺乏特异性的囊性包块,且行CT检查的初衷并不是检查宫颈微偏腺癌,多由于其他原因(外伤)而行CT检查。
常规宫颈癌早期病变筛查的检出率不高,当临床症状与常规筛查结果不符时,应结合影像学检查,如影像学提示宫颈处囊性病灶(伴/不伴实性部分)应警觉本病,并同时行宫颈穿刺、宫颈锥切等进一步检查。本组病例2患者以卵巢肿瘤就诊,行妇科检查时宫颈异常,结合HPV筛查结果考虑宫颈病变的可能,但行2次阴道镜下宫颈活检均提示炎症,入院后行宫颈细针深部穿刺术加行免疫组化才最终确诊为宫颈微偏腺癌,这个病例提示临床医生,宫颈疑有本病时应行宫颈穿刺,如结果为炎症也不要放弃,可再次穿刺,争取穿刺到病灶处再加行免疫组化基本可确诊。由于宫颈微偏腺癌累及的腺体常存在于宫颈间质的深部并呈内生型生长,颈管骚刮术、宫颈锥切对本病的漏诊率较高。这也提示临床医生宫颈微偏腺癌的病灶很深,穿刺时应行深部穿刺,多次取材,争取穿刺到病灶处,所取出的组织如加行免疫组化更有助于确诊。
2.5 治疗与预后
宫颈微偏腺癌临床较少见,容易漏诊,如果能术前正确诊断本病,采用正确的治疗策略,早期宫颈微偏腺癌的预后尚可,因此宫颈微偏腺癌的预后与临床医生的警觉性相关,如能早期诊断对该病的意义重大。Lim等[16]对18个早期病例进行了49.2个月的长期随访发现16/18的病例并没有出现临床复发的迹象,5年生存率为88%,即早期病例5年生存率较高。Lim的研究显示影像学上表现为实性肿物、向子宫腔内浸润生长、转移、阴道异常排液或伴发卵巢肿瘤的宫颈微偏腺癌患者常常预后欠佳,余预后尚可。
对于早期患者(IA1、IA2)如有希望保留生育功能的可以先行保守治疗,但应慎重掌握指征,并需严密随诊观察。对于晚期宫颈微偏腺癌患者,原则上采用以放化疗为主的综合治疗方式。Ferrandina等[23]报道了1例宫颈微偏腺癌行宫颈癌根治术后加用放化疗成功治疗(1年未复发)的病例,认为放化疗对宫颈微偏腺癌有一定疗效,但也有研究显示宫颈微偏腺癌对放化疗均不敏感。现在关于此疾病的文献多为病例报道,缺乏大规模的回顾性或前瞻性研究,故目前针对其治疗方案多基于经验用药。
[1] Young RH, Clement PB. Endocervical adenocarcinoma and its variants: their morphology and differential diagnosis[J]. Histopathology, 2002, 41 (41): 185-207.
[2] Gilks CB, Young RH, Aguirre P, et al. Adenoma malignum (minimal deviation adenocarcinoma) of the uterine cervix. A clinicopathological and immunohistochemical analysis of 26 cases[J]. Am J Surg Pathol, 1989, 13 (9): 717-745.
[3] Mikami Y, Mccluggage WG. Endocervical glandular lesions exhibiting gastric differentiation: an emerging spectrum of benign, premalignant, and malignant lesions[J]. Adv Anat Pathol, 2013, 20 (4): 227-253.
[4] Mikami Y, Kiyokawa T, Hata S, et al. Gastrointestinal immunophenotype in adenocarcinomas of the uterine cervix and related glandular lesions: a possible link between lobular endocervical glandular hyperplasia/pyloric gland metaplasia and adenoma malignum[J]. Mod Pathol, 2004, 17: 962-972.
[5] Takatsu A, Miyamoto T, Fuseya C, et al. Clonality analysis suggests that STK11 gene mutations are involved in progression of lobular endocervical glandular hyperplasia (LEGH) to minimal deviation adenocarcinoma (MDA)[J]. Virchows Arch, 2013, 462 (6): 645-695.
[6] Nucci MR, Clement PB, Young RH. Lobular endocervical glandular hyperplasia, not otherwise specified: a clinicopathologic analysis of thirteen cases of a distinctive pseudoneoplastic lesion and comparison with fourteen cases of adenoma malignum[J]. Am J Surg Pathol, 1999, 23 (8): 886-976.
[7] Li Y, Zeng Q, Liao Z, et al. Peutz-jeghers syndrome and family survey: A case report[J]. Int J Clin Exp Pathol, 2013, 6 (5): 982-985.
[8] Peng WX, Kure S, Ishino K, et al. P16-positive continuous minimal deviation adenocarcinoma and gastric type adenocarcinoma in a patient with Peutz-Jeghers syndrome[J]. Int J Clin Exp Pathol, 2015, 8 (5): 5877-5958.
[9] Lee J, Dong S, Kim H, et al. A distinct region of chromosome 19p13.3 associated with the sporadic form of adenoma malignum of the uterine cervix[J]. Cancer Res, 1998, 58 (6): 1140-1143.
[10] Solmaz U, Dereli L, Mat E, et al. Adenoma malignum of the cervix diagnosed after surgery based on a prediagnosis of ovarian cancer[J]. J Obstet Gynaecol, 2014, 35(1):1-2.
[11] Kuragaki C, Enomoto T, Ueno Y, et al. Mutations in the STK11 gene characterize minimal deviation adenocarcinoma of the uterine cervix[J]. Lab Invest, 2003, 83(1):35-45.
[12] Goedhals J, Van DMJ, Yazbek VA, et al. Adenoma malignum-like mucinous ovarian carcinoma[J]. Histopathology, 2008, 53 (3): 352-355.
[13] 郑益红, 雷英, 赖姨梅. 伴双侧卵巢转移的宫颈微小偏离型腺癌2例临床病理观察[J]. 赣南医学院学报, 2013, 33 (6): 882-883.
[14] Guo F, Hu Y, Xu X, et al. Diagnostic challenges in minimal deviation adenocarcinoma of the uterine cervix: A report of two cases and review of the literature[J]. Mol Clin Oncol, 2013, 1 (5): 833-838.
[15] Yang Q, Jiang W, Li L, et al. Forkhead box protein P1 is a useful marker for the diagnosis of mucinous minimal deviation adenocarcinoma of uterine cervix[J]. Ann Diagn Pathol, 2014, 18 (4): 232-237.
[16] Lim KT, Lee IH, Kim TJ, et al. Adenoma malignum of the uterine cervix: Clinicopathologic analysis of 18 cases[J]. Kaohsiung J Med Sci, 2012, 28 (3): 161-164.
[17] Mills KE, Shuen P, Zolis L. Adenoma Malignum Presenting With Profound Hyponatremia[J]. J Obstet Gynaecol Can, 2015, 37 (7): 624-627.
[18] Mikami Y, Kiyokawa T, Hata S, et al. Gastrointestinal immunophenotype in adenocarcinomas of the uterine cervix and related glandular lesions: a possible link between lobular endocervical glandular hyperplasia/pyloric gland metaplasia and adenoma malignum[J]. Mod Pathol, 2004, 17: 962-972.
[19] Li G, Wei J, Gui S, et al. Minimal deviation adenocarcinoma of the uterine cervix[J]. Int J Gynaecol Obstet, 2010, 110 (2): 89-92.
[20] Teixeira J C, Derchain S F, Zambelli Oliveira E R, et al. Microinvasive adenocarcinoma of the cervix in a young woman vaccinated against human papillomavirus: the screening must be continued[J]. J Low Genit Tract Dis, 2014, 18 (2): 50-53.
[21] Takatsu A, Shiozawa T, Miyamoto T, et al. Preoperative differential diagnosis of minimal deviation adenocarcinoma and lobular endocervical glandular hyperplasia of the uterine cervix: a multicenter study of clinicopathology and magnetic resonance imaging findings[J]. Int J Gynecol Cancer, 2011, 21 (7): 1287-1382.
[22] Mceachern J, Butcher M, Burbridge B, et al. Adenoma malignum detected on a trauma CT[J]. J Radiol Case Rep, 2013, 7 (4): 22-28.
[23] Ferrandina G, Carbone A, Macchia G, et al. A complete pathological response to treatment in a young patient with locally advanced minimal deviation adenocarcinoma of the uterine cervix undergoing chemoradiation followed by radical surgery[J]. Gynecol Obstet Invest, 2011, 72 (72): 141-143.
崔雨萌(1990-),女,硕士研究生。E-mail:cuiyumeng_2011@163.com
石 红,教授。E-mail:shong60@163.com
10.11724/jdmu.2017.03.21
R711.74
B
1671-7295(2017)03-0305-06
崔雨萌,石红.宫颈微偏腺癌伴双卵巢粘液性肿瘤2例报告[J].大连医科大学学报,2017,39(3):305-310.
2016-05-07;
2017-05-04)
