赤眼鳟Toll样受体9基因的cDNA全长克隆及表达特性分析
2017-07-01金生振王荣华周智愚刘巧林彭慧珍肖调义
金生振,王荣华,周智愚,刘巧林,2,彭慧珍,2,肖调义,2*
赤眼鳟Toll样受体9基因的cDNA全长克隆及表达特性分析
金生振1,王荣华1,周智愚1,刘巧林1,2,彭慧珍1,2,肖调义1,2*
(1.湖南农业大学湖南省特色水产资源利用工程技术研究中心,湖南长沙410128;2.水产高效健康生产湖南省协同创新中心,湖南常德415000)
为探究赤眼鳟()Toll样受体9基因(toll–like receptor 9,)的结构特性及其参与免疫应答草鱼呼肠弧病毒(grass carp reovirus, GCRV)感染时的表达特性,采用RACE技术克隆Sc基因cDNA全长序列,采用实时荧光定量PCR技术比较分析免疫应答GCRV的表达特性。结果显示:的cDNA全长为3 687 bp,编码1 059个氨基酸,有17个富含亮氨酸重复序列(leucine rich repeats, LRRs)结构域。在被检测的9个组织中均有表达,在中肾和头肾中的表达量最高;感染GCRV后,基因在赤眼鳟和草鱼头肾中的表达量均上调,在赤眼鳟头肾中的表达量于感染后12 h达到峰值,推测参与了赤眼鳟抗GCRV的免疫应答,且在抗GCRV入侵免疫反应中赤眼鳟较草鱼的免疫应答更为迅速。
赤眼鳟;Toll样受体9基因;草鱼呼肠弧病毒;草鱼
鱼类Toll样受体(toll–like receptors, TLRs)通过识别病原微生物保守的病原相关分子和调节宿主免疫应答的模式来识别受体家族(pattern recognition receptors, PRRs)[1–2]。TLRs家族已有多个不同类型的基因在多种脊椎动物中被鉴别,在硬骨鱼中已发现了至少26种TLRs基因[3–4]。最先于小鼠巨噬细胞中被发现[5],是先天免疫反应中主要的DNA识别受体,能特异性识别细菌或病毒中未甲基化的胞嘧啶–鸟嘌呤核苷酸(CpG),能促进炎性细胞因子分泌,最终有效控制细菌或病毒感染[6–7]。属于典型的I型跨膜蛋白,包括富含亮氨酸重复序列(leucine rich repeats, LRRs)结构域的胞外区、跨膜区和Toll/白介素–1受体(Toll–IL–1R, TIR)结构域的胞内区,其传导的信号通路主要由髓样分化因子88 (myeloid differentiation factor 88,88)介导[7]。目前,已在草鱼()、鲤鱼()、鲫()、半滑舌鳎()、大黄鱼()和虹鳟()等鱼类中被克隆和鉴定[8–13]。
赤眼鳟()与草鱼同属雅罗鱼亚科,属赤眼鳟属[14]。赤眼鳟被草鱼呼肠弧病毒(grass carp reovirus, GCRV)感染时比草鱼具有更高的成活率[14–16]。在相关抗性分子研究中已获得了赤眼鳟、、和基因参与赤眼鳟免疫应答GCRV感染时发挥重要作用的结果[17–20]。笔者克隆赤眼鳟基因()的cDNA全长序列,研究其结构特性和表达特性,并比较感染GCRV后基因在草鱼和赤眼鳟头肾中的表达差异,以期为参与赤眼鳟抗GCRV的免疫应答提供参考依据。
1 材料与方法
1.1材料
6月龄的健康赤眼鳟、草鱼购于湖南浏阳市北盛镇乌龙渔场(该渔场为湖南省省级良种场),为2015年5月繁育个体,其体长为(9.40 ± 0.75) cm,体质量为(13.50 ± 1.35) g 。赤眼鳟和草鱼各150尾,共300尾。购回后放养于80 L/箱的恒温水循环养殖系统,28 ℃养殖30 d。每箱放30尾。试验所用GCRV (106毒株,其50为1.78×107/mL)由中国水产科学研究院长江水产研究所研究员曾令兵惠赠。
1.2方法
1.2.1总RNA的提取及cDNA的合成
从养殖系统中随机选取1尾健康赤眼鳟,取其头肾组织60~80 mg,按TaKaRa MiniBEST Universal RNA Extraction Kit (TaKaRa, China)的说明提取总RNA。用核酸蛋白仪检测总RNA的质量和浓度,并用1%的琼脂糖电泳检测其完整性。以完整性好的2 μg RNA(值为1.8~2.0)为模板,按照First Strand cDNA Synthesis Kit (Fermentas, USA)的说明与Oligo(dT)18引物合成cDNA。
1.2.2基因的cDNA全长克隆
根据GeneBank中已有鲤科鱼类的序列,用Oligo 7.0软件设计引物(表1),并用引物TLR9F和TLR9R扩增中间序列。根据获得的中间序列设计扩增的3′ 和5′ 端特异性引物。将得到的PCR产物切胶回收,然后连接至pMD19–T载体,转化后挑取阳性克隆送武汉奥科鼎盛生物科技有限公司测序。

表1 本研究中所用的引物序列
1.2.3基因的生物信息学分析
用SeqMan 5.01对ccDNA的序列进行拼接;用蛋白质分析系统Expasy分析c的氨基酸序列;通过SMART预测的结构域,用ClustalX 2.1对TIR结构域进行多序列比对;用MEGA 6.0软件中的邻接法构建的系统发育树。
1.2.4基因的组织表达特性分析
从养殖系统中随机挑选3尾健康赤眼鳟,分别取其脑、鳃、肝胰脏、脾脏、中肾、头肾、鳍条、心脏、肠等9个组织,同组织混样,提取总RNA,用1%琼脂糖电泳检测RNA的完整性,并用核酸蛋白仪检测其质量和浓度。选取质量和完整性好的RNA约2 μg为模板,按照First Strand cDNA Synthesis Kit (Fermentas, USA)的说明,用模板与Oligo(dT)18引物合成第一链cDNA,产物用于下一步试验。用特异性荧光定量引物(ScTLR9–Q– F1103/R1201,=98.84%,2=0.997) 和(CiTLR9– Q–F821/R910,=97.64%,2=0.992) 扩增,内参基因为–基因。
1.2.5GCRV感染后基因的表达差异分析
从预饲养的健康赤眼鳟和草鱼(各150尾)中各选取120尾,每种鱼设3个平行攻毒处理组和1个空白对照组,每组30尾鱼饲养在养殖系统中。在试验组每尾鱼的腹腔注射200 μL GCRV病毒悬液,对照组注射等量的无菌PBS,在0 、6 、12 、24 、48、72、96 、120 h计8个时间点,于每个试验组选取3尾有出血症状的赤眼鳟和草鱼,分别提取其头肾组织的总RNA。按Fermentas试剂盒说明书逆转录合成cDNA后,用SYBR Green I染液(TAKARA, China)在CFX96荧光定量PCR仪(Bio–Rad, USA)中进行定量分析。反应体系:10 μL SYBR® Premix Ex™ (TliRNaseH Plus),上、下游引物(10 μmol/L)各0.2 μL,稀释后的cDNA模板为9.6 μL。反应程序:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火40 s,72 ℃延伸20 s,40个循环。溶解曲线温度从65 ℃升至95 ℃,每5 s增加0.5 ℃。用Bio–Rad CFX Manager Software 3.1 (Bio–Rad, USA)进行标准曲线分析和定量结果分析,采用2–ΔΔCt法计算每个样品中的相对表达量,并用GraphPad Prism 6作图。
2 结果与分析
2.1基因的cDNA全长与序列分析结果
基因cDNA全长为3 687 bp,包括ORF 3 180 bp,编码1 059个氨基酸残基,5'–非编码区(UTR) 128 bp和3'–UTR 379 bp (GeneBank登录号为KU955845)。预测该基因的蛋白质相对分子质量为121 610,等电点为8.91。SMART结构域预测结果显示:由N–端的信号肽(SP,1~18 aa)、16个LRR基序、LRR–CT基序(787~838 aa)和TM(840~862 aa)及TIR(895~1044 aa )组成(图1)。16个LRR基序分别为52~77 aa,78~107 aa,115~134 aa,189~209 aa,210~229 aa,276~295 aa,300~328 aa,356~379 aa,383~403 aa,533~559 aa,588~619 aa,642~665 aa,667~686 aa,691~710 aa,715~736 aa,737~757 aa。
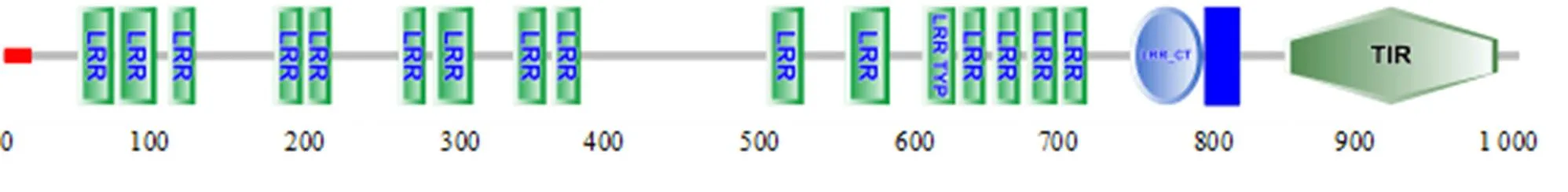
图1 ScTLR9结构域预测结果
系统发育树结果(图2)显示:整个系统发育树分为2支,硬骨鱼类分支和哺乳动物分支,其中赤眼鳟和草鱼聚为一簇。
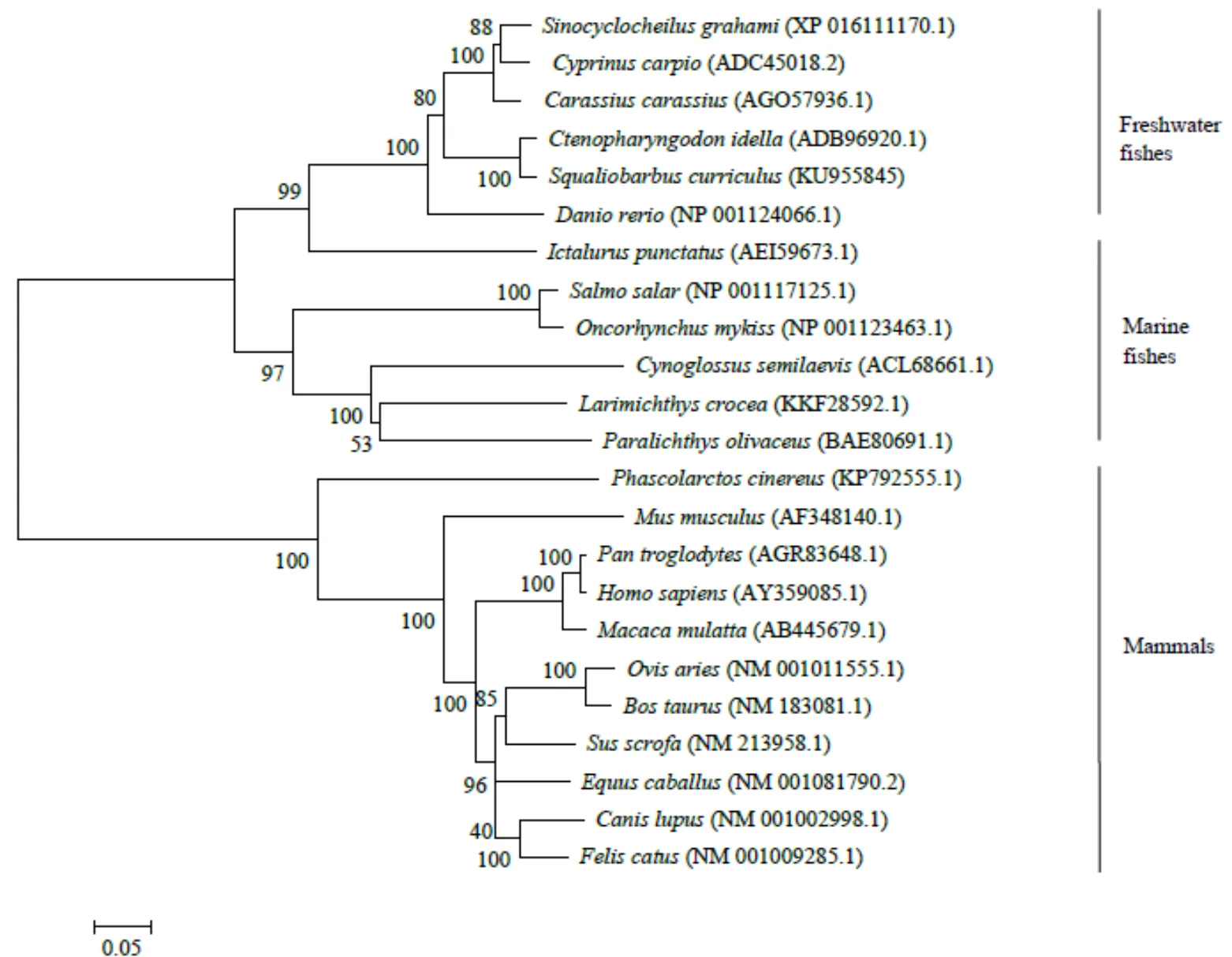
图2 赤眼鳟TLR9氨基酸序列的系统发育树
不同物种的TIR结构域氨基酸序列比对结果(图3)显示:硬骨鱼类基因的TIR结构域氨基酸序列高度保守,同时的TIR结构域包含3个高度保守的区域:Box 1(YDAFVVFD)、Box 2(LCLEDRDWLPG)和Box 3(FWNNL)。

图3 不同物种TLR9的TIR结构域同源比对结果(黑色线框标记部分为3个保守的基序)
2.2在赤眼鳟不同组织中的表达
在被检测的9个赤眼鳟组织中均有表达,其中在赤眼鳟头肾、中肾中的表达量较高,在脑中的表达量次之,在脾脏、心脏中也有一定的表达,在肝胰脏中的表达量最低(图4)。

图4 不同组织中TLR9的相对表达量
2.3GCRV感染后在赤眼鳟和草鱼头肾中的表达差异
由图5可见,在赤眼鳟和草鱼头肾中的表达模式存在差异。人工感染GCRV初期(0~12 h),在赤眼鳟头肾中的表达量显著上调,并在感染后12 h表达量达到最高,在感染后24 h出现下调;在草鱼头肾中,人工感染GCRV初期(0~12 h),的表达量基本维持不变,在感染后24 h出现明显的上调,且在感染后48 h表达量达到最高,在感染后72 h 出现下调(图5)。
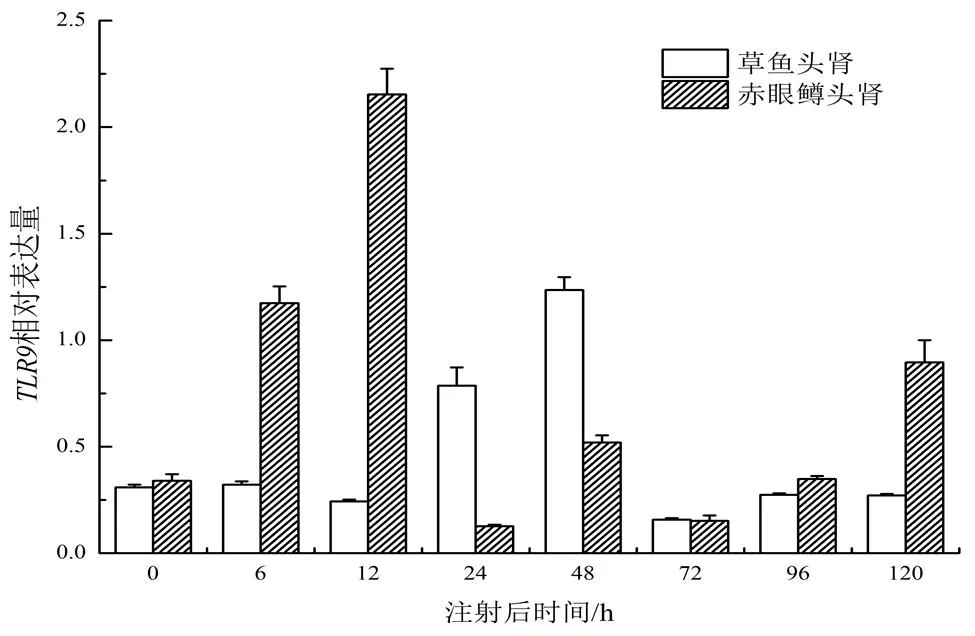
图5 GCRV感染后TLR9在赤眼鳟和草鱼头肾中的表达量
3 结论与讨论
赤眼鳟与草鱼的相似性为97%,与鲤鱼、黑鲫等鲤科鱼类的相似性也达到了87%以上。赤眼鳟由17个LRR结构域的胞外区、跨膜区和胞内TIR结构域组成,而草鱼只含有16个LRR结构域的胞外区[8]。在胞外区的246~259氨基酸残基处含有2个CXXC基序。该结构与CpG的结合及基因调控[21]有关。还含有与CpG–DNA相互作用所必须的2个氨基酸(在蛋白序列上的位置为D547和Y549)[22]。不同物种的TIR结构域多序列对比结果表明,基因TIR结构域非常保守,包含3个保守区域Box1、Box2和Box3。的3个保守区域和的一致。
Real–Time qPCR分析结果显示,c在检测的9个组织中均有表达,在头肾、中肾中的表达量较高。草鱼在鳃中的表达量最高[8]。鲤鱼在中肾中的表达量最高[9]。鲫鱼、半滑舌鳎、大黄鱼、虹鳟主要集中在脾和头肾中表达[10–13]。综上可见,虽然不同鱼类的最高表达部位不尽相同,但多数在脾和头肾中的表达较高,表明作为一种识别受体在鱼类免疫反应发挥了的重要作用。在鱼类先天性免疫反应中扮演了重要角色,赤眼鳟比草鱼具有更好的抵抗GCRV的特性[14–16]。在本试验中,感染GCRV后,在赤眼鳟抵抗GCRV时发挥了重要作用,且在赤眼鳟、草鱼头肾中的表达模式存在明显差异。在应对GCRV时,比的应答时间更短,反应更迅速,且的相对表达量较早达到峰值,整体相对表达量远高于草鱼的。由以上结果可推测在赤眼鳟抵抗GCRV入侵中扮演了重要角色,但由于赤眼鳟和草鱼在结构域上的差异,其在草鱼和赤眼鳟中可能存在不同的识别机制和传导通路[21–22]。具体的识别机制和传导通路还待进一步研究。
本研究结果表明,赤眼鳟具有TLRs家族的典型结构特征,由17个富亮氨酸结构域(LRRs)、跨膜结构域(TM)和Toll/白介素–1受体结构域(TIR)组成。赤眼鳟在头肾和中肾中的相对表达量较高;在应对GCRV时,比的应答时间更短,反应更快。该结果提示在赤眼鳟抵抗GCRV入侵时发挥了重要作用,但其作用机制还有待研究。
[1] AKIRAS,UEMATSUS,TAKEUCHIO.Pathogen recognition and innate immunity[J].Cell,2006,124(4):783–801.DOI:10.1016/j.cell.2006.02.015.
[2] TAKEDAK,KAISHOT,AKIRAS.Toll–likereceptors[J].AnnuRevImmunol,2003,21:335–376. DOI:10.1146/annurev.immunol.21.120601.141126.
[3] AOKI T,TAKANO T,SANTOS M D,et al.Molecular innate immunity in teleost fish:review and future perspectives[C]//TSUKAMOTO K,KAWAMURA T,TAKEUCHI T,et al.Fisheries for global welfare and environment.Tokyo:TERRAPUB,2008:263–276.
[4] ZHULY,NIEL,ZHUG,et al.Advances in research of fish immune–relevant genes:a comparative overview of innate and adaptive immunity in teleosts[J].DevCompImmunol,2013,39(1/2):39–62.DOI:10.1016/j.dci. 2012.04.001.
[5] PALTIY.Toll–like receptors in bony fish:from genomics to function[J].DevCompImmunol,2011,35(12):1263–1272.DOI:10.1016/j.dci.2011.03.006.
[6] ARPAIAN,BARTONG M.Toll–like receptors:key players in antiviral immunity[J].CurrOpinVirol,2011,1(6):447–454.DOI:10.1016/j.coviro.2011.10.006.
[7] MÜLLERT,HAMMS,BAUERS.TLR9–mediatedrecognitionof DNA[J].Handb Exp Pharmacol,2008(183):51–70.DOI:10.1007/978–3–540–72167–3_3.
[8] 杨春荣,苏建国,彭丽敏,等.草鱼TLR9基因全长cDNA的克隆及特征分析[J].水产学报,2011,35(5):641–649.
[9] KONGCHUMP,HALLERMANE M,HULATAG,et al.Molecularcloning,characterization and expression analysis of,andgenes in common carp ()[J].Fish ShellfishImmunol,2011,30(1):361–371.DOI:10.1016/j.fsi.2010.11.012.
[10] 王俊丽,郝光,雒燕婷,等.鲫基因克隆及生殖因素对其在肠道表达的影响[J].中国水产科学,2014(3):432–441.
[11] YUY,ZHONGQ,LIC,et al.Isolation and characterization of toll–like receptor 9 in half–smooth tongue sole[J].Fish Shellfish Immunol,2009,26(3):492–499.DOI:10.1016/j.fsi. 2009.02.005.
[12] YAOC L,KONGP,WANGZ Y,et al.Cloning and expression analysis of two alternative splicing toll–like receptor 9 isoforms A and B in large yellow croaker,[J].Fish ShellfishImmunol,2008,25(5):648–656.DOI:10.1016/j.fsi.2008.07.006.
[13] ORTEGA–VILLAIZANM,CHICOV,FALCOA,et al. The rainbow troutgene and its role in the immune responses elicited by a plasmid encoding the glycoprotein G of the viral haemorrhagic septicaemia rhabdovirus (VHSV)[J].MolImmunol,2009,46(8/9):1710–1717.DOI:10.1016/j.molimm.2009.02.006.
[14] 刘巧林.草鱼与赤眼鳟杂交F1遗传特征及其对草鱼呼肠弧病毒抗性的研究[D].长沙:湖南农业大学,2013.
[15] 彭慧珍.感染GCRV草鱼和赤眼鳟miRNA的鉴定与分析[D].长沙:湖南农业大学,2014.
[16] 王红权.基于GCRV抗性提高的草鱼免疫特性分析[D].长沙:湖南农业大学,2014.
[17] 肖调义,李伟,王荣华,等.赤眼鳟Toll样受体3基因cDNA全长克隆及表达分析[J].水生生物学报,2016,40(5):894–901.
[18] 王荣华,李伟,肖调义,等.赤眼鳟基因cDNA克隆与表达特性研究[J].水生生物学报,2016,40(3):459–466.
[19] 彭慧珍,刘敏,刘巧林,等.赤眼鳟基因全长cDNA克隆及其经GCRV攻毒后的组织表达分析[J].水生生物学报,2014(6):993–1001.
[20] 陈开健, 王静安, 刘巧林, 等. 赤眼鳟基因的cDNA克隆及其应对GCRV的免疫表达特性[J]. 湖南农业大学学报(自然科学版), 2016,42(6):641–646.
[21] BELLJ K,MULLENG E,LEIFERC A,et al. Leucine–rich repeats and pathogen recognition in Toll–like receptors[J].TrendsImmunol,2003,24(10):528–533.
[22] PETERM E,KUBARENKOA V,WEBERA N,et al. Identification of anN–terminalrecognitionsiteinthatcontributestoCpG–DNA–mediatedreceptoractive- tion[J].JImmunol,2009,182(12):7690–7697. DOI:10. 4049/jimmunol.0900819.
责任编辑:王赛群
英文编辑:王库
Molecular cloning and expression characteristics of toll–like receptor gene 9 in
JIN Shengzhen1, WANG Ronghua1, ZHOU Zhiyu1, LIU Qiaolin1,2, PENG Huizhen1, 2, XIAO Tiaoyi1,2*
(1.Hunan Engineering Research Center for Utilization of Characteristics of Aquatic Resources, Hunan Agricultural University, Changsha 410128, China; 2.Collaborative Innovation Center for Efficient and Health Production of Fisheries in Hunan Province, Changde, Hunan 415000, China)
In order to investigate the structural characteristics of the toll–like receptor gene 9 in(), as well as its expression feature on the immune response in case of GCRV infection, the full–length cDNA of genewas cloned using RACE technology in the study, and the expression ofimmune response in GCRV infection was analyzed using real–time qPCR. The results showed that the full–length cDNA ofwas 3 687 bp encoding with a polypeptide of 1 059 amino acid residues and containing 17 LRR domains. ThemRNA was expressed in all collected tissues, and the relative expression level in mesonephros and head kidney were higher than that in other tissues; Under GCRV infection, the expression ofwere up–regulated in head kidney for barbel chub and grass carp, the relative expression level reached its peak in 12 h forin head kidney of barbel chub. It was speculated that the genewas more quickly on the immune response against GCRV invasion in toll–like receptor than that in grass carp, it played an important role on the response to GCRV infection.
; toll–like receptor 9();grass carp reovirus (GCRV);
10.13331/j.cnki.jhau.2017.03.015
S965.199;Q959.46+8
A
1007-1032(2017)03-0304-06
2017–01–12
2017–04–04
国家自然科学基金面上项目(31272652,31572615)
金生振(1992—),男,硕士研究生,主要从事水生动物遗传育种研究,Jins92927@126.com;
,肖调义,博士,教授,主要从事水生动物遗传育种研究,tyxiao1128@163.com
投稿网址:http://xb.hunau.edu.cn
