黄颡鱼胰岛素样生长因子结合蛋白1基因的克隆及表达分析
2017-07-01梁宏伟李忠罗相忠邹桂伟
梁宏伟,李忠,罗相忠,邹桂伟*
黄颡鱼胰岛素样生长因子结合蛋白1基因的克隆及表达分析
梁宏伟1,2,李忠1,罗相忠1,邹桂伟1*
(1.中国水产科学研究院长江水产研究所,湖北武汉 430223;2.淡水水产健康养殖湖北省协同创新中心,湖北武汉 430070)
为研究黄颡鱼()胰岛素样生长因子结合蛋白1基因()的特征,阐明基因在不同性别黄颡鱼组织中的表达特征和IGFBP1蛋白在雌、雄黄颡鱼肌肉中的表达差异,克隆基因的cDNA全长,并进行实时荧光定量PCR检测和Western Blot分析。结果表明:黄颡鱼基因cDNA全长为1 259 bp,其开放阅读框长度为714 bp,编码237个氨基酸,3端和5端非翻译区分别为407 bp和138 bp;黄颡鱼基因核苷酸序列与鲇形目斑点叉尾鮰的相似度(89%)较高,与鲢、鲤、鲫、草鱼和团头鲂等的差异较大;肝脏是黄颡鱼基因mRNA表达最丰富的组织,基因在雄性个体心脏、肾脏、肌肉和肠组织中的表达量显著高于雌性的(<0.05);IGFBP1蛋白在雌、雄黄颡鱼肌肉组织中都有表达,且在雄性个体中的表达量高于在雌性个体中的表达量。
黄颡鱼;胰岛素样生长因子结合蛋白1基因;心脏;肾脏;肌肉;肠
胰岛素样生长因子(Insulin–like growth factors,IGFs)包括IGF、IGF受体(IGFR)、IGF结合蛋白(IGF binding proteins,IGFBPs)和IGFBP水解酶等,在动物生长发育过程中发挥着重要的调控作用[1]。IGF系统包括一系列的多功能细胞增殖调控因子,IGFBP与IGF结合后抑制IGF与其受体结合,发挥调控作用[2]。IGFBP还可以通过延长IGF半衰期来调节IGFs 的生物活性[2–3]。动物体内存在的6种IGFBPs[3]虽然在结构上高度同源,但其各自发挥的功能和组织表达结构[4]不同。IGFBP1与其他几种结合蛋白有着明显的差异,它通过运输和调节IGF与受体结合而参与机体的生长、发育和生殖等生理过程[5]。关于鱼类基因的功能研究越来越受到重视,草鱼[6]、鲢[7]、建鲤[8]和花鲈[9]等的基因已被克隆和研究。
黄颡鱼()在中国广泛分布,由于具有肌间刺少、肉质细嫩、营养丰富、经济价值较高等优点,已成为中国重要的淡水经济养殖鱼类之一。不同性别黄颡鱼表现出明显的生长差异,雄性比雌性生长快,同龄性成熟黄颡鱼雄性的个体明显大于雌性的,具有明显的雄性偏倚性。脊椎动物个体的差异主要由生长速率决定的,而生长速率又受到下丘脑—垂体—性腺轴及其他组织分泌的生长激素或类胰岛素生长因子的调控[10]。鉴于基因参与鱼类的生长和发育,笔者分析黄颡鱼基因的序列特点和表达特征,并分析IGFBP1蛋白在雌、雄个体肌肉组织中的表达,旨在为研究基因在黄颡鱼生长中的作用提供参考。
1 材料与方法
1.1材料
黄颡鱼采自中国水产科学研究院长江水产研究所试验场。随机选取18月龄健康无伤的雌、雄性个体各10尾,雌性个体体质量为(50±5) g,全长为(14±2) cm;雄性个体的体质量为(70±8) g,全长为(18±3) cm。将试验鱼用MS–222麻醉后,迅速采集其鳃、肌肉、心脏、脑、肝脏、脾脏、胃和肠等组织置于液氮中冷冻保存。
1.2方法
1.2.1总RNA的提取和cDNA第一链的合成
用Trizol Reagent(Introvigen)进行不同组织总RNA的提取。以总RNA为模板,按照RNA PCR Kit(AMV) Ver3.0 (TaKaRa)试剂盒的方法合成cDNA第一链,–20 ℃保存备用。
1.2.2基因的克隆
通过Clustalx对从GenBank获得的已有鱼类基因mRNA序列进行比对。用Primer 5.0软件设计保守区域引物(IGFBP1F/ IGFBP1R)。引物信息见表1。

表1 黄颡鱼IGFBP1基因克隆及表达分析的引物
以制备的cDNA第一链为模板进行PCR扩增。反应体系总体积为50 μL,包括1×Buffer 5 μL,10 μmol/L上、下游引物各1 μL,10 μmol/L的dNTPs 1 μL,5 UDNA聚合酶0.3 μL,约100 ng cDNA模板。反应条件:94 ℃预变性3 min;94 ℃变性1 min,56 ℃退火1 min,72 ℃延伸90 s,共进行32个循环;最后72 ℃延伸10 min。PCR扩增产物用2%琼脂糖凝胶电泳进行检测,并用AxyPrep DNA凝胶回收试剂盒(Axygen)进行胶回收,然后以pMD–18T为载体转化插入的大肠杆菌感受态细胞。将经鉴定为阳性的克隆送武汉擎科生物科技有限公司进行测序。基于获得的黄颡鱼基因的保守序列,设计3′ RACE和5′ RACE特异性引物(表1),用SMART RACE cDNA Amplification Kit试剂盒(Clontech)进行3′末端和5′末端的扩增,并克隆测序。
1.2.3黄颡鱼基因的序列分析
用软件DNASTAR 6.0将克隆得到的基因保守区序列、3′末端和5′末端序列进行拼接,得到cDNA序列全长,并查找开放阅读框和预测氨基酸编码序列、相对分子质量和等电点。将cDNA序列在NCBI中进行Blast同源比对,并预测蛋白质结构域和细胞定位。用在线工具ExPASy(http://www.expasy.org/)预测信号肽和疏/亲水性。通过MEGA 6.0软件构建基于基因氨基酸序列的Neighbor– Joining(NJ)系统发育树。
1.2.4基因在不同性别黄颡鱼组织中的表达特征
基于克隆得到的黄颡基因cDNA序列设计实时荧光定量PCR引物(表1),以黄颡鱼基因为内参(引物β–actin1/β–actin2,表1),对基因在雌、雄黄颡鱼脑、鳃、心脏、肝脏、肾脏、胃、肠和肌肉组织中的表达特征进行分析。反应体系:2×SYBR Premmix Ex(TakaRa) 12.5 μL,10 μmol/L上、下游引物各0.5 μL,2 μL模板cDNA,9.5 μL ddH2O。反应条件:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,40个循环。试验设置3个重复。
1.2.5IGFBP1蛋白在雌、雄黄颡鱼肌肉中的表达
取雌、雄黄颡鱼各2尾,分别向其肌肉组织中加入蛋白抽提液,裂解后离心,将上清液转移至离心管,通过BCA蛋白质定量试剂盒(TIANGEN)进行蛋白定量,校正,使其均一化。向蛋白中加入上样缓冲液,煮沸3 min,迅速进行冰浴,然后进行10% SDS–PAGE凝胶电泳分离,随后将分离的蛋白转至聚偏氟乙烯树脂(PVDF)膜上,用5%牛血清蛋白(BSA)于室温封闭1 h,用TBS/T溶液漂洗3次。将兔anti–IGFBP1 (ab4242,Abcam)抗体密封后于4 ℃过夜,用TBS漂洗3次。加入山羊抗兔的用辣根过氧化酶(HRP)标记的二抗(Santa Cruz Biotechnology),于室温孵育1 h,再漂洗3次。用ECL Plus Detection Kit试剂盒进行检测,并用GK–330C+凝胶成像系统进行图像分析。
2 结果与分析
2.1黄颡鱼基因的cDNA克隆与序列分析
克隆获得的黄颡鱼基因cDNA序列全长为1 259 bp(GenBank登录号为HM210741),其中,开放阅读框(open reading frame,ORF)为714 bp,3′和5′ 非翻译区分别为407 bp和138 bp,碱基A+T的含量为55.1%,G+C的含量为44.9%。其核苷酸序列包含了4个3′端与mRNA瞬时表达相关的快速降解信号ATTTA和1个低氧诱导因子1的辅助顺式原件(HAS)序列CAGGT。核苷酸序列同源性比较结果表明,基因核苷酸序列与同属鲇形目斑点叉尾鮰的同源性最高(89%),与鲢的同源性为73%,与鲤、鲫、草鱼和团头鲂的同源性均为72%。

“·”为终止密码子;“↓”为信号肽切割位点;“ mRNA”为快速降解信号;“ ”为HAS 序列。
黄颡鱼基因编码237个氨基酸,由20种氨基酸组成,其中亮氨酸(Leu)含量最高,为12.2%。蛋白质相对分子质量为26 100,等电点(pl)为8.01。编码蛋白质信号肽序列的长度为29个氨基酸(AA),切割位点位于N端29位L(Leu)和30位E(Glu)之间。蛋白质二级结构预测结果表明,黄颡鱼基因编码的蛋白在N端和C端分别包含保守结构域IGFBP 超家族(IGFBP superfamily)和超家族(TY superfamily)结构域。黄颡鱼编码氨基酸序列的同源性比对结果表明,黄颡鱼与同为鲇形目的斑点叉尾鮰的相似性最高,达80%,与草鱼和鲢的同源性为59%,与团头鲂和斑马鱼的同源性为58%,与其他鱼类的序列同源性也在60%左右。黄颡鱼IGFBP–1蛋白序列在不同鱼类中的差异较大。
2.2黄颡鱼基因的进化分析
用黄颡鱼基因的氨基酸序列与GenBank中获得的其他16个物种的氨基酸序列构建NJ系统进化树(图2)。结果显示,17个物种分为两大类群,鱼类为单独一个类群,与其进化地位一致,黄颡鱼基因首先与同属鲇形目的斑点叉尾鮰聚为一支,然后与鲤科的草鱼、鲢、团头鲂、鲫、鲤和斑马鱼聚为一支,同属鲈形目的花鲈和黄金鲈聚在一起;在另外一个大类群中,人和小鼠聚为一支,牛和猪聚为一支,然后再与非洲爪蟾聚在一起。

图2 基于IGFBP1基因氨基酸序列的系统发育树
2.3黄颡鱼基因在雌、雄个体组织中的表达特征
实时荧光定量PCR分析结果(图3)表明,黄颡鱼基因mRNA在脑、鳃、心脏、肝脏、肾脏、胃、肠和肌肉组织中的表达量差异较大,在肝脏组织的表达量最大,其次是在肠道、肌肉和肾脏中的表达,在心脏、脑和腮组织中的表达量相当。基因在雌、雄黄颡鱼中的表达分析结果(图3)表明,雄性心脏、肾脏、肌肉和肠组织中的表达量显著高于雌性的(<0.05),而雌性鳃中的表达量显著大于雄性的(<0.05);在脑、肝脏和胃组织中的表达雌、雄差异没统计学意义(>0.05)。
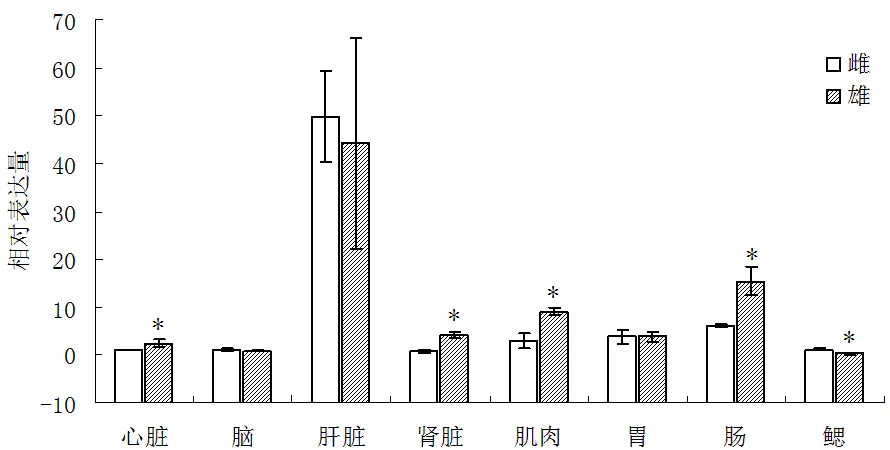
组织
2.4IGFBP1蛋白在雌、雄黄颡鱼肌肉组织中的表达特征
以甘油醛–3–磷酸脱氢酶(glyceraldehyde–3– phosphate dehydrogenase,GAPDH)蛋白作为内参,检测IGFBP1蛋白在雌、雄黄颡鱼肌肉组织中的表达情况(图4),结果表明,IGFBP1蛋白在雌、雄黄颡鱼肌肉组织中均有表达,且在雄性中的表达高于在雌性中的。

M 雄性个体;F 雌性个体。
3 结论与讨论
包括鱼类在内的脊椎动物的生长主要受胰岛素样生长因子(IGFs)信号通路的调控[11]。IGFBP1是IGFs通路中的一个重要组成蛋白。近年来,一些硬骨鱼类的基因全序列或部分序列被克隆和研究[12–18]。本研究中成功克隆了黄颡鱼基因的cDNA全长序列,其核苷酸序列与同属鲇形目的斑点叉尾鮰的同源性较高,而与其他物种的同源性较低。基因所编码的AA序列也呈现相似的特征,即在同目物种间相对保守,而与其他物种序列相比差异较大。
鱼类序列存在一些保守结构[19]。在IGFBP1蛋白质结构中,N端是与IGF–1结合的重要区域;中心区决定了IGFBP的特异性;C端部分参与与IGF–1的结合,并与细胞粘附相关。IGFBP1作为一个重要的结合蛋白,通过这些保守结构序列与其他蛋白结合,从而发挥IGFBP1的生物学作用。首先,动物IGFBP1氨基酸序列N–端存在保守的CGCCXXC结构,该结构是IGFBP1与IGFs结合的重要序列结构[20];其次,在IGFBP1的C端有一个CWCV保守区域结构,该结构在LGFBPs蛋白与IGFs以及与细胞外相关结构的结合中有重要作用[9]。与其他物种的IGFBP1氨基酸结构相比,黄颡鱼的N端和C端同样存在这2种保守序列,其中黄颡鱼IGFBP1氨基酸序列CGCCXXC的结构为CGCCLAC。此外,在多数物种基因的非编码区还含有AT富集区,存在多个ATTTA序列,此序列可参与选择性的mRNA降解过程[21]。花鲈序列包含3个ATTTA结构,1个存在于5端非翻译区,2个存在于3端非翻译区[9]。黄颡鱼基因的5端非翻译区有2个ATTTA序列,分别位于90~94 nt和98~102 nt,3端非翻译区有4个ATTTA序列,分别位于965~969、1 097~1 101、1 120~1 124、1 167~1 171 nt,表明黄颡鱼的更容易启动选择性的mRNA降解过程。
硬骨鱼肝脏是IGFBP1合成的主要场所[22]。基因在肝脏组织中的表达最丰富。在大菱鲆中,基因在肝脏中的表达量最高,在脾脏中的表达量次之,而在心脏、胃、肾脏中的表达量较低,在肠中只有微量表达[3]。mRNA在花鲈肝脏中的表达量最高,在肌肉和脾脏中有较高表达,而在脑、垂体、肠、头肾中只有少量的表达,在其他组织中的表达量极少[9]。本研究中,黄颡鱼基因在肝脏中的表达量最高,在肌肉、肾脏和肠中的表达量次之,在心脏、脑和鳃中的表达量较低。鱼类的mRNA除在肝脏中有丰富的表达外,在肌肉、肠和肾等组织中也有表达,但在不同物种间的表达特征不同。这可能与物种的生理状态、生活环境和生活习性等有关。黄颡鱼雄性个体的表达量高于雌性个体的。这与黄颡鱼雄性的生长比雌性快相一致。鱼类的生长受GH /GHR/IGF轴的调控[23],IGFs是生长轴中的关键因子。鱼类 IGFs的基本功能是促生长。IGFBPs 家族成员与IGFs结合,调节IGFs的作用效率,并用其运送 IGFs到靶组织,从而发挥IGFs的生物学效应[24]。
本研究结果表明,基因在雌、雄黄颡鱼不同组织中的表达存在差异,无论是mRNA还是蛋白的表达,在肌肉组织中的表达均是雄性高于雌性。这与雄性个体的生长快于雌性个体的研究结果相一致,因此,基因可能与不同性别个体的生长调控有关。关于基因对黄颡鱼生长的调控作用还有待研究。
[1] HAKUNO F,FUKUSHIMA T,YONEYAMA Y,et al. Novel functions of high–molecular–mass complexes containing insulin receptor substrates in mediation and modulation of insulin–like activities:emerging concept of diverse functions by irs–associated proteins[J].Frontiers in Endocrinology,2015,6:73.DOI:10.3389/fendo. 2015.00073.
[2] KIM M S,LEE D Y.Insulin–like growth factor (IGF)–I and IGF binding proteins axis in diabetes mellitus[J]. Annals of Pediatric Endocrinology & Metabolism,2015,20(2):69–73.DOI:10.6065/apem.2015.20.2.69.
[3] 胡健,温海深,关健,等.大菱鲆2种类胰岛素样生长因子结合蛋白基因的克隆及其在成鱼和早期发育期中的表达[J].海洋学报(中文版),2012,34(5):139–146.
[4] GUPTA M B.The role and regulation of IGFBP–1 phosphorylation in fetal growth restriction[J].J Cell Commun Signal,2015,9(2):111–123.DOI:10.1007/ s12079–015–0266–x.
[5] UWAIFO G I,Parikh S J,Keil M,et al.Comparison of insulin sensitivity,clearance,and secretion estimates using euglycemic and hyperglycemic clamps in children[J].J Clin Endocrinol Metab,2002,87(6):2899–2905.DOI:10.1210/jcem.87.6.8578.
[6] 陶洋,邹曙明.草鱼胰岛素样生长因子结合蛋白基因的全长cDNA克隆及表达[J].上海海洋大学学报,2011,20(1):15–21.
[7] 丁为群,梁宏伟,邹桂伟,等.鲢基因全长cDNA的克隆及表达分析[J].西北农林科技大学学报(自然科学版),2013,41(5):1–8.
[8] 魏可鹏,俞菊华,李红霞,等.建鲤基因的克隆及与增重相关的SNP位点分析[J].华北农学报,2012,27(3):75–80.DOI:10.3969/j.issn.1000–7091.2012. 03.015.
[9] 钱焜,温海深,迟美丽,等.海产花鲈基因的克隆及表达分析[J].中国海洋大学学报(自然科学版),2014,44(9):37–45.
[10] MEI J,GUI J F.Genetic basis and biotechnological manipulation of sexual dimorphism and sex determina- tion in fish[J].Sci China Life Sci,2015,58(2):124–136. DOI:10.1007/s11427–014–4797–9.
[11] ZOU S,KAMEI H,MODI Z,et al.Zebrafish IGF genes:gene duplication,conservation and divergence,and novel roles in midline and notochord development[J].PLoS ONE,2009,4(9):e7026.DOI:10.1371/journal.pone. 0007026.
[12] GRACEY A Y,TROLL J V,SOMERO G N.Hypoxia– induced gene expression profiling in the euryoxic fish[J].Proc Natl Acad Sci USA,2001,98(4):1993–1998.DOI:10.1073/pnas.98.4.1993.
[13] MAURES T J,DUAN C.Structure,developmental expression,and physiological regulation of zebrafish IGF binding protein–1[J].Endocrinology,2002,143(7):2722–2731.DOI:10.1210/endo.143.7.8905.
[14] KAJIMURA S,AIDA K,DUAN C.Understanding hypoxia–induced gene expression in early development:and in vivo analysis of hypoxia–inducible factor 1–regulated zebra fish insulin–like growth factor binding protein 1 gene expression[J].Mol Cell Biol,2006,26(3):1142–1155.DOI:10.1128/MCB.26.3.1142–1155.2006.
[15] KAMEI H,LU L,JIAO S,et al.Duplication and diversification of the hypoxia–induciblegene in zebrafish[J].PLoS ONE,2008,3(8):e3091.DOI:10.1371/journal.pone.0003091.
[16] RAHMAN M S,THOMAS P.Characterization of three IGFBP mRNAs in Atlantic croaker and their regulation during hypoxic stress:potential mechanisms of their upregulation by hypoxia[J].Am J Physiol Endocrinol Metab,2011,301(4):E637–E648.DOI:10.1152/ajpendo. 00168.2011.
[17] SUN C F,TAO Y,JIANG X Y,et al.IGF binding protein 1 is correlated with hypoxia–induced growth reduce and developmental defects in grass carp () embryos[J].Gen Comp Endocrinol,2011,172(3):409–415.DOI:10.1016/j. ygcen.2011.04.005.
[18] ZHAI W,ZHANG J,SHI Z,et al.Identification and expression analysis ofgene from Japanese flounder ()[J].Comp Biochem Physiol B,Biochem Mol Biol,2012,161(4):413–420. DOI:10.1016/j.cbpb.2012.01.007.
[19] CHEN W,ZHANG Z,DONG H,et al.Insulin–like growth factor–binding protein–1 (IGFBP–1) in goldfish,:molecular cloning,tissue expression,and mRNA expression responses to periprandial changes and cadmium exposure[J].Fish Physiol Biochem,2016,42(3):1043–1052.DOI:10.1007/s10695–015–0195–x.
[20] DUAN C.Specifying the cellular responses to IGF signals:roles of IGF–binding proteins[J].J Endocrinol,2002,175(1):41–54.DOI:10.1677/joe.0.1750041.
[21] SHAW G,KAMEN R.A conserved A U sequence from the 3untranslated region of GM–CSF mRNA mediates selective mRNA degradation[J].Cell,1986,46(5):659–667.DOI:10.1016/0092–8674(86)90341–7.
[22] PEDROSO F L,FUKADA H,MASUMOTO T. Molecular characterization,tissue distribution patterns and nutritional regulation of IGFBP–1,–2,–3 and –5 in yellowtail,[J].Gen Comp Endocrinol,2009,161(3):344–353.DOI:10.1016/j.ygcen.2009.01. 010.
[23] REINECKE M.Influences of the environment on the endocrine and paracrine fish growth hormone–insulin– like growth factor–I system[J].J Fish Biol,2010,76(6):1233–1254.DOI:10.1111/j.1095–8649.2010.02605.x.
[24] 杨慧荣,赵会宏,陈彦珍.胰岛素样生长因子IGF系统与鱼类性腺的研究进展[J].动物学杂志,2013,48(2):306–313.
责任编辑:王赛群
英文编辑:王库
Expression and expression analysis ofgene in yellow catfish ()
LIANG Hongwei1,2, LI Zhong1, LUO Xiangzhong1, ZOU Guiwei1*
(1.Yangtze River Fisheries Research Institute, Chinese Academy of Fishery Sciences, Wuhan 430223, China; 2.Freshwater Aquaculture Collaborative Innovation Center of Hubei Province, Wuhan 430070, China)
To analyze the characteristics of insulin–like growth factor–binding protein 1(), and to reveal its expression pattern in different gender tissues and the expression difference of its protein between male and female muscles, thecDNA was cloned from the. The mRNA expression ofwas studied using florescent quantitative real–time PCR and the protein expression pattern of IGFBP1 was detected using western blot method. The full–length of cDNA ofis 1 259 bp which included a 138 bp complete 5untranslated region (5′ UTR), a 407 bp 3′ UTR and a 714 bp open reading frame (ORF) region which encoded a 237 amino acid of peptides. The results indicated that nucleotide sequences ofwere obvious difference from other species (such as,,,and,etc.)except for, which was identical to Siluriformes ofThe highest abundance expression oftranscript was detected in liver, and mRNA level ofin heart, kidney, muscle and intestine from male was higher than that from female (<0.05). The IGFBP1 protein expression from male was higher than that from female. The results provided data support for further functional investigation ongene in
;; gender differences; heart; kidney; muscle; intestine
10.13331/j.cnki.jhau.2017.03.014
S917.4
A
1007-1032(2017)03-0298-06
2016–09–01
2017–04–20
“十二·五”农村领域国家科技计划项目(2011AA100401);水产种质资源平台项目(2016DKA30470)
梁宏伟(1978—),男,副研究员,博士,主要从事水产动物遗传育种研究,lianghw@yfi.ac.cn;
,邹桂伟,研究员,zougw@yfi.ac.cn
投稿网址:http://xb.hunau.edu.cn
