大鼠脑组织冰冻切片免疫组化漂片法的实验研究
2017-07-01邵敏峰章正祥
邵敏峰 章正祥⋆ 陈 强 邓 玉 程 静 侯 群
·论著·
大鼠脑组织冰冻切片免疫组化漂片法的实验研究
邵敏峰 章正祥⋆ 陈 强 邓 玉 程 静 侯 群
目的 探讨大鼠脑组织冰冻切片免疫组化可行的技术方案,并分析其实验结果。方法 以大鼠下丘脑A11区酪氨酸羟化酶TH为例,应用漂片法进行免疫染色。结果 组织切片完整,染色背景干净,未见非特异染色,TH阳性表达明显,形态正常。结论 应用漂片法对大鼠脑组织进行免疫组化染色,可优化染色效果,提高工作效率。
漂片法 免疫组化 冰冻切片
免疫组织化学(IHC)是常规病理诊断中不可缺少的重要方法,在神经科研中也至关重要。常规免疫组化采用贴片法进行染色,操作步骤中易发生干片,试剂使用量较大,染色组织数量较少,对需要进行大样本量免疫组化染色,此法较为困难。作者应用漂片法对大鼠脑组织冰冻切片进行免疫组化染色,过程中不易干片,试剂使用节约,一次可染色较多数量组织,可大幅提高工作效率,且取得理想的实验效果。2016年5月至6月作者以大鼠下丘脑A11区域酪氨酸羟化酶TH为例,利用冰冻切片免疫组化漂片法进行染色的应用。
1 材料与方法
1.1 实验动物 SPF级SD雄性大鼠,体重250~300g,上海西普尔-必凯实验动物有限公司提供,许可证号码SCXK(沪):2013-0016。浙江中医药大学动物实验中心饲养。
1.2 仪器及主要试剂 内源性过氧化物酶阻断剂(中杉金桥);Triton X-100(美国sigma公司);PBS磷酸缓冲液(石家庄天舜生物);小鼠酪氨酸羟化酶单克隆抗体(美国sigma公司);山羊抗小鼠IgG/HRP聚合物(中杉金桥);浓缩型DAB试剂盒(中杉金桥);恒温冷冻切片机(Thermo Scientific,microm HM 550);OLYMPUS IX71倒置显微镜(日本OLYMPUS)
1.3 方法 (1)取材及固定:大鼠用1%戊巴比妥钠(5ml/kg)麻醉后,开腹夹闭腹主动脉,开胸用灌流针行左心室穿刺,至升主动脉,剪开右心耳,先快速灌注生理盐水200~300ml,至右心耳流出澄清液体,然后灌注4%多聚甲醛磷酸缓冲液200~300ml,先快后慢灌注,至上肢、颈部僵直,即固定完成,灌注后取大鼠脑组织。4℃条件下将脑组织在4%多聚甲醛磷酸缓冲液中再固定24h。(2)脱水及冰冻切片:将脑组织转移至30%蔗糖-PBS液中脱水72h。擦干表面液体,铝箔纸包裹,于液氮中速冻10s左右,存于-80℃冰箱。根据《大鼠脑立体定位图谱》(第6版)对下丘脑A11区进行定位。冰冻切片机连续切片,厚度为30μm,取10张脑片存于盛有PBS液的6孔板中。(3)免疫组化漂片法染色:①脑片收集于0.01M的PBS液后,置于摇床中10min洗去OCT。②将脑片转移至盛有PBS液的12孔板中并吸干液体,加入3%H2O2400μl室温孵育15min,除去内源性过氧化物酶。③PBS液漂洗5min,共3次。④吸干PBS液,加入含有0.3%Triton X-100的PBST液400μl,室温孵育30min。⑤吸干液体,加入TH小鼠抗大鼠单抗(稀释度为1:2000)400μl,置于4°冰箱孵育过夜,共计17h。⑥PBS液漂洗10min,共3次。⑦吸干PBS液,加入辣根酶标记抗鼠IgG 聚合物7滴,37°孵育20min。⑧PBS液漂洗10min,共3次。⑨DAB避光显色5~10min,待肉眼观察到脑片显色出适当程度,及时终止显色。⑩PBS液漂洗5min,共3次。贴片,置于37°鼓风箱10min,烘干组织表面液体。85%、90%、95%、95%、100%、100%乙醇梯度脱水各2min。二甲苯Ⅰ、Ⅱ、Ⅲ各透明2min,中性树胶封片。
2 结果
显微镜下观察(4×10倍和10×10倍),组织切片完整,染色背景干净,染色均匀,未见非特异性染色,TH阳性表达明显,胞浆呈棕黄色,形态呈三角形或多极状,有较长的突起。见图1~3。
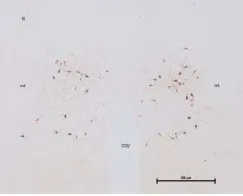
图1 下丘脑A11区酪氨酸羟化酶TH(4×10)

图2 下丘脑A11区酪氨酸羟化酶TH(左侧,10×10)

图3 下丘脑A11区酪氨酸羟化酶TH(右侧,10×10)
3 讨论
免疫组化技术在实验中经常使用,在神经科研中尤其重要。免疫组化染色要根据需要证明的抗原种类,标本中的抗原保存情况,实验的精度要求和实验室的条件来选择最佳的方法,选择原则包括:特异性、敏感性、简便性、安全性、省时省钱[1]。石蜡切片染色处理步骤多,石蜡对组织抗原有破坏作用,相比之下,冰冻切片具有保护抗原不受破坏,简便的优势。贴片法是将冰冻切片后的组织贴于涂有多聚赖氨酸的防脱载玻片上,进行染色的方法。在实际操作过程中,贴片法存在以下缺点:(1)组织容易变干导致蛋白变性,抗原性丧失,表现为不着色或一片棕色,从而干扰实验结果[2]。(2)染色中试剂消耗量较大。(3)每一张载玻片上可贴组织数量较少,如大批量染色比较困难。(4)贴片法在操作过程中易发生脱片。在国外,脑组织冰冻切片漂片法得到广泛应用,Majercikova Z等[3]利用漂片法对下丘脑fos蛋白进行免疫组化染色,取得理想的结果。
作者针对以上缺点,利用冰冻切片漂片法进行免疫组化染色,因脑片在整个染色过程中未脱离液体,不会发生干燥而产生假阳性。12孔板中各孔可同时放入多张脑片进行染色,可大幅提高免疫组化染色效率。染色过程中,加入试剂只需浸没脑片即可,可节省试剂用量。因此,对于需要大批量免疫组化染色,可利用漂片法达到理想的结果。
在操作过程中,作者认为:(1)脑组织冰冻切片前应在-20℃切片机中平衡30min。(2)若用漂片法进行染色,组织切片厚度不应太薄,一般在20~40μm。(3)切片后脑片需要漂洗以洗去溶于PBS液中的OCT。(4)对于是否需要抗原修复有不同看法,一般认为冰冻切片可不需要抗原修复,因冰冻切片较石蜡切片对抗原的破坏程度要小。(5)漂洗应充分,以减少非特异性染色的干扰。(6)漂洗过程中需要转移脑片,作者采用带有100μm网孔底的细胞过滤筛,置于6孔板中,这样可以使在两个6孔板间转移脑片更为便捷[4]。(7)DAB显色时间不宜过长,一般<10min,因阳性物质超过一定时间不会随时间延长而继续增加[5]。(8)贴片时可以将脑片转移至盛满PBS液的小盒中,将防脱载玻片的一端浸入PBS液中,呈30°~45°,液面浸至预贴位置为止,用柔软的毛刷将脑片展开,推动至液面,并尽可能靠近载玻片,脑片的一侧附着在玻片后,将玻片顺势移出液体,脑片可平整贴于载玻片上。(9)采用一步法聚合物检测系统进行免疫组化染色,将二抗抗体分子与酶聚合在一起,直接放大抗原抗体结合的信号,不涉及生物素,可减少操作过程。
综上所述,应用漂片法对大鼠脑组织进行免疫组化染色,可优化染色效果,提高工作效率,尤其适用于大批量进行脑片的免疫染色,其中的应用条件还需要各个实验室的不断探索。
[1] 孟庆媛, 刘东璞, 郭梦凡, 等. 免疫组织化学染色技术实际应用体会. 黑龙江医药科学, 2006, 1:82-83.
[2] 宋容. 免疫组织化学染色技术的应用体会. 重庆医学, 2007, 22: 2331-2332.
[3] Majercikova Z, van Weering H, Scsukova S, et al. A new approach of light microscopic immunohistochemical triple-staining: combination of Fos labeling with diaminobenzidine-nickel and neuropeptides labeled with Alexa488 and Alexa555 fluorescent dyes. Endocrine Regulations, 2012(46): 217-223.
[4] Bachman J. Immunohistochemistry on freely floating fixed tissue sections. Methods Enzymol, 2013, 533: 207-15.
[5] 巴迎春, 王廷华, 李明. 用免疫组化ABC法的漂片法做好脑片实验的体会. 四川解剖学杂志, 2006, 1: 58-59.
Objective To introduce a feasible technical scheme of rat's frozen brain section for immunohistochemical staining,and to evulate the outcome. Methods Rat's tyrosine hydroxylase(TH)in hypothalamus A11 area was taken as example,used floating-frozen section immunostaining. Results Tissue section was complete,dyeing background was clean,without nonspecif i c staining,TH positive expression with normal form was obvious. Conclusion Using free fl oating staining of rat's brain tissue is benef i cial to optimize staining quality and improve the work eff i ciency.
Bleaching method IHC Frozen section
国家自然科学基金资助项目(81302938);浙江省中医药优秀青年人才基金计划(2013ZQ015);2011年度浙江中医药大学科研基金人才专项项目;2017年浙江省医药卫生科研基金项目(2017KY118,2017KY509),2017年度浙江省中医药科学研究基金项目(2017ZA047)
310053 浙江中医药大学第一临床医学院(邵敏峰 邓玉 程静)310006 浙江中医药大学附属第一医院(章正祥 陈强侯群)
*通信作者
