容积生长率与倍增时间在肺小结节鉴别诊断中的应用研究
2017-07-01叶剑锋许茂盛喻迎星孙志超任聪聪郑思思
叶剑锋 许茂盛⋆ 喻迎星 孙志超 任聪聪 郑思思
容积生长率与倍增时间在肺小结节鉴别诊断中的应用研究
叶剑锋 许茂盛⋆ 喻迎星 孙志超 任聪聪 郑思思
目的 比较肺小结节三维动态生长指标容积生长率与倍增时间的评价能力,探讨容积生长率作为判别结节良恶性的评价指标的可靠性。方法 回顾性分析经病理检查证实的肺部小结节患者36例,其中男15例,女21例;年龄32~83岁,平均年龄(61±10.7)岁。所有患者均行≥2次肺部CT薄层平扫,图像重建层厚0.75mm。采用肺结节三维分析软件VCAR进行结节容积测量,计算容积生长率与倍增时间值。通过受试者工作特征曲线评价其诊断准确性。结果 36例结节直径3~19mm,平均直径(7.3±3.3)mm。恶性结节(恶性组)20例,其中腺癌19例、小细胞癌1例;良性结节(良性组)16例,其中错构瘤1例、慢性炎性肉芽肿性病变15例。共122次CT检查,平均3.4次。经VCAR测算2次检查间结节容积,各获得80个生长率和倍增时间值。容积生长率(%/年):良性组(-44.8±49.90),恶性组(86.1±54.01)(t=2.10,P=0.038);倍增时间:良性组(2071.7±2932.61)d,恶性组(543.8±1482.32)d(t=2.09,P=0.040)。容积生长率曲线下面积为0.706,倍增时间曲线下面积为0.701,两者差异无统计学意义(z=-0.064,P=1.051)。结论 容积生长率与倍增时间均可以作为评价小结节生长的手段,但容积生长率更具有优势。
肺小结节 容积生长率 倍增时间 肺癌
随着胸部CT的常规应用和低剂量CT肺癌筛查的开展,检出肺结节越来越小,且缺乏形态学特征,病灶的动态变化成为结节管理的重要参数。直径是肺小结节评估的常用方法 ,但因结节较小常不敏感。利用计算机辅助技术三维容积测量可显著提高肺结节观察的准确性[1]。较多研究针对容积倍增时间(VBT),用以评价肿瘤生长性。而Ko等[2]研究认为生长率更加适合评价结节的容积变化,且可缩短明确诊断的时间。本文回顾性分析肺小结节患者肺部CT薄层平扫影像资料,探讨容积生长率作为判别结节良恶性评价指标的可靠性。
1 临床资料
1.1 一般资料 选择2013年6月至2015年5月本院医学影像科行肺部CT检查患者36例,男15例,女21例;年龄32~83岁,平均年龄(61±10.7)岁。结节直径3~19mm,平均直径(7.3±3.3)mm。纳入标准:(1)非钙化肺小结节,直径≤20mm。(2)检查次数≥2次,并在图像数据资料库中存有0.75mm薄层图像。(3)所有患者均经病理检查证实。排除标准:(1)钙化、空洞结节。(2)软件无法识别分割结节。(3)图像存在伪影干扰。(4)诊断不明确。将入组肺结节分为恶性组与良性组。
1.2 方法 (1)CT图像采集:采用德国Siemens Sensation 64层螺旋CT扫描仪。患者一次平静吸气后屏气完成全肺扫描,扫描范围为胸廓入口至横膈(两侧肋膈角水平)。扫描参数为:管电压120kVp,管电流量120mAs,旋转速度0.33s/圈,螺距1.2,准直0.6mm×64,矩阵512×512,常规层厚5mm重建,滤过B70f(肺窗观察)、B30f(纵隔窗观察);用于肺小结节分析薄层重建层厚为0.75mm,滤过B30f。(2)图像后处理:由一名工作经验>5年的影像科医师经过培训后,在GE AW2.0工作平台上,利用VCAR软件进行结节容积三维测量,得到容积数据、经线数值等(见图1)。(3)生长率及倍增时间的计算方法 生长率的计算公式如下:GR=(V2-V1)/V1(T2-T1)×100%,其中V1、V2代表前后两次所测容积,T2-T1代表前后两次检查间隔时间。倍增时间的计算公式:DT=(T2-T1)×log 2/log(V2/V1)。
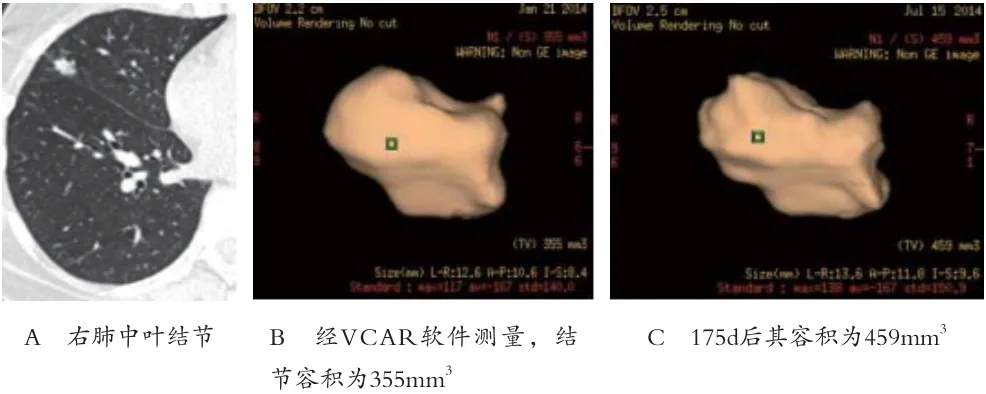
图1 肺小结节容积CT测量
1.3 统计学方法 采用SPSS 17.0统计软件。计量资料采用独立样本t检验;计数资料采用Pearsonχ2检验,当<1时采用Fisher确切概率法,采用受试者工作特征曲线(ROC)分析容积生长率与倍增时间的诊断效能,以P<0.05为差异有统计学意义。
2 结果
36例肺小结节,恶性结节20例,其中腺癌19例,小细胞癌1例;良性结节16例,其中错构瘤1例,慢性炎性肉芽肿性病变15例。恶性组小结节容积90~3455mm3,平均(962.29±1298.32)mm3;良性组12~1584mm3,平均(138.47±297.35)mm3。共122次CT检查,平均3.4次/例。经VCAR测算2次检查间结节容积,各获得80个生长率和倍增时间值。容积生长率(%/年):良性组(-44.8±49.90)%,恶性组(86.1±54.01)%(t=2.10,P=0.038);倍增时间:良性组(2071.7±2932.61)d,恶性组(543.8±1482.32)d(t=2.09,P=0.040),两种评价方法比较差异均有统计学意义(P<0.05)。容积生长率ROC曲线下面积为0.706,倍增时间曲线下面积为0.701,两者比较差异无统计学意义(z=-0.064 P=1.051),见图2、表1。恶性组中CT检查次数<3次 11例;检查次数≥3次 9例,其中6例为非同次发现异常,均为容积生长率早于倍增时间发现,通过生长率诊断异常(与首次检查时间差值)均值(178.0±75.30)d,通过倍增时间为(329.0±128.20)d,两者时间差值(151.6±84.23)d。
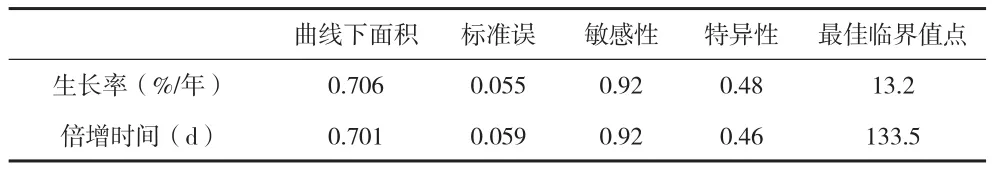
表1 容积生长率与倍增时间比较
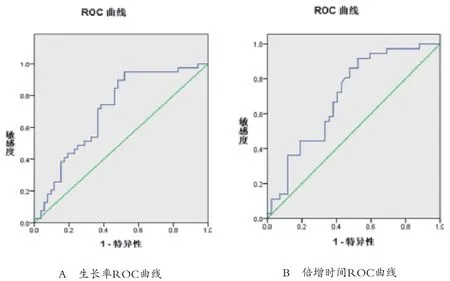
图2 生长率与倍增时间ROC曲线
3 讨论
肺癌的患病率和病死率在所有恶性肿瘤中目前均居首位[3]。中晚期肺癌的5年生存率较低,但最新研究显示,早期阶段如原位癌(AIS)及微侵袭腺癌(MIA)若接受根治性手术,则其5年无病生存率可为100%或接近100%[4]。
在既往研究中,将结节依据其密度的不同分为磨玻璃样结节、部分实性结节及实性结节,且通过其倍增时间推断其病理类型[5]。但其依据的是观测者的主观评判。特别是对于结节的大小测量是通过手动获得,这就使得测量结果的客观性及可重复性存在较大的局限性。近年来,Yankelevitz 等[6]指出,通过CT三维重建测量结节的方法对结节体积的增长变化非常敏感,且容积误差<3%。采用体积测定法评价肿瘤倍增时间的临床研究也取得一定进展,对肺实性结节应用的准确性和可靠性也得到初步认可[7-8]。Kostis 等[9]确认自动分析软件测定结节大小的准确性和可重复性。本资料中所有结节均使用GE-AW工作站的ALA软件获得容积等相关数据,保证相关数据的客观性及可靠性。
通过对软件分割模式的调整,其也能对一部分磨玻璃结节进行识别测量。因此,对于软件而言,结节有两类,可识别及不可识别结节。本研究讨论能利用软件进行分割识别的结节,而对于无法分割及识别的结节,需由传统的手动二维或三维测量进行相关的比较,从而对软件测量体积并比较其变化进行补充。
本资料中恶性组小结节平均体积962.29mm3,良性组138.47mm3。恶性组体积比良性组大,推测其主要原因:(1)根据fieischeiner学会等组织[10]及中国专家的推荐,当体积较大者接受手术的几率较大,因此,在一次检查后即接受手术治疗。这就使长期随访者以小体积者居多。(2)恶性结节的体积是呈正生长,且恶性程度高、生长速度快,而良性结节生长速度慢,且部分呈负增长。
结节体积变化是判断结节良恶性的一个重要特征,倍增时间与容积生长率均是评价这一特征的指标,但前者较后者得到更加广泛的应用。本资料中,两种评价方法的ROC曲线下面积及最佳临界值点的敏感性与特异性及标准误基本一致。表明两者具有相似的诊断效能。但两者仅达中等诊断效能,表明容积变化作为小结节的良恶性诊断单一标准,存在一定的局限性,仍需结合其他诸如密度变化等特征,从而进一步提高鉴别能力。例如,近年来Hoop等[11]学者提出的质量(mass)的概念,认为质量对小结节良恶性的鉴别比单纯的容积变化更有提示作用。良性组中有4次检查因与前次检查比较体积无变化,倍增时间数据无限大,不具备合理性,在统计过程中予以剔除,这也体现出倍增时间法在分析中的缺陷,而容积生长率法却能较好的克服这个缺陷。两种方法也存在共同的缺陷。当小结节初始体积较小,再次检查时只要有体积上的改变,即使绝对值较小,但其相对值均较大,从而影响结果的可靠性。
[1] Tsunezuka Y, Shimizu Y, Tanaka N, et al: Positron emission tomography in relation to Noguchi's classification for diagnosis of peripheral non-small-cell lung cancer 2 cm or less in size. World journal of surgery 2007, 31(2): 314-317. 2
[2] Ko JP, Berman EJ, Kaur M, et al: Pulmonary Nodules: growth rate assessment in patients by using serial CT and three-dimensional volumetry. Radiology 2012, 262(2): 662-671.
[3] Torre LA, Bray F, Siegel RL, et al: Global cancer statistics, 2012. CA: a cancer journal for clinicians 2015, 65(2): 87-108.
[4] Naidich DP, Bankier AA, MacMahon H, et al: Recommendations for the management of subsolid pulmonary nodules detected at CT: a statement from the Fleischner Society. Radiology 2013, 266(1): 304-317.
[5] Quint LE, Cheng J, Schipper M, et al: Lung lesion doubling times: values and variability based on method of volume determination. Clinical radiology 2008, 63(1): 41-48.
[6] Yankelevitz DF, Reeves AP, Kostis WJ, et al: Small pulmonary nodules: volumetrically determined growth rates based on CT evaluation. Radiology 2000, 217(1): 251-256.
[7] Rampinelli C, De Fiori E, Raimondi S, et al: In vivo repeatability of automated volume calculations of small pulmonary nodules with CT. AJR American journal of roentge nology 2009, 192(6): 1657-1661.
[8] 周科峰, 朱斌, 杨留发, 等. ALA软件测定倍增时间在肺结节随访中的应用. 医学影像学杂志 2008(10): 1124-1127.
[9] Kostis WJ, Yankelevitz DF, Reeves AP, et al: Small pulmonary nodules: reproducibility of three-dimensional volumetric measurement and estimation of time to follow-up CT. Radiology 2004, 231(2): 446-452.
[10] Godoy MC, Truong MT, Sabloff B, et al: Subsolid pulmonary nodule management and lung adenocarcinoma classification: state of the art and future trends. Seminars in roentgenology 2013, 48(4): 295-307.
[11] de Hoop B, Gietema H, van de Vorst S, et al: Pulmonary groundglass nodules: increase in mass as an early indicator of growth. Radiology 2010, 255(1): 199-206.
Objective To compare the predictive value of the growth rate and doubling time in the evaluation of small pulmonary nodules,and to assess the reliability of the growth rate in the differential diagnosis of benign and malignancy. Methods Thirty-six patients(15 males,21 females)with pathological conf i rmed small lung nodules(diameter range 3–19(mean:7.3±3.3mm))were enrolled in this retrospective study. The age range was from 32 to 83 years with a mean of 61±10.7 years. Every patient underwent two or more CT scans,and the image rec onstruction thickness was 0.75 mm. The volume of each nodule was computed by VCAR,a pulmonary nodules 3D analysis sof tware,then calculated volume growth rate and the doubling time value. The diagnostic accuracy was assessed by the receiver-operating characteristic curve(ROC). Results Thirty-six pulmonary nodules(20 malignant,16 benign)included 19 cases of lung adenocarcinoma,1 case each of small cell lung cancer and pulmonary hamartoma,and 15 cases of chronic inf l ammatory granuloma lesions. A total of 122 CT examinations,with an average of 3.4 examinations per patient,were identif i ed for volumetric analysis. There were 80 values of growth rates and double time though measuring nodule volume by VCAR between two examinations. Values of growth rates(% / year):the benign group(mean,44.8±-49.90[standard deviation])and malignant group(86.1±54.01)(t=2.10,P=0.038).Doubling time(days):the benign group(2071.7±-2932.61)and malignant group(543.8±1482.32)(t=2.09,P=0.040). Area under the curve of volume growth rate and doubling time were 0.706 and 0.701,respectively(z=0.064,P=1.051;there was no signif i ca nt difference). Conclusion Growth rate and doubling time can predict growth rates of nodules,but growth rate has more value on the differential diagnosis of small nodules.
Small pulmonary nodule Growth rate Doubling time Lung cancer
310006 浙江中医药大学附属第一医院
*通信作者
