一种同系异体异位心脏与皮瓣同期移植小鼠模型的建立
2017-07-01刘士强丁健科张栋梁陈晨陈建武庄然苏映军郭树忠
刘士强 丁健科 张栋梁 陈晨 陈建武 庄然 苏映军 郭树忠
一种同系异体异位心脏与皮瓣同期移植小鼠模型的建立
刘士强1丁健科1张栋梁1陈晨1陈建武1庄然2苏映军1郭树忠1
目的 构建一种简单可靠的同期心脏联合皮瓣移植小鼠模型,探讨复合组织与内脏器官联合移植后可能存在的相互影响。方法 取供体C57小鼠心脏及腹股沟皮瓣移植至受体C57小鼠颈部。获取供体心脏血管蒂主动脉时,保留其右侧颈总动脉分支,供体心脏主动脉与肺动脉分别与受体C57小鼠右侧颈总动脉和颈外静脉连接;获取供体腹股沟皮瓣的营养血管分别与供体心脏的右侧颈总动脉及受体左侧颈总静脉相连,即将供体颈总动脉作为血管桥,连接供体心脏与皮瓣。术后每天观察、记录皮瓣与心脏的存活情况,最后行组织病理学检查。结果 同系移植物存活时间大于100 d。平均手术时间为(193.6± 7.8)min,其中心脏热缺血时间为(14.4±1.7)min,皮瓣热缺血时间为(28.0±4.2)min。术后第100天,组织学检查显示,心肌、皮瓣组织细胞完好,无炎症细胞浸润。结论 我们成功地构建了一种简便可靠的同期小鼠心脏联合皮瓣移植模型,可用于复合组织与内脏器官联合移植的相关实验研究。
复合组织移植;内脏器官移植;Cuff套管;血管桥;小鼠模型
内脏器官移植(solid organ transplantation,SOT)作为治疗终末器官衰竭的有效手段已经得到广泛应用。但由于创伤、感染、肿瘤等原因,部分患者移植术后创面难以闭合[1]。近年来,复合组织移植(composite tissue allotransplantation,CTA)在创面覆盖、功能外观修复中取得了良好的效果[2-4]。SOT的患者同期行CTA修复难以闭合创面作为一种新的有效方法,已经得到了临床验证[4-8]。然而内脏器官与复合组织联合移植后在免疫排斥反应中的相互影响尚不清楚,且缺乏合适的动物模型进行相应的研究。因此,自2015年12月至2016年6月,我们建立小鼠心脏联合皮瓣同期移植模型,用于开展相关的研究。
1 实验材料
雄性C57BL/6(H-2b)健康小鼠13只,6~12周龄,体质量为21~25 g,购自第四军医大学实验动物中心,饲养于清洁级动物饲养室。本实验经第四军医大学动物实验伦理委员会批准。
2 实验方法
2.1 实验分组
实验分为两组:解剖组(n=8)。3只小鼠进行心脏、皮瓣及颈部受区解剖探查;5只小鼠分离并结扎双侧颈外静脉及右侧颈总动脉,术后观察小鼠的存活状态。同系移植组(n=5)。小鼠间行同系心脏联合皮瓣移植,术后观察皮瓣、心脏存活状态,术后100 d对移植物行病理学检查。
2.2 手术过程
本实验由单人操作,手术过程中小动物恒温电热毯保持术区37℃,采用戊巴比妥(60 mg/kg)腹腔注射麻醉,术中必要时追加1/4初始麻醉剂量。受体术前腹腔注射0.3 ml林格液,术后腹腔注射0.2 m l葡萄糖生理盐水溶液,以补充术中水分丢失和能量损耗。
2.2.1 解剖组 实验动物麻醉后,剔除颈部毛发,标记0.7 cm×1.0 cm矩形术区。取仰卧位,固定后碘伏消毒术区,沿标记线剪开矩形术区皮肤,分离皮下组织,保留矩形术区左侧皮肤软组织,掀开形成的带蒂皮瓣,剪除部分舌下腺,分离右侧颈外静脉、颈总动脉并结扎,同时分离对侧颈外静脉并结扎。颈外静脉结扎点为近心端靠近锁骨的主干处,手术过程中尽量减少静脉分支的损伤。结扎完毕后旷置创面,间断以生理盐水湿润,1 h后原位缝合带蒂皮瓣。术毕,待动物苏醒后送饲养笼观察。
2.2.2 同系移植组 供体腹股沟皮瓣的获取:麻醉后,一侧腹股沟区剔除毛发,标记1.2 cm×1.5 cm矩形术区。取仰卧位,固定后碘伏消毒术区,沿标记线剪开皮肤、皮下组织,掀起皮瓣,显露股动静脉。分离股动静脉,于腹股沟韧带处、腹壁浅动静脉分支远心端结扎并离断股血管,取下皮瓣[9]。套管方法[10]:将股动脉穿过26 G套管,使管壁外翻包裹套管后,用11-0尼龙线环绕1周固定;股静脉则使用24 G套管以同样的方法固定,将皮瓣置于4℃生理盐水保存(图1a)。供体心脏的获取[11]:腹股沟皮瓣取下后剪开小鼠腹壁,显露腹部下腔静脉,注入0.4 ml肝素盐水(50 IU),1 min后剪开血管使血液流出;剪开膈肌与胸骨两侧肋骨并掀起,打开胸腔,切除胸腺,结扎并离断左侧上腔静脉;剪开右侧上腔静脉及下腔静脉远端使血液流出,30 G针头刺入胸主动脉,注入4℃生理盐水3.0 ml进行灌注;然后分离右侧颈总动脉至分叉处,结扎并离断右侧锁骨下动脉,在左侧颈总动脉分支水平离断主动脉干,这样可使心脏主动脉保留右侧颈总动脉分支(图1b)。先后结扎并剪断右侧上腔及下腔静脉。尽可能分离肺动脉主干,并在远端离断,最后完全结扎肺静脉,取下心脏置入4℃生理盐水中保存。
受体麻醉后,剔除颈部毛发,标记0.7 cm×1.0 cm术区。取仰卧位,消毒后剪开皮肤、皮下组织,去除部分右侧舌下腺及胸锁乳突肌,分离右侧颈外静脉、颈总动脉(图1c),近心端分别以血管夹夹毕后使用22 G、26 G套管,受体心脏并不摘除;取出供体心脏,将受体颈总动脉连接心脏主动脉,受体颈外静脉连接心脏肺动脉,将供体心脏保留的颈总动脉分支使用血管夹夹毕,然后使心脏恢复血供;分离受体左侧颈外静脉,近心端夹毕。取出供体皮瓣,股动脉与供体颈总动脉连接,股静脉与受体颈外静脉连接,松开血管夹,恢复皮瓣血供(图1d)。调整并固定心脏位置,固定血管蒂,缝合皮瓣。
2.3 大体观察
解剖组术后每天观察小鼠活动状态是否异常,是否存在偏瘫或活动减少,毛发是否光亮整齐,头面部是否水肿,每日测量体质量变化。同系移植组术后每天观察皮瓣颜色的改变以及心脏跳动情况,触摸皮瓣质地和心脏跳动强度,判断是否出现淤血、缺血坏死、血肿、感染等并发症。
2.4 组织学检查
术后第100天,取移植组供体皮瓣及心脏,置于10%甲醛溶液固定24 h后,储存于70%乙醇溶液,石蜡包埋后切片(4μm),HE染色后观察。
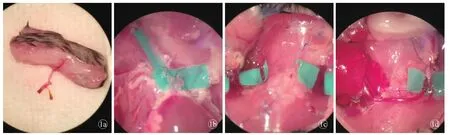
图1 同系移植组术中 a.已经套管完毕的供体腹股沟皮瓣 b.分离出颈总动脉分支的供体心脏 c.受体双侧颈外静脉及右侧颈总动脉 d.移植至受体的心脏及皮瓣移植物
3 结果
3.1 解剖组观察
单纯心脏移植模型中,心脏血管蒂主动脉长度较短,不保留任何分支,经过解剖组的研究发现,适当延长主动脉长度,保留右侧颈总动脉,可为移植心脏供血的同时通过血管分支为其他器官供血。双侧颈总动脉由血管蒂长,管壁较厚,口径与腹股沟皮瓣血管蒂股动脉匹配,非常适合作为血管桥。右侧颈总动脉较左侧颈总动脉可缩短心脏血管蒂长度,且与主动脉角度合适,减少心脏移植后蒂扭转,且移植受体分支处后不易返折,右侧颈总动脉更适合作为血管桥(图2)。C57小鼠结扎双侧颈外静脉及右侧颈总动脉,术后无异常改变,观察4周发现小鼠状态良好、活动自如、反应敏捷、毛发光亮整齐;未出现偏瘫、行走障碍,面部浮肿。术后1周内体质量降低10%左右,随后逐渐回升。
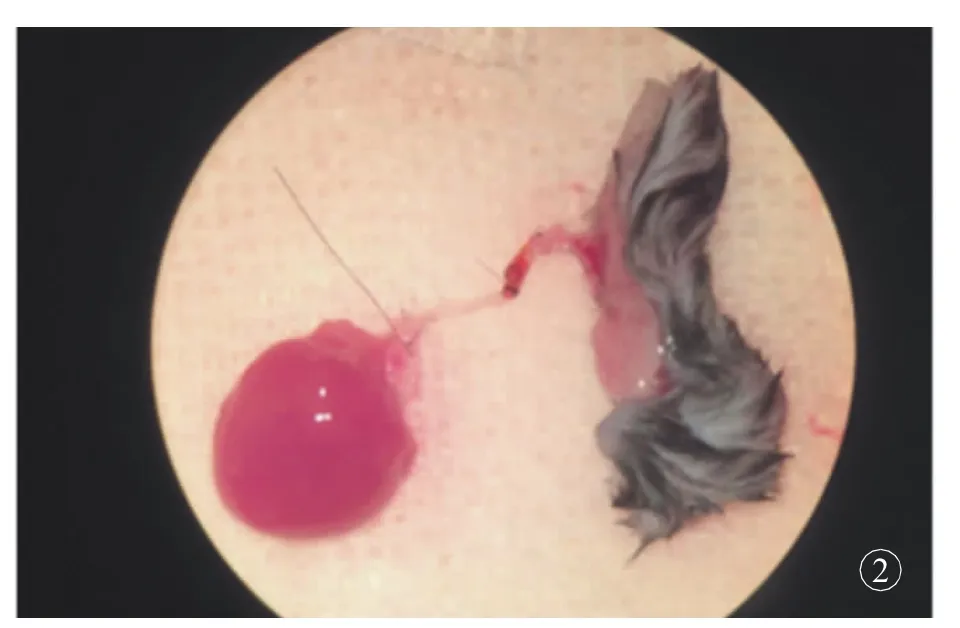
图2 供体心脏与皮瓣通过颈总动脉连接示意
3.2 同系移植组手术时间及器官缺血时间
同系移植组平均手术时间为(193.6±7.8)min,其中受体手术时间为(87.6±6.3)min。心脏热缺血时间(打开供体胸腔至心脏灌注4℃保存液之间和从4℃保存液取出与受体连接至恢复血供的时间)为(14.4±1.7)min。供体皮瓣热缺血时间为(28.0± 4.2)min。通过使用供体血管桥连接心脏皮瓣,避免了分离更多的受体血管,以及使用简便的Cuff血管吻合方法,缩短了受体手术时间;如果2名实验者分别实施供体与受体手术,则手术时间及器官缺血时间可进一步缩短。
3.3 同系移植物大体观察及组织病理学检查
由于实验前进行了大量的探索与改进,同系移植组存活率为100%,仅1例术后第2天出现伤口裂开,立即予以缝合后逐渐愈合。术后100 d持续观察,皮瓣颜色红润,随时间推移,肿胀逐渐消失,重新生长出的毛发与周围方向不一致,心脏搏动规律有力。由于Cuff技术的应用,术后血管吻合处未发生出血、栓塞;移植物在受体颈部,避免了术后受体对移植物的撕咬;受体未发现感染、无毛发脱落、表皮脱屑、溃疡形成等并发症发生。与解剖组相似,术后1周内受体的体质量降低10%左右,随后逐渐回升。术后第100天,病理显示皮瓣组织结构完整,心肌细胞完好,无明显炎症细胞浸润(图3)。
4 讨论
自从第1例手移植和颜面移植后,CTA取得了令人鼓舞的修复效果[12-13],但长期服用免疫抑制剂所带来的不良反应,如感染、肿瘤、代谢紊乱等限制了其广泛应用[14]。SOT联合应用CTA覆盖难以闭合的创面被认为是拯救生命所必须,小肠、肝脏等器官联合CTA已成功应用于临床[15]。但是,内脏器官与复合组织在免疫学中相互影响及分离排斥等问题仍待研究,因此,必须构建复合组织与内脏器官联合移植的动物模型。
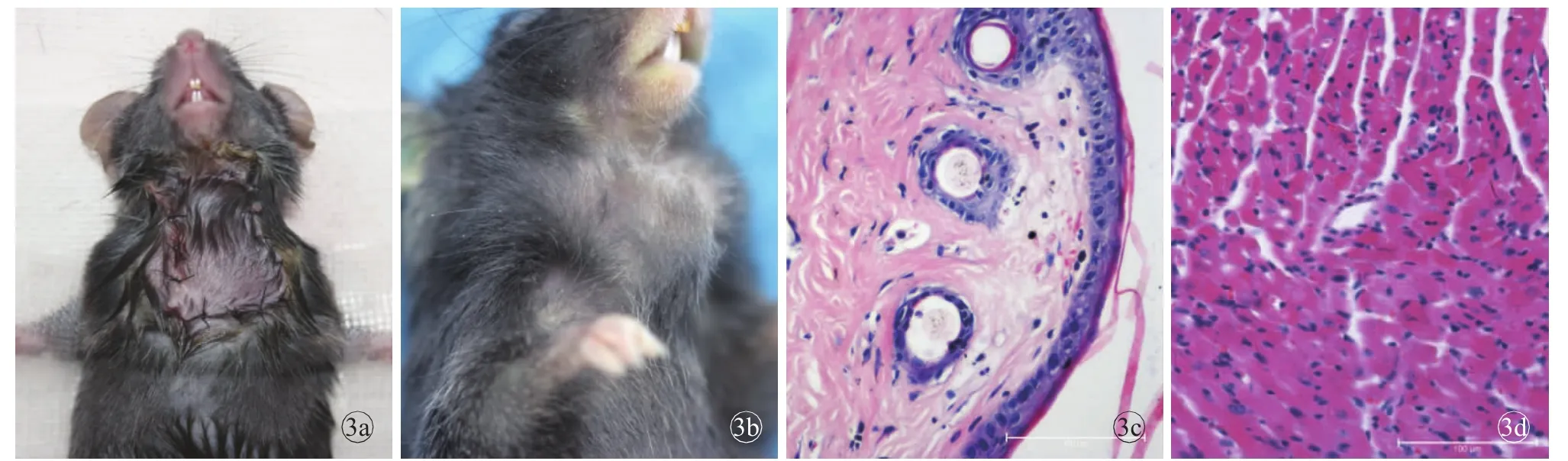
图3 同系移植物术后大体及组织病理学检查结果 a.术后即时 b.术后100 d c.皮瓣组织结构完整,界限清晰(HE×200)d.心肌细胞完好,无明显炎症细胞浸润(HE×200)
同时移植多个器官手术难度较大,且操作时间长,创伤较大,实验动物很难耐受,相关模型鲜有报道。Yang等[16]首先报道了心脏与复合组织联合移植模型,但其实验动物为大鼠,并且在移植心脏后10 d再次手术移植复合组织,操作过程较复杂,占用了颈部与腹股沟两处术区。相比大鼠,我们使用的小鼠模型具有基因背景清楚,转基因、敲除品系广泛,各类抗体制剂、分子探针种类繁多,其H2抗原系统与人类MHC相近,成本低廉,易饲养等优势,而且将心脏与复合组织同期移植在颈部一处术区,减轻了创伤,简化了手术流程。Oh等[17]构建了小鼠心脏联合胸腺、胸骨CTA模型,用于研究含血管化骨髓的复合组织(vascularized bone morrow transplantation, VBMT)及胸腺诱导同种异体移植免疫耐受的实验研究,但胸骨胸腺组成的复合组织与心脏串联,血液回流必须通过心脏。我们的模型是利用心脏血管蒂的分支作为血管桥为复合组织供血,血液回流分别经过受体双侧颈外静脉,从而使两器官并联连接,为研究免疫学问题减少了解剖上的相互影响。
术中只需剥离近锁骨颈外静脉主干,减少其余静脉分支损伤,避免静脉回流障碍造成的面部肿胀;由于右侧舌下腺必须切除以容纳供体心脏,还应减少对侧舌下腺损伤以防小鼠术后饮食减少,造成体质量减轻;移植物血管蒂较长,血管吻合完毕后应按照血管走行方向进行固定,防止血管返折。NKamada和RYCalne报道的Cuff血管吻合技术虽然缩短了血管吻合时间,降低了手术难度,但由于小鼠血管口径较细,管壁很薄,本模型对显微外科操作水平有较高的要求。此外,本模型采用异位移植的心脏,只进行营养血管的吻合,并无射血功能,在血流灌注上与原位心脏存在部分差异。按本手术方式,亦可用其他复合组织如肌皮瓣、骨肌皮瓣、VBMT等替代皮瓣,与心脏同期移植,可进一步进行尝试。
我们成功地构建了小鼠心脏联合皮瓣同期移植模型,具有诸多特点:⑴使用Cuff血管吻合技术,降低吻合难度;⑵仅行1次手术,颈部1处受区,减少创伤;⑶皮瓣可由其他复合组织代替使模型多样化。本模型将促进复合组织与内脏器官联合移植后相互影响的研究,还可用于内脏、复合组织分离排斥研究的相关实验,并利于新的免疫治疗策略的开发。
[1] Zanfi C,Cescon M,Lauro A,et al.Incidence and management of abdominal closure-related complications in adult intestinal transplantation[J].Transplantation,2008,85(11):1607-1609.
[2] Sosin M,Rodriguez ED.The Face Transplantation Update:2016 [J].Plast Reconstr Surg,2016,137(6):1841-1850.
[3] Shores JT,Brandacher G,Lee WP.Hand and Upper Extremity Transplantation:An Update of Outcomes in the Worldwide Experience[J].Plast Reconstr Surg,2015,135(2):351e-360e.
[4] Levi DM,Tzakis AG,Kato T,et al.Transplantation of the abdominal wall[J].Lancet,2003,361(9376):2173-2176.
[5] Cipriani R,Contedini F,Santoli M,et al.Abdominal wall transplantation with microsurgical technique[J].Am J Transplant,2007,7(5): 1304-1307.
[6] Ravindra KV,Martin AE,Vikraman DS,et al.Use of vascularized posterior rectus sheath allograft in pediatric multivisceral transplantation--report of two cases[J].Am J Transplant,2012,12 (8):2242-2246.
[7] Giele H,Bendon C,Reddy S,et al.Remote revascularization of abdominal wall transplants using the forearm[J].Am J Transplant, 2014,14(6):1410-1416.
[8] Selber JC,Chang EI,Clemens MW,et al.Simultaneous scalp, skull,kidney,and pancreas transplant from a single donor[J]. Plast Reconstr Surg,2016,137(6):1851-1861.
[9] DunnRM,Mancoll J.Flapmodelsin the rat:a review and reappraisal [J].Plast Reconstr Surg,1992,90(2):319-328.
[10] SucherR,Lin CH,Zanoun R,etal.Mousehind limb transplantation: a new composite tissue allotransplantation model using nonsuture supermicrosurgery[J].Transplantation,2010,90(12):1374-1380.
[11] Ratschiller T,Deutsch MA,Calzada-Wack J,et al.Heterotopic Cervical Heart Transplantation in Mice[J].J Vis Exp,2015,25 (102):e52907.
[12] Dubernard JM,Owen E,Herzberg G,et al.Human hand allograft: report on first 6 months[J].Lancet,1999,353(9161):1315-1320.
[13] Devauchelle B,Badet L,Lengelé B,et al.First human face allograft:early report[J].Lancet,2006,368(9531):203-209.
[14] Morelon E,Petruzzo P.Vascularized composite allotransplantation still remains an emerging field after 17 years[J].Curr Opin Organ Transplant,2015,20(6):593-595.
[15] Giele H,Vaidya A,Reddy S,et al.Current state of abdominal wall transplantation[J].Curr Opin Organ Transplant,2016,21(2):159-164.
[16] Yang J,Erdmann D,Chang JC,et al.A Model of Sequential Heart and Composite Tissue Allotransplant in Rats[J].Plast Reconstr Surg,2010,126(1):80-86.
[17] Oh B,Furtmüller GJ,Sosin M,et al.A novel microsurgical model for heterotopic,en bloc chest wall,thymus,and heart transplantation in mice[J].J Vis Exp,2016,(107):e53442.
Establishment of a simultaneous transplantation mouse model of allogeneic heterotopic heart and skin flap
LIU Shi-qiang,DING Jian-ke,ZHANG Dong-liang,CHEN Chen,CHEN Jian-wu,ZHUANG Ran,SU Ying-jun,GUO Shu-zhong. (Department of Plastic Surgery,Xijing Hospital,Xi′an 710032,China)
ObjectiveWe aimed to develop a model ofconcomitant heart and composite tissue transplant in mice,which could be used to compare the possible surgical results.MethodsIsograft transplants were performed among C57BL/6 mice.The donor's heart was harvested with the right common carotid artery,then the aorta and pulmonary arterywere anastomosed to the recipient's right common carotid arteryand external jugular vein,and the donor's abdominal flap vessels were connected to the donor's rightcommon carotid arteryand recipient's leftexternal jugular vein,respectively.Heart viabilitywas assessed by daily palpation,and the skin flap was observed every day.Finally, the grafts were assessed histologically.ResultsIndefinite allograft survival(>100 days)was achieved in the isograft transplant group.The mean totaloperative timewas(193.6±7.8)minuteswith theaveragewarm ischemia timeofheartand skin flap was(14.4±1.7)minutes and (28.0±4.2)minutes,respectively.Histologic examination displayed viable grafts withoutnecrosis or fibrosis.ConclusionWe succeeded in developing a technically feasible and reliable model of simultaneous heart and composite tissue transplant in mice which may be used in the research ofmutual immunologic influence and split rejection between composite tissue and solid organ.
Composite tissue allotransplantation;Solid organ transplantation;Cuff technique;Vessel bridge;Mice model
GUO Shu-zhong,Email:shuzhong@fmmu.edu.cn
2016-10-06)
10.3969/j.issn.1673-7040.2017.03.013.
10.3969/j.issn.1673-7040.2017.03.013
国家自然科学基金(30830102)
1.第四军医大学西京医院 全军整形外科研究所,陕西 西安 710032;2.第四军医大学 基础部免疫教研室,陕西 西安 710032
郭树忠,Email:shuzhong@fmmu.edu.cn
本文引用格式:刘士强,丁健科,张栋梁,等.一种同系异体异位心脏与皮瓣同期移植小鼠模型的建立[J].中国美容整形外科杂志,2017, 28(3):166-169.
