重金属处理下萱草的富集能力和生理生态响应
2017-06-30梁明霞郭英何云晓陈娟
梁明霞+郭英+何云晓+陈娟
摘要:为了城乡地区的美化和土壤的长期净化,观赏园艺植物的生物修复潜力日益受到关注。通过盆栽试验,观测观赏园艺植物萱草(Hemerocallis citrine Baroni)的2个主要栽培種猛子花和白花,对不同重金属处理的生理生态响应和生物富集能力,探讨萱草对重金属污染土壤的净化和修复潜力。结果表明,2个栽培种均对镉、锰、铜处理有良好的耐受性和富集能力。镉、锰和铜不同程度地影响了萱草的生长和生理过程。在所有重金属处理中,镉处理表现出比铜和锰更大的负面效应。研究表明,萱草的2个栽培种猛子花和白花均可用于富集重金属,同时实现对污染土壤的净化和美化。在镉、铜和锰处理下,猛子花具有更好的生理生态响应,可作为生物修复和固定植物;而白花在锰处理下具有高的转化因子和地上部生物富集率,可作为生物提取植物。
关键词:萱草;生理生态响应;生物富集;重金属
中图分类号: X171.4文献标志码: A文章编号:1002-1302(2017)08-0269-05
近年来,由于采矿、工业生产以及人类活动,重金属污染日益加剧。土壤重金属危害微生物、植物、动物的生长和繁殖,并通过食物链威胁人类健康。许多研究关注重金属在土壤中的沉降和对陆地环境的污染[1-4]。镉是影响植物生长和人类健康的有害重金属之一[3-5]。锰和铜是参与植物光合、呼吸过程和作为某些酶组分的微量元素,但是,过多的锰和铜也会引发多种生物毒性作用[6]。镉、锰和铜在土壤的积累将引起植物的多种响应,如超氧自由基离子的积累、激发细胞抗氧化物质的生成,细胞膜、核酸和叶绿体的损伤[7-8],气孔导度和光合能力的降低、植物生长抑制和死亡[9-12]等。目前,土壤修复受到了越来越多的关注,已成为全球亟待解决的问题。植物修复是一种有效、成本低、对环境友好的清除重金属污染的技术方法[6,12]。寻找理想的重金属积累植物并阐明它的生理生态响应过程是成功实现植物修复的关键[13]。具有高重金属积累能力的观赏植物,可考虑作为新的植物修复物种来美化、监测和恢复重金属污染的土壤[14]。有研究探讨了某些观赏植物的环境净化能力。González-Chávez 等研究指出,菊花(Chysanthemum morifolium)可作为尾矿地植物恢复的物种[15]。Chatterjee等研究发现,向日葵(Helianthus annuus)、万寿菊(Tagetes erecta L.)、鸡冠花(Celosia cristata L.)等观赏植物均可用于湿地重金属污染的修复[16]。Liu等发现凤仙花(Impatiens balsamina L.)、金盏菊(Calendula officinalis)、蜀葵属(Althaea rosea L.)植物在铅和镉胁迫下均有高的耐受力和富集能力,并且蜀葵可作为Cd超积累植物[17]。一些观赏园艺植物如黄菖蒲(Iris pseudacorus L.)、凤凰木(Delonix regia)、木麻黄(Casuarina equisetifolia Forst.)可作为生物监测和富集植物[18-19]。这些研究表明,观赏园艺植物可用于采矿和工业废弃地的修复,或用于天然和人工湿地建设从而净化城市和农村环境的水质。虽然观赏植物在植物修复方面有很大的潜力,但是,目前相关研究仅有少数重金属积累植物报道,而且重金属胁迫下观赏植物的生理过程、富集和解毒能力的研究仍被忽视。
百合科植物萱草(Hemerocallis citrina Baroni),广泛分布在我国、日本和韩国,具有食用、药用和观赏价值[20-21]。萱草通过克隆生长,拥有高的生物量积累和繁殖能力,并且对不良的气候和生境有良好的耐受和适应能力。在田间,萱草常生长在一些被重金属严重污染的土壤。因此,推断萱草可能具有好的耐受和修复潜力。但目前,萱草对重金属胁迫的生理生态响应和富集能力还未有报道。本研究通过盆栽模拟试验,探讨在重金属镉、铜和锰胁迫下,萱草2个栽培种是否在生理生态响应和耐受性上表现出明显差异,是否具有生物修复潜力。
1材料与方法
1.1植物材料和试验设计
植物材料于2013年4月18日采自湖南省祁东县,选择植株株高和基径大小一致的健康植株,栽植在15 L装满约 10 kg 匀质土壤的塑料花盆中。土壤性质(以干土计)为pH值=71、有机碳19.5 g/kg、总氮1.63 g/kg、水解氮 105.05 mg/kg、磷2.75 g/kg、总钾18.15 g/kg、有机质 25.85 g/kg、镉0.010 mg/kg、铜0.023 mg/kg、锰0.038 mg/kg干土。试验采用2因子(栽培种和重金属)随机设计,即2种栽培种(猛子花和白花)×5种重金属处理(0;Cd:50、500 μg/g 干土;Mn:500 μg/g干土;Cu:500 μg/g干土),每个处理设15个重复。在植株移栽生长1个月后,将500 mL 406 mg/L的CdCl2·2.5H2O溶液、406.2 mg/L CdCl2·25H2O溶液,781.3 mg/L CuSO4·5H2O溶液和614.6 mg/L MnSO4·H2O溶液每天分别浇淋在土壤表面,共处理15 d,使添加在土壤中的重金属达到处理浓度。未进行重金属处理的对照植株用500 mL蒸馏水浇灌。试验持续2个月。
1.2数据测定
在试验结束时,随机选取每个处理的4株植株测定高度和基径。所有的植株收获后,分为地下部(新根+块茎)和地上部(茎+叶),用蒸馏水分别冲洗后测量新根数。然后将所有的植株在80 ℃烘干至恒质量后,称取地下部和地上部生物量干质量。
取0.1 g的叶片粉末用80%丙酮提取后,按Lichtenthaler方法[22],用分光光度计分别测定波长470、663、646 nm处的吸光度,叶绿素a、叶绿素b和类胡萝卜素含量表示为μmol/g干质量。脯氨酸含量按照Bates等的方法[23],在520 nm处测定吸光度,脯氨酸含量表示为μmol/g干质量。根系活力的测定取0.5 g 2 mm的细根,洗净后放入10 mL 0.4%TTC溶液中(pH值=7.4),按照Robbani等的方法[24]测定。
取干燥和磨细后的样品粉末用HNO3-HCIO4 (4 ∶1)溶液在120~130 ℃消化5 h,放冷后,用原子吸收光谱仪测定Cd、Cu、Mn含量。计算生物量富集率 (bioaccumulation coefficient,简称BC),转移因子(translocation factor,简称TF)和耐受指数(tolerance index,简称TI)。全株、地上部和地下部富集效率(TBC、SBC、RBC) 分别为全株、地上部和地下部中Cd、Cu、Mn含量与土壤中Cd、Cu、Mn含量之比。转移因子(TF)指植株将重金属从地下部转移到地上部的能力,表示为地上部Cd、Cu、Mn含量与地下部Cd、Cu、Mn含量之比。耐受指数(TI)指植株在重金属胁迫下的生长表现,表示为植株分别生长在重金属胁迫和对照环境下的总干物质质量之比。
1.3统计分析
数据采用SPSS 16.0统计分析,采用one-way ANOVA 的Duncans多重比较分析各处理间的差异显著性(P<005)。采用two-way ANOVA(P<0.05)分析栽培种和重金属效应对各测定指标的影响。
2结果与分析
2.1生长表现和生理响应
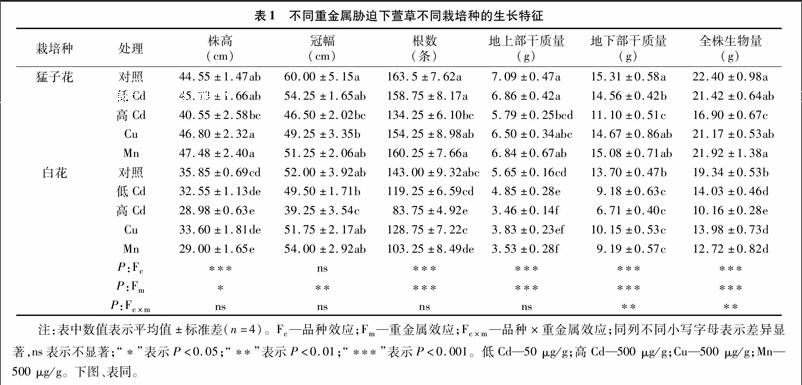
由表1可知,与对照相比,Cu處理显著降低了猛子花的冠幅,而Mn处理对猛子花生长无明显影响。Cu处理未显示出对白花生长的明显影响,而Mn则显著抑制了白花株高和根数,表明白花对锰处理更敏感。高浓度Cd处理显著降低了2个栽培种的冠幅和根数,而低Cd则无明显影响。
由表1可见,重金属胁迫下,2个栽培种显示出生物量积累上的差异。与对照相比,低Cd、Mn、Cu处理对地上部和全株生物量无明显影响,但高Cd则显著降低了猛子花的地上部、地下部干质量和全株生物量。然而,与对照相比,所有的重金属处理对白花的地上部、地下部干质量和全株生物量均有显著影响,特别是高Cd处理,这说明白花对重金属胁迫更为敏感。统计分析表明,株高、根数、地上部、地下部干质量和全株生物量表现出明显的栽培品种间效应(P<0.001);重金属处理显著影响了根数、地上部、地下和全株生物量(P<0001)、株高(P<0.05)、冠幅(P<0.01)。栽培种和重金属的交互效应显著影响了地下部和全株生物量(P<0.01)。
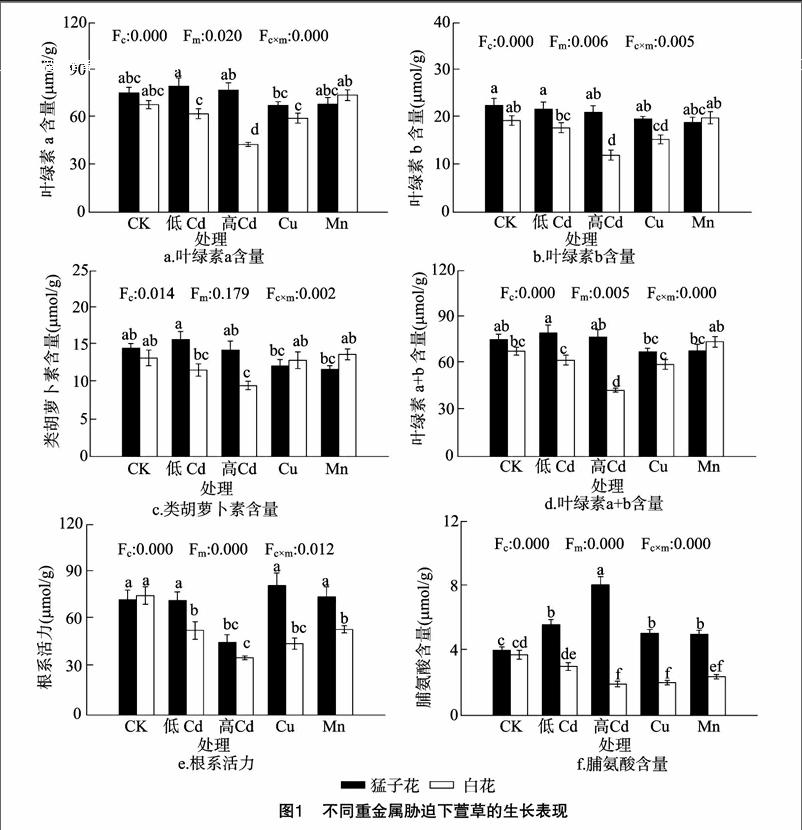
由图1-a至图1-d可见,与对照相比,2种Cd浓度处理未显著影响猛子花的叶绿素a、叶绿素b、叶绿素a+b、类胡萝卜素含量,然而,高Cd处理显著降低了白花的叶绿素a、叶绿素b、叶绿素a+b、类胡萝卜素含量。并且在2种Cd胁迫下,猛子花均表现出较白花更高的叶绿素含量,白花受到更多的叶绿体结构和功能损伤。另外,与对照相比,Mn处理对2个栽培种的叶绿素含量无显著影响,而Cu处理降低了白花的叶绿素b含量。重金属胁迫下猛子花的脯氨酸含量要高于白花。除了低Cd处理外,其他重金属处理均显著降低了白花的脯氨酸含量,然而,仅有高Cd处理增加了猛子花的脯氨酸含量(图1-f)。如图1-e所示,仅有高Cd处理显著降低了猛子花的根活力,而所有重金属处理均抑制了白花的根系活力。结果表明,叶绿素a、叶绿素b、叶绿素a+b、类胡萝卜素、脯氨酸含量、根系活力均表现出明显的栽培品种间效应。
重金属和栽培品种的交互处理显著影响了叶绿素a、叶绿素b、叶绿素a+b、类胡萝卜素、脯氨酸含量、根系活力。
2.2生物富集特征
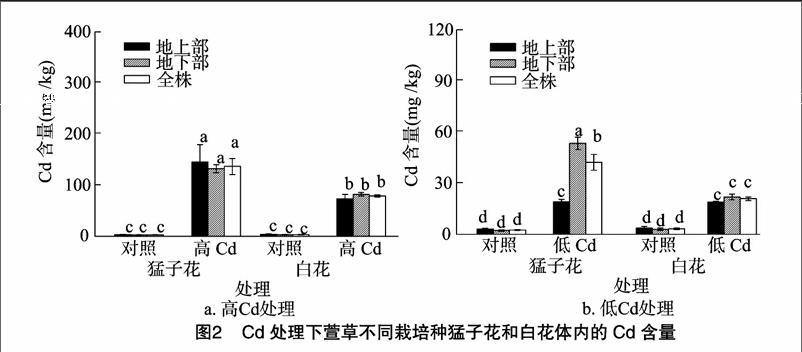
由图2可见,与对照相比,3种重金属处理显著增加了猛子花和白花植株的地上部、地下部、全株中的重金属含量。2种Cd处理下,猛子花表现出比白花更高的地下部和全株Cd含量。由图3可见,Cu处理下,2个栽培种均显示出比地上部更高的地下部积累能力。猛子花显示出比白花更多的地下和全株锰积累含量。由表2可见,不同重金属胁迫下,2个栽培种显示出TF、BC、TI值上的差异。Cu胁迫下,2个栽培种的TF值和地上部、地下部和全株富集效率无明显差异,而白花显示出比猛子花更低的TI (0.73);Mn胁迫下,猛子花显示出比白花更低的TF值和更高的TBC、RBC、TI值;高Cd胁迫下,猛子花显示出比白花更高的TBC、RBC、SBC、TI、TF值,说明猛子花有更高的生物富集和耐受能力。Cu和Mn处理下,猛子花显示出比白花更高的RBC值,而白花在锰处理下有更高的SBC值,这说明2个栽培种在不同重金属胁迫下表现出地上部和地下部积累分配上的差异。
3讨论
重金属胁迫对萱草的2个栽培种有不同的影响。高Cd处理显著抑制了猛子花的冠幅、根数、根系活力、地上部、地下部和全株生物量,而显著增加了脯氨酸含量。Cu处理仅抑制了猛子花的脯氨酸含量和冠幅,而锰处理对猛子花的生长特征无显著影响。另一方面,高Cd处理显著降低了白花的株高、冠幅、根数、根活力,叶绿素a、叶绿素b、类胡萝卜素、脯氨酸含量、地下部、地上部干质量和全株生物量积累;而低Cd处理仅抑制白花的地下干质量和全株生物量积累和根系活力。Cu和Mn处理均显著降低了白花的地上部、地下部干质量、全株生物量、脯氨酸含量,并且在Mn处理下降低了白花的根数、株高、根系活力,说明Mn处理对白花有更多的负面效应。结果表明,高Cd处理对2个栽培种的生长和生理有更大的抑制作用。并且,3种重金属对白花的抑制作用更显著。研究显示,萱草表现出重金属胁迫下生理生态响应和富集能力上的品种间差异。除了高Cd处理,其他各种重金属胁迫下,猛子花比白花有更高的地上部、地下部干质量和全株生物量。植物对重金属胁迫表现出多种耐受机制,如将重金属固定在细胞壁以避免重金属进入细胞内,抑制敏感酶的活性或通过螯合作用降低重金属生物毒性和改变对重金属的吸收[25]。脯氨酸积累可缓解重金属诱发的水势下降,从而有助于水分平衡[26-27]。脯氨酸通过渗透调节和保护蛋白合成酶增加了植物对环境胁迫的耐受性[28]。另外,叶绿素含量也常用于评价环境胁迫对光合效率的影响。结果表明,与白花相比,猛子花在2种Cd胁迫处理下显示出更高的叶绿素a、叶绿素b和类胡萝卜素含量,在所有处理中均显示出更高的脯氨酸含量,说明猛子花有更好的适应机制。根是物质吸收和合成的主要部位之一,在水分和矿质养分吸收中起着重要作用。根可监测重金属在土壤中的分布,从而通过调节根的生长来避免重金属的毒性作用[29-30]。与对照相比,仅有高Cd处理显著降低了猛子花的根系活力和根数,而所有重金属处理均显著抑制了白花的根系活力。研究表明,重金属胁迫下,猛子花表现出更好的水分平衡、光合能力和根功能,更少的光合和蛋白质伤害,这也进一步证实了猛子花有更好的生长表现。
近年来,观赏植物重金属积累能力的研究越来越多受到关注[31]。Sun等调查了As和Cd对鬼针草(Bidens pilosa L.)的交互影响,并指出Bidens pilosa可作为Cd超积累植物和As的提取者[32]。有研究表明,紫茉莉(Mirabilis jalapa L.)可作为Cd超积累植物[33]。萱草由于克隆生长有高的生物量和繁殖能力,并且有良好的适应能力。结果表明,2个栽培种在Cd、Cu、Mn处理下有高的生物富集能力和耐受能力。转移因子(TF)、生物富集因子(BC)和耐受因子(TI)是评价重金属生物富集和耐受性的指标[34]。Lux等基于耐受因子(TI)将植物分为高耐受性(TI>0.60)、中度耐受性(0.35 4结论 研究表明,2个栽培种有不同的重金属富集能力和生理生态响应。与Cu、Mn处理相比,高Cd处理显示出最强的负面作用。猛子花有高的TI值和高的生物富集能力,表明具有较强的植物修复潜力。Mn处理下,白花有更高的TF、SBC值,可考虑作为土壤修复的提取植物。因此,为了土壤的长期净化和美化工业城市和农村地区,未来应将更多的观赏园艺植物作为植物修复物种。 参考文献: [1]陈涛,常庆瑞,刘京,等. 长期污灌农田土壤重金属污染及潜在环境风险评价[J]. 农业环境科学学报,2012,31(11):2152-2159. [2]周启星,宋玉芳. 污染土壤修复原理与方法[M]. 北京:科学出版社,2004. [3]Baryla A,Carrier P,Franck F,et al. Leaf chlorosis in oilseed rape plants (Brassica napus) grown on cadmium-polluted soil:causes and consequences for photosynthesis and growth[J]. Planta,2001,212(5):696-709. [4]Wang Y B,Yan A L,Dai J,et al. Accumulation and tolerance characteristics of cadmium in Chlorophytum comosum:a popular ornamental plant and potential Cd hyperaccumulator[J]. Environmental Monitoring and Assessment,2012,184(2):929-937. [5]Nakamura M,Ochiai T,Noji M,et al. An improved tolerance to cadmium by overexpression of two genes for cysteine synthesis in tobacco[J]. Plant Biotechnology,2014,31(2):141-147. [6]Yang S Y,Huang Y J,Zhang J,et al. Physio-biochemical response to copper stress of Miscanthus Floridulus,a pioneer plant species in mine wastes-potential for phytoremediation[J]. Fresenius Environmental Bulletin,2014,23(3):686-692. [7]Fang W,Kao C H. Enhanced peroxidase activity in rice leaves in response to excess iron,copper and zinc[J]. Plant Science,2000,158(1/2):71-76. [8]Kalai T,Khamassi K,Silva J A T D,et al. Cadmium and copper stress affect seedling growth and enzymatic activities in germinating barley seeds[J]. Archives of Agronomy and Soil Science,2014,60(6):765-783. [9]Gouia H,Ghorbal M H,Meyer C. Effects of cadmium on activity of nitrate reductase and on other enzymes of the nitrate assimilation pathway in bean[J]. Plant Physiology and Biochemistry,2000,38(7/8):629-638.
[10]Mallick N,Mohn F H. Use of chlorophyll fluorescence in metal-stress research:a case study with the green microalga Scenedesmus[J]. Ecotoxicology Environmental Safety,2003,55(1):64-69.
[11]Tkalec M,Prebeg T,Roje V,et al. Cadmium-induced responses in duckweed Lemna minor L.[J]. Acta Physiologiae Plantarum,2008,30(6):881-890.
[12]Salt D E,Smith R D,Raskin I. Phytoremediation[J]. Annual Review of Plant Biology,1998,49:643-668.
[13]Hernández-Allica J,Becerril J M,Garbisu C. Assessment of the phytoextraction potential of high biomass crop plants[J]. Environmental Pollution,2008,152(1):32-40.
[14]Hernández-Apaolaza L,Gascó A M,Gascó J M,et al. Reuse of waste materials as growing media for ornamental plants[J]. Bioresource Technology,2005,96(1):125-131.
[15]González-Chávez M C,Carrillogonzález R. Tolerance of Chrysantemum maximum to heavy metals:the potential for its use in the revegetation of tailings heaps[J]. Journal of Environment Science China,2013,25(2):367-375.
[16]Chatterjee S,Singh L,Chattopadhyay B,et al. A study on the waste metal remediation using floriculture at East Calcutta Wetlands,a Ramsar site in India[J]. Environmental Monitoring and Assessment,2011,184(8):5139-5150.
[17]Liu J N,Zhou Q X,Sun T,et al. Growth responses of three ornamental plants to Cd and Cd-Pb stress and their metal accumulation characteristics[J]. Journal of Hazardous Materials,2008,151(1):261-267.
[18]Caldelas C,Araus J L,Febrero A,et al. Accumulation and toxic effects of chromium and zinc in Iris pseudacorus L.[J]. Acta Physiologiae Plantarum,2012,34(3):1217-1228.
[19]Ukpebor E E,Ukpebor J E,Aigbokhan E,et al. Delonix regia and Casuarina equisetifolia as passive biomonitors and as bioaccumulators of atmospheric trace metals[J]. Journal of Environment Science China,2010,22(7):1073-1079.
[20]Miyake T,Yahara T. Isolation of polymorphic microsatellite loci in Hemerocallis fulva and Hemerocallis citrina (Hemerocallidaceae)[J]. Molecular Ecology Notes,2006,6(3):909-911.
[21]Noguchi J,Hong D Y. Multiple origins of the Japanese nocturnal Hemerocallis citrina var. vespertina (Asparagales:Hemerocallidaceae):evidence from noncoding chloroplast DNA sequences and morphology[J]. International Journal of Plant Sciences,2004,165(1):219-230.
[22]Lichtenthaler H K. Chlorophylls and carotenoids-pigments of photosynthetic biomembranes[J]. Methods in Enzymology,1987,148(1):350-382.
[23]Bates L S,Waldren R P,Teare I D. Rapid determination of free proline for water-stress studies[J]. Plant and Soil,1973,39(1):205-207.
[24]Robbani M,Banno K,Kakegawa M. Differential flooding tolerance of some dwarfing pear rootstock clones selected from the progenies of Pyrus betulaefolia and P. calleryana[J]. Journal of the Japanese Society for Horticulture Science,2006,75(4):297-305.
[25]Punz W F,Sieghardt H. The response of roots of herbaceous plant-species to heavy-metals[J]. Environmental and Experimental Botany,1993,33(93):85-98.
[26]Mehta S K,Gaur J P. Heavy-metal-induced proline accumulation and its role in ameliorating metal toxicity in Chlorella vulgaris[J]. New Phytologist,1999,143(2):253-259.
[27]Hayat S,Hayat Q,Alyemeni M N,et al. Cumulative effects of proline and salicylic acid on the cadmium-induced changes in Cicer arietinum L.[J]. Fresenius Environmental Bulletin,2014,23(2):330-340.
[28]Kuznetsov V V,Shevyakova N I. Stress responses of tobacco cells to high temperature and salinity proline accumulation and phosphorylation of polypeptides[J]. Physiologia Plantarum,1997,100(2):320-326.
[29]Whiting S N,Leake J R,McGrath S P,et al. Positive responses to Zn and Cd by roots of the Zn and Cd hyperaccumulator Thlaspi caerulescens[J]. New Phytologist,2000,145(2):199-210.
[30]Zelinová V,Alemayehu A,Bocˇová B,et al. Primary stress response induced by different elements is mediated through auxin signalling in barley root tip[J]. Acta Physiologiae Plantarum,2014,36(11):2935-2946.
[31]Sun Y,Zhou Q,Xu Y,et al. Phytoremediation for co-contaminated soils of benzo[a]pyrene (B[a]P) and heavy metals using ornamental plant Tagetes patula[J]. Journal of Hazardous Materials,2011,186(2/3):2075-2082.
[32]Sun Y B,Zhou Q X,Liu W T,et al. Joint effects of arsenic and cadmium on plant growth and metal bioaccumulation:a potential Cd-hyperaccumulator and As-excluder Bidens pilosa L.[J]. Journal of Hazardous Materials,2009,165(1/2/3):1023-1028.
[33]Yu Z G,Zhou Q X. Growth responses and cadmium accumulation of Mirabilis jalapa L. under interaction between cadmium and phosphoru[J]. Journal of Hazardous Materials,2009,167(1/3):38-43.
[34]Bluskov S,Arocena J M,Omotoso O O,et al. Uptake,distribution,and speciation of chromium in Brassica juncea[J]. International Journal of Phytoremediation,2005,7(2):153-165.
[35]Lux A,Sottníková A,Opatrná J,et al. Differences in structure of adventitious roots in Salix clones with contrasting characteristics of cadmium accumulation and sensitivity[J]. Physiologia Plantarum,2004,120(4):537-545.
[36]Boominathan R,Doran P M. Cadmium tolerance and antioxidative defenses in hairy roots of the cadmium hyperaccumulator,Thlaspi caerulescens[J]. Biotechnology and Bioengineering,2003,83(2):158-167.
[37]Baker A J M,Reeves R D,Hajar A S M. Heavy-metal accumulation and tolerance in British populations of the metallophyte Thlaspi-caerulescens J-and-C-Presl (Brassicaceae)[J]. New Phytologist,1994,127(1):61-68.
