水稻秸秆降解菌系的筛选及其菌群组成分析
2017-06-30张蕴琦徐凤花张书敏吴优张晴
张蕴琦+徐凤花++张书敏++吴优++张晴

摘要:将崩解滤纸能力强的菌系1在30 ℃条件下以水稻秸秆为唯一碳源连续驯化41代,25代后羧甲基纤维素钠(CMC)酶活力、滤纸酶活力和秸秆失重率基本稳定,较第1代提高了59.7%、61.0%和62.4%。利用PCR-DGGE对驯化进程中菌系1细菌组成多样性及优势菌群的变化动态进行分析,原始样品共检测到13个主要条带,优势菌群由Solitalea sp.、假单胞菌属(Pseudomonas sp.)和一些不可培养微生物组成。经滤纸及水稻秸秆驯化,部分细菌被淘汰,微生物多样性减少,滤纸和水稻秸秆驯化稳定期优势菌群均包括多形拟杆菌属(Bacteroides sp.)、梭菌属(Clostridium sp.)和假单胞菌属,表明这些优势菌群对滤纸纤维素和水稻秸秆纤维素均有较强的降解能力,此外,条带10(Uncultured Clostridium sp. Clone 3-2)在水稻秸秆驯化33代颜色变深成为优势菌,推测在水稻秸秆降解过程中具有一定的作用。
关键词:菌系1;驯化;水稻秸秆;变性梯度凝胶电泳;多样性;优势菌群
中图分类号: X172文献标志码: A文章编号:1002-1302(2017)08-0257-04
2013年黑龙江省水稻秸秆量为2 400万t,约占秸秆总量的39.3%[1]。由于水稻秸秆木质素缩聚单元比例较高,与纤维素和半纤维素结合较紧密,硅质化程度高[2],同时黑龙江年均气温较低,因此其自然降解速度缓慢,资源化利用率低,大量焚烧严重污染环境。
近年来国内外学者选育出一些能够降解水稻秸秆的菌株,主要包括木霉菌、青霉菌和一些细菌,但是,研究发现单菌株产酶能力有限[3],且水稻秸秆结构复杂,很难被高效降解,而菌系通过多种微生物协同作用对水稻秸秆降解效果更好,然而,目前对菌系的研究较少。本试验在30 ℃下以6种不同来源的样品为菌源,采用限制性筛选的方法,利用水稻秸秆定向驯化培养,获得能够高效稳定降解水稻秸秆的菌系,并通过分子生物学技术揭示该菌系细菌组成多样性及优势菌群的变化动态。
1材料与方法
1.1样品来源(表1)
1.2培养基
富集培养液[4]:蛋白胨5 g,酵母粉1 g,NaCl 5 g,CaCO3 2 g,微量元素液0.5 mL,土壤浸汁100 mL,蒸馏水900 mL,121 ℃灭菌30 min。
微量元素溶液成分:ZnSO4 0.29 g,CaCl2 0.24 g,CuSO4 025 g,MgSO4 0.17 g。
土壤浸汁:土壤与去离子水以质量比1 ∶1,搅拌混合,过滤,灭菌后备用。
蛋白胨纤维素培养液(PCS)[5]:蛋白胨5.0 g,纤维素(新华滤纸/水稻秸秆)5.0 g,NaCl 5.0 g,CaCO3 2.0 g,酵母粉 1.0 g,蒸馏水1.0 L,121 ℃灭菌30 min。1.3试剂
EDTA(乙二胺四乙酸)、SDS(十二烷基磺酸钠)、CTAB(十六烷基三甲基溴化铵)、磷酸二氢钠、异丙醇、蛋白酶K、磷酸氢二钠、异戊醇、溶菌酶、Tris-饱和酚、甲叉双丙烯酰胺、丙烯酰胺、去离子甲酰胺、尿素、冰乙酸、过硫酸铵、DNA胶回收试剂盒,试剂均为分析纯。
DNA提取液的配制[6]:0.1 mol/L Tris-HCl,0.1 mol/L EDTA,0.1 mol/L Na3PO4,1.5 mol/L NaCl,1% CTAB,pH值为8.0。
1.4试验方法
1.4.1样品富集称取1~6号样品各10 g,分別加入 150 mL 富集培养液中,30 ℃恒温振荡培养,富集3代,10 d/代,传代接种量为15%。
1.4.2菌系初筛采用滤纸条崩解法,向150 mL蛋白胨纤维素培养基(滤纸)中接入20 mL富集培养液,30 ℃静置培养,驯化5代,10 d/代,选择滤纸崩解的样品,继续多代驯化。
1.4.3菌系复筛待菌系降解滤纸能力稳定后,采用蛋白胨纤维素培养基(水稻秸秆)继续定向驯化培养,第4天测定CMC酶活及滤纸酶活,第7天测定样品中秸秆失重率。
1.4.4纤维素酶活性测定采用DNS法[7]测定CMC酶活性和滤纸酶活性。
1.4.5秸秆失重率测定将水稻秸秆发酵液离心,弃上清,加入盐酸和硝酸混合液,过滤,再用蒸馏水反复冲洗,将剩余物转入培养皿,于105 ℃电热恒温鼓风干燥箱中烘干至恒质量,称质量。按照公式计算失重率[8]。
失重率ω=[(m1-m2)/m0]×100%。
其中,m0为水稻秸秆初始质量(g),m1为培养皿与样品烘干恒质量(g),m2为培养皿质量(g)
1.4.6菌系DNA提取及PCR-DGGE分析
1.4.6.1菌系总DNA提取及纯化取原始样品以及滤纸和水稻秸秆驯化中期、稳定期的发酵液为样品,置于离心管(样液为10 mL),-20 ℃冻存。按照吕新等报道的高盐法[6]提取DNA,得DNA粗提液,取5 μL作琼脂糖凝胶电泳检测,并选用OMEGA生物技术公司的琼脂糖凝胶回收试剂盒进行胶回收,纯化DNA。
1.4.6.2菌系16S rDNA V3可变区PCR扩增用于DGGE电泳的 PCR 扩增产物引物序列为[9]338F (5′-CGCCCGCCG
CGCGCGGCGGGCGGGGCGGGGGCACGGGGGGACTCCTACGG
GAGGCAG-3′)和518R(5′-ATTACCGCGGCTGCTGG-3′);反应体系[10]:模板DNA 1 μL,10×PCR buffer 2.5 μL,dNTP(2.5 mmol/L)2 μL,正反引物各0.5 μL,5 U/μL Taq聚合酶 0.25 μL,加双蒸水至25 μL;PCR反应条件[11]:94 ℃预变性10 min;94 ℃变性1 min,65 ℃复性8 min,72 ℃延伸2 min,共40次循环;72 ℃延伸10 min,PCR产物经1.5%琼脂糖凝胶电泳进行检测。
1.4.6.3变性梯度凝胶电泳采用Bio-Rad变性梯度凝胶电泳对PCR产物进行分离,丙烯酰胺凝胶浓度为8%,变性剂梯度为35%~65%,电泳缓冲液为1×TAE,上样量为30 μL PCR产物和10 μL 6×溴酚蓝二甲苯氰溶液,在60 ℃、60 V条件下电泳14 h。紫外凝胶成像系统分析结果,并对DGGE图谱上的优势条带和差异条带进行割胶回收,将其放入灭菌的200 μL离心管中,加入20 μL灭菌的去离子水中,4 ℃放置过夜。取2 μL DNA浸出液为模板进行PCR扩增,并再次进行变性梯度凝胶电泳,对单一条带进行切胶回收及PCR扩增,扩增产物送交华大基因公司测序。
2结果与分析
2.1菌系驯化
将不同来源的6个样品在PCS培养基(滤纸)中驯化至第5代,仅1号和3号样品滤纸条部分崩解,其他样品滤纸无明显崩解现象。对1号和3号样品驯化至23代,第7天1号样品滤纸均崩解为片状,3号中滤纸断裂;第10天1号滤纸完全降解,菌液呈淡黄色,3号滤纸崩解为片状,表明随着驯化代数的增加,样品中菌系对滤纸崩解能力逐渐增强。
2.2菌系复筛
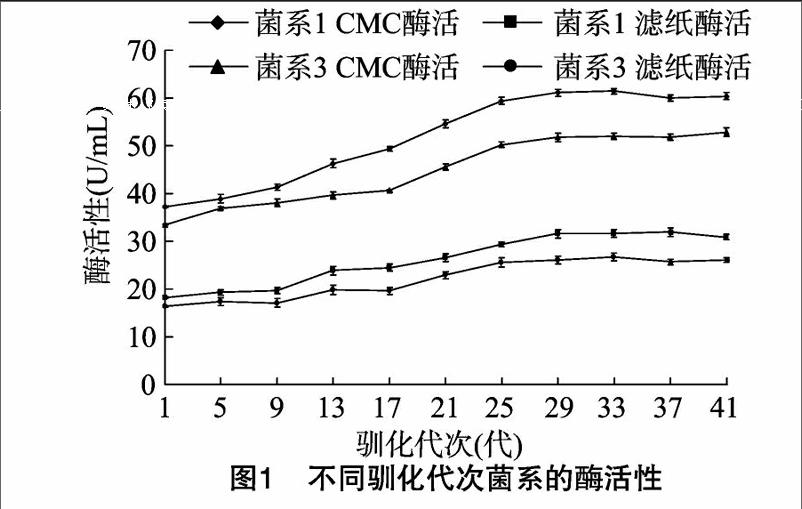
为得到能够快速稳定降解水稻秸秆的菌系,将菌系1和菌系3在以水稻秸秆为唯一碳源的PCS培养基中定向驯化培养,不同驯化代次CMC酶活性与滤纸酶活性如图1所示。1~25代酶活性均逐渐提高,第25代菌系1 CMC酶活性与滤纸酶活性分别为59.4、29.3 U/mL,较第1代提高了59.7%、61.0%,菌系3为50.2、25.6 U/mL,较第1代提高了49.9%、56.1%,菌系1较菌系3高18.3%、14.5%,表明驯化培养对提高菌系1酶活性效果明显,且菌系1酶活性强于菌系3。杨冰从长期耕种的水稻田中筛选出水稻秸秆降解复合菌系 I-D,37℃条件下培养2 d,CMC酶活最高为 24.2 U/mL[12]。
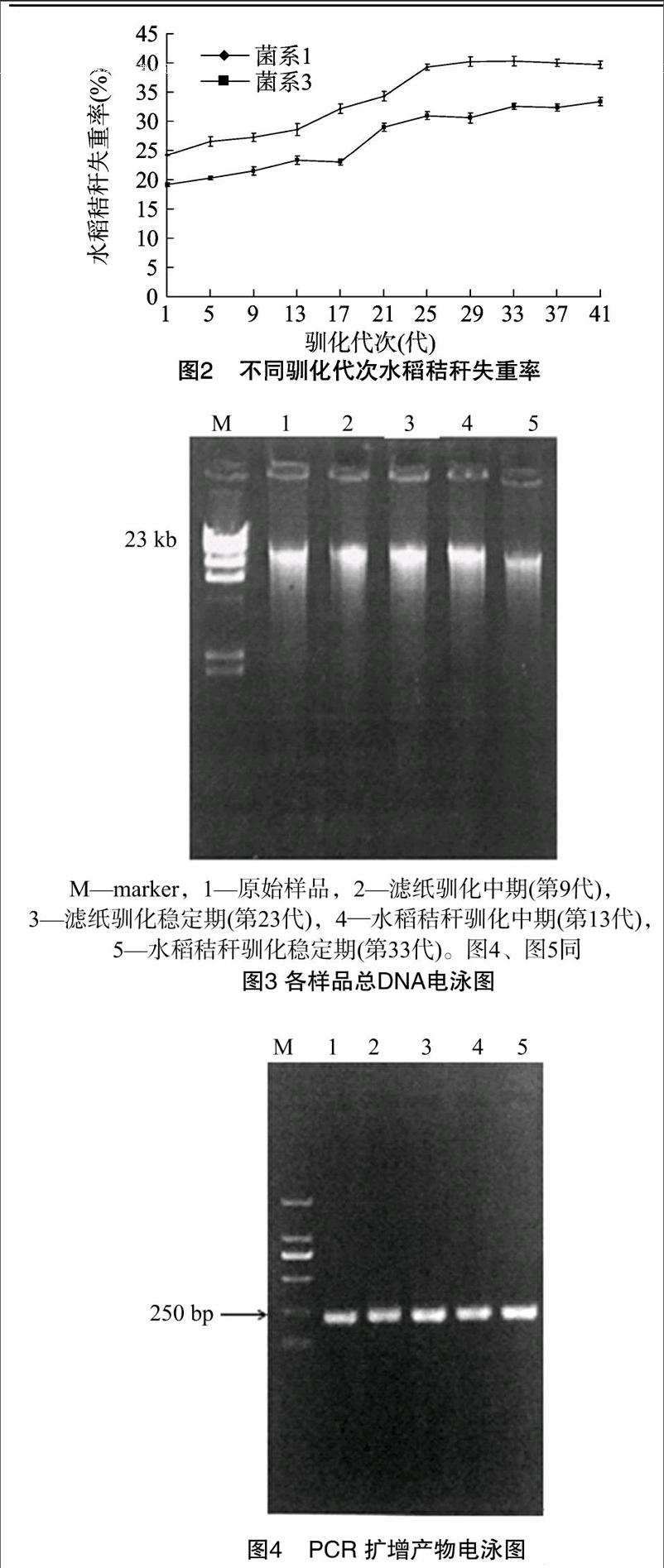
由图2可见,在各代次驯化培养第7天时,1~25代水稻秸秆失重率逐渐增加,第25代菌系1和菌系3秸秆失重率为39.3%、31.0%,较第1代提高62.4%、62.3%,菌系1较菌系3高26.8%,表明菌系1对水稻秸秆降解能力强于菌系3。刘甲峰等从免耕多年还田的土壤中驯化获得1组纤维素降解菌系,第7天稻秸失重率为30.0%[13]。朱虹等从稻草堆底土壤筛选的纤维素降解菌系第7天稻秸失重率为39.6%[14]。
2.3DGGE监测菌系1群落结构
2.3.1菌系1总DNA提取由于菌系1降解能力强于菌系3,因此采用PCR-DGGE技术对菌系1优势菌群变化动态进行分析。总DNA电泳结果见图3,各样品基因片段大小均约为23 kb,5条主带清晰较亮,表明DNA完整性较好,但各条带存在拖尾现象,且点样孔处均不同程度地发亮,说明样品中含有未除去的蛋白质等杂质。以纯化后的总DNA为模板进行PCR扩增,扩增产物大小为200 bp左右,条带清晰单一(图4),可用于DGGE分析。
2.3.2菌系1菌群组成变化动态DGGE图谱中1个条带可能代表1种微生物,同时颜色相对较深的条带是优势菌,菌系1不同时期条带的数目及颜色深浅存在差异,如图5所示,在驯化过程中,微生物组成发生变化。原始样品共检测出13个主要条带,说明微生物多样性较丰富,条带2、4、5、6、7、11、12、13颜色较深,代表菌系的优势细菌。滤纸驯化过程中,条带2、4、5、11、12、13颜色持续变浅,对滤纸降解能力较弱,驯化9代,与原始样品相比,条带1、8、9颜色变深,条带3、10、11颜色深浅没有明显变化,第23代条带3、6、7变深,条带1、3、6、7、8、9代表的细菌成為优势菌,表明这些细菌逐渐适应滤纸培养环境并趋于稳定,对滤纸降解能力较强。
水稻秸秆驯化培养13代的样品检测出9个主要条带,菌系微生物多样性减少。与滤纸驯化23代相比,条带2、4、5代表的细菌被淘汰,条带1、10、11、12、13深浅无明显变化,条带3、6、7、8、9变浅,表明水稻秸秆驯化初期,菌系中微生物由于未能适应碳源的变化,活性降低,当培养33代时,条带11消失,条带1、3、6、7、8、9、10较深,代表的细菌为优势细菌,说明这些条带代表的细菌对水稻秸秆降解能力较强,共同组成一个能稳定降解水稻秸秆的菌系。
DGGE图谱条带测序后与GenBank数据库同源性比对结果见表2,除条带4、5、10、11、12、13与某些不可培养微生物相似外,其他各主要条带的近缘菌分别归属于多形拟杆菌属(Bacteroides sp.)、假单胞菌属(Pseudomonas sp.)、梭菌属(Clostridium sp.)和Solitalea sp.。原始样品优势菌群为Solitalea sp.、Pseudomonas sp.和一些不可培养微生物,经滤纸驯化优势菌群变化较大,演替为Bacteroides sp.、Clostridium sp. 和Pseudomonas sp.,水稻秸秆驯化稳定期优势菌群包括Bacteroides sp.、Clostridium sp.、Pseudomonas sp.和Uncultured Clostridium sp. Clone 3-2。
3讨论
菌系1 DGGE图谱中条带1与多形拟杆菌(Bacteroides thetaiotaomicron VPI-5482)同源率为97%,驯化各时期均为优势菌,多形拟杆菌是一种碳水化合物降解细菌,Kim等研究发现Bacteroides thetaiotaomicron VPI-5482含有1个编码糖苷转移酶的基因,能够降解纤维素等多糖物质[15]。条带3、6序列与荧光假单胞菌(Pseudomonas fluorescens Pf0-1)相似性达到99%,条带7与铜绿假单胞菌(Pseudomonas aeruginosa PAO1)相似性为100%,在不同时期样品中均存在。目前已有研究显示,荧光假单胞菌和铜绿假单胞菌均具有纤维素降解能力,尹礎等分离出1株产酶能力较强的纤维素降解菌,其与荧光假单胞菌16S rDNA核苷酸同源率达到99%以上[16]。李平等将筛选的5株细菌构建1组高效纤维素降解菌系,经
