大孔吸附树脂分离纯化金丝小枣总黄酮工艺研究
2017-06-30师仁丽于文龙梁娜张群王向红
师仁丽++于文龙++梁娜+张群+王向红
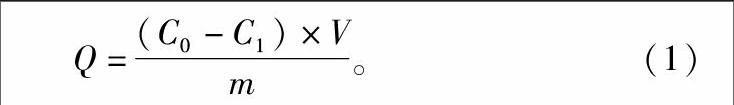
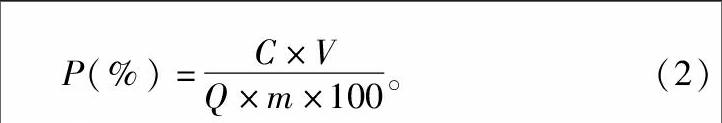
摘要:以静态吸附与解吸率为指标,考察了6种大孔吸附树脂对金丝小枣总黄酮的分离纯化效果,从而筛选出1种效果最佳的大孔吸附树脂。采用正交优化的方法确定出纯化金丝小枣总黄酮的工艺参数。确定AB-8树脂对金丝小枣总黄酮的分离纯化效果最好,其对金丝小枣总黄酮的吸附率可达88.57%,解吸率为99.71%。最佳工艺条件为上样液pH值为3、吸附流速3 mL/min、上样浓度0.35 mg/mL、洗脱剂为70%乙醇,此时总黄酮收率可达到9339%。同时,绘制了泄露曲线与解吸曲线,确定了最佳上样体积与洗脱剂用量分别为40、70 mL。
关键词:金丝小枣;黄酮;大孔吸附树脂;纯化
中图分类号: R284.2文献标志码: A文章编号:1002-1302(2017)08-0172-04
枣(Ziziphus jujuba Mill.)是鼠李科(Rhamnaceae)枣属植物的成熟果实,原产于中国,栽培已有4 000年的历史[1]。红枣营养价值高,且有很高的药用价值,是营养和医疗保健的优质滋补果品,是很重要的食用材料和经济产品,享有“营养保健丸、木本粮食”的美誉[2]。由于其具有抗氧化、抗炎、抗癌、保护心肌等功能而被用作营养食品和传统药品[3]。金丝小枣广泛分布在河北沧州一带,果核细小、可食率达97%、含可溶性固形物40%~45%、制干率约55%、质脆细嫩、品质优良等特点[4]。
黄酮类化合物是植物产生的一类次生代谢产物,是一类重要的天然化合物,对人体健康起着重要的作用。大量研究表明黄酮类物质具有降血压、降血脂、增大心脏血流量、增强心脏收缩、减少心脏搏动数、止咳祛痰、抗菌消炎的功效[5]。
在提取的粗黄酮中一般含有多种杂质,如糖类、色素、蛋白质、氨基酸等。为了提高黄酮纯度,需要对粗提物进行进一步的分离纯化,从而提高黄酮含量。目前,使用的黄酮类化合物纯化方法很多,主要有柱层析、薄层层析、气相层析、溶剂萃取、沉淀法等方法,在工业生产中均存在一定的缺点。大孔吸附树脂纯化法是目前使用最为广泛的纯化方法[6-7]。该技术具有生产成本低、周期短、效率高、可再生等优点,所以在天然产物有效成分的分离技术中有较好的应用发展趋势。
本试验选取6种在黄酮类化合物纯化中应用较为广泛的大孔吸附树脂,通过研究金丝小枣黄酮类化合物在不同树脂上的静态吸附、解吸效果,从而选择出1种精制金丝小枣黄酮较理想的吸附树脂,并采用正交优化法对该树脂的各种纯化工艺参数进行研究,以期为金丝小枣黄酮的分离纯化提供科学依据。
1材料与方法
1.1材料与仪器
金丝小枣,购自河北省沧州;芸香苷对照品(≥99%),购自上海源叶生物科技有限公司;石油醚(60~90 ℃)、无水乙醇、亚硝酸钠、硝酸铝、氢氧化钠、盐酸,购自天津市天力试剂;AB-8树脂、D-101树脂、HPD-600树脂、ADS-17树脂、HPD-826树脂、聚酰胺树脂,购自沧州宝恩吸附材料科技有限公司;101-OAB电热古鼓风干燥箱,购自天津市泰斯特仪器有限公司;UV-2008H型紫外可见风光光度计,购自上海UNIC公司;HT-300BQ型数控超声提取器,购自天津市瑞普电子仪器公司;DZWK-C型恒温水浴锅,购自北京市光明医疗仪器厂;BS-214D型电子分析天平,购自Sartorius公司;TGL-16M快速离心机,购自浙江金坛市杰瑞尔电器有限公司;层析柱,购自华美仪器公司;RE-52A型旋转蒸发仪,购自上海亚荣生化仪器厂;真空恒流泵,购自上海沪粤明科学仪器有限公司;自动收集器,购自上海嘉鹏科技有限公司;FZG-4A型真空干燥箱,购自南京天利制药设备有限公司。
1.2原料預处理
将金丝小枣洗净烘干、去核、取1 g加10 mL石油醚(60~90 ℃),超声(180 W,45 ℃)30 min,置于60 ℃水浴锅中挥发干,加入20 mL 70%乙醇,超声50 min,取上层清液,重复3次,最后合并清液,在3 500 r/min的离心条件下,离心 10 min,弃去沉淀,得到总黄酮粗提液。旋转蒸发去除乙醇,至无醇味,加入蒸馏水定容至500 mL得到样品液。
1.3芸香苷标准曲线的绘制
准确称取干燥至恒质量的芸香苷标准品1 mg,置于 10 mL 容量瓶中,用95%乙醇溶解至刻度、摇匀、得到 1 mg/mL 的芸香苷标准液。分别精密吸取标准液0、1.0、20、3.0、4.0、5.0 mL,置于5 mL容量瓶中,用95%乙醇定容至刻度,加入5%NaNO2溶液0.5 mL。摇匀,静置6 min;再加入10%Al(NO3)3溶液0.5 mL,混匀,静置6 min;最后加入4%NaOH溶液4 mL,摇匀,放置10 min,以不加标准品的空白作参比,测定510 nm处吸光度(D),作3个平行,取平均值。以标准品浓度与吸光度作线性回归,绘制芸香苷标准曲线。
1.4测定样品总黄酮含量
用标准曲线的方法测定样品的吸光度,作3个平行,取平均值,根据线性回归方程计算样品中总黄酮浓度。
1.5黄酮纯化工艺研究
1.5.1大孔树脂的筛选
1.5.1.1大孔树脂的预处理将6种大孔吸附树脂(AB-8树脂、D-101树脂、HPD-600树脂、ADS-17树脂、HPD-826树脂、聚酰胺树脂)取适量,用95%乙醇浸泡24 h,使其充分溶胀,后用乙醇清洗,当流出液与水以1 ∶5的比例混合时,无浑浊出现为止,用蒸馏水洗至无醇味。之后用4%HCl溶液浸泡3 h后水洗至中性,再用2%NaOH浸泡3 h水洗至中性,最后浸泡于蒸馏水中备用。
1.5.1.2大孔树脂饱和吸附量的测定准确称取已处理好的树脂2 g(湿质量),至于200 mL具塞磨口三角瓶中,加入已知浓度的全枣黄酮溶液25 mL、100 r/min,在电动振荡机上振荡24 h,充分吸附后,抽滤,计算滤液中黄酮的质量浓度,按下列公式计算各树脂的饱和吸附量Q(mg/g)。
Q=(C0-C1)×V1m。(1)
式中:C0为样品液起始浓度(mg/mL);C1为滤液中黄酮浓度(mg/mL);V为溶液体积(mL);m为树脂质量(g)。
1.5.1.3大孔树脂解吸率的测定取上述吸附饱和的大孔树脂,用蒸馏水清洗至洗脱液无色,转移至干净的具塞磨口三角瓶中,加入70%的乙醇溶液50 mL,100 r/min,在电动振荡机上振荡24 h,抽滤,测定滤液中黄酮浓度,计算解吸率P(%)。
P(%)=C×V1Q×m×100。(2)
式中:C为解吸液中黄酮浓度(mg/mL);V为解吸液体积(mL);Q为饱和吸附量(mg/g);m为树脂质量(g)。
1.5.2单因素试验由上述试验筛选出效果最佳的大孔吸附树脂,进行上样液pH值、流速、浓度、用量,解吸液浓度及用量的动态吸附与解吸试验。取出层析柱(10×30 mm),将10 g预处理好的AB-8型树脂采用湿法装柱,使树脂沿着玻璃棒缓慢倒入层析柱中,及时将产生的气泡赶出,装柱高度为10 cm。
1.5.2.1pH值对黄酮吸附的影响取6份已知浓度的全枣黄酮粗提液25 mL,分别调节其pH值为3、4、5、6、7、8,以 1 mL/min 的流速上柱吸附,分管收集流出液(5 mL/管),测定每管的黄酮浓度,从而计算到达吸附饱和时的流出液体积,并计算吸附量。
吸附量(mg)=上样液浓度(mg/mL)×流出液体积(mL)。(3)
1.5.2.2上样流速对黄酮吸附的影响取已知浓度的全枣黄酮粗提液(pH值=4),分别以1、2、3、4 mL/min的速度上柱吸附,利用自动收集器,分管收集流出液(5 mL/管),测定每管的黄酮浓度,从而计算到达吸附饱和时的流出液体积,按(3)式计算不同流速下的吸附量。
1.5.2.3上样浓度对黄酮吸附的影响分别取4份浓度分别为0.05、0.15、0.25、0.35 mg/mL的样品溶液(pH值=4),以2 mL/min的流速上样,分管收集流出液(5 mL/管),测定每管的黄酮浓度,从而计算到达吸附饱和时的流出液体积,按(3)式计算不同流速下的吸附量。
1.5.2.4解吸液浓度的考察取一定量样品黄酮粗提液(pH值=4,C=0.25 mg/mL),以2 mL/min的流速上柱吸附,做4组试验,待吸附饱和后,用蒸馏水清洗树脂,之后用 50 mL 浓度分别为30%、50%、70%、90%的乙醇以2 mL/min的流速进行洗脱,测得洗脱液黄酮浓度,计算黄酮含量。
黄酮含量(mg)=洗脱液黄酮浓度(mg/mL)×洗脱剂用量(mL)。(4)
1.5.2.5泄露曲线的绘制按上述已确定的吸附条件,取浓度为0.25 mg/mL的黄酮粗提液适量,pH值=4,以2 mL/min的流速上样,分管收集流出液(5 mL/管),测定每管在510 nm处的吸光度,以吸光度为纵坐标,试管号为横坐标,绘制泄露曲线,确定泄漏点。
1.5.2.6洗脱曲线的绘制取一定量全枣黄酮粗提液,按上述已确定的吸附及解吸条件,即样液浓度为0.25 mg/mL、pH值=4,上样流速为2 mL/min,待吸附饱和后,用70%乙醇洗脱,分管收集洗脱液(7 mL/管),测定洗脱液的吸光度,绘制解吸曲线,从而确定洗脱剂用量。
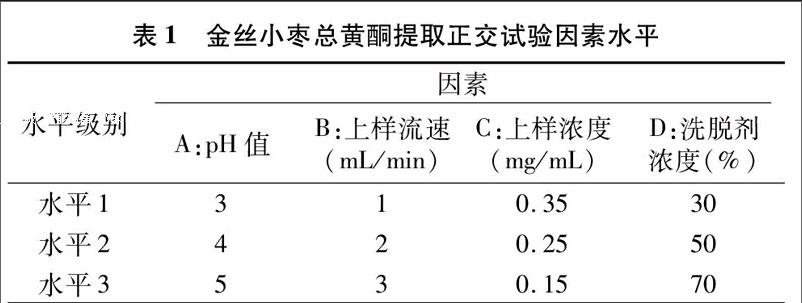
1.5.3正交试验优化纯化工艺为确定金丝小枣总黄酮提取物的纯化工艺,精确量取体积为40 mL的枣黄酮提取液,以上样液pH值(A)、上样流速(B)、上样浓度(C)、洗脱剂浓度(D)4个因素作为试验因子,以总黄酮收率为指标,进行4因素3水平的L9(34)正交试验,因素水平见表1。
2结果与分析
2.1標准曲线测定结果分析
由图1可以看出,芸香苷标准曲线方程为y=13.629x-0.000 05,决定系数r2=0.999 62。结果表明,黄酮标准品的吸光度在0.0~0.7范围内,线性关系良好,因此在相同的条件下,由样品的吸光度可计算出其相应的黄酮浓度。
2.2大孔树脂的筛选
通过对6种大孔吸附树脂的静态吸附与解吸试验,得出每种树脂的饱和吸附量和解吸率(表2)。
由表2可以看出,D-101树脂的饱和吸附量最大,可达到0.87 mg/g,HPD-600树脂和AB-8树脂次之,分别为086、0.85 mg/g,但相差均不大。D-101和HPD-600树脂的解吸率分别为81.51%、87.08%,均明显小于AB-8树脂的解吸率(99.71%)。综合考虑,选择AB-8型树脂对金丝小枣黄酮提取液进行纯化。
2.3单因素试验结果与分析
2.3.1pH值对黄酮吸附影响的结果黄酮类化合物含有羟基,是弱酸性类物质,适宜在酸性条件下进行吸附。所以根据被吸附物的结构特点,调整粗提液的pH值可以达到较佳的吸附效果。由图2可以看出,上样液的pH值对大孔吸附树脂的吸附效果影响较大,pH值在3~4时,吸附量逐渐增大;当黄酮粗提液的pH值=4时,树脂对枣黄酮的吸附量最大;之后随着pH的增加,树脂的吸附量逐渐减小。因此确定4为最佳的吸附液pH值。
2.3.2上样流速对黄酮吸附的影响由图3可知,上样流速对黄酮吸附量的影响,总黄酮的吸附率在一定范围内与上样流速成反比,流速越大吸附率越小。但当流速过低时,虽然吸附率较大,但吸附时间过长。流速过快时,被吸附物质来不及被树脂吸附而泄露出去,降低树脂的吸附率。流速为 1 mL/min 时,吸附率为77.89%;流速为2 mL/min时,吸附率为71.58%,两者相差较小,综合考虑,选择2 mL/min为最佳吸附流速。
2.3.3上样浓度对黄酮吸附的影响由图4可知,在 0.05~0.25 mg/mL 的浓度范围内,总黄酮收率随浓度的升高而增大,但0.25~0.35 mg/mL的浓度范围内总黄酮收率不再增大确,有略微降低的趋势。推测认为,适当增加上样浓度就增大了树脂与被吸附物的接触机会,树脂的吸附作用增强,但浓度过高,导致树脂的选择吸附性降低,使总黄酮过早泄露。因此,选择0.25 mg/mL为最适宜的上样浓度。
2.3.4解吸液浓度对黄酮含量的影响由图5可知,选择不同浓度的含水乙醇作为解吸液,30%~70%浓度的乙醇对总黄酮的洗脱效果逐渐增强,大于70%的乙醇的洗脱效果下降。因此,选择70%作为最佳解吸液浓度。
2.3.5泄露曲线的绘制在动态吸附过程中,提取液首先与树脂上层接触,达到饱和状态,随后这种状态逐渐向下推移,当所有树脂吸附饱和时,停止吸附,提取液开始泄露。由图6可知,总黄酮从第8管开始泄露,此时上柱液体积为 40 mL,所以选择40 mL为最佳上柱液体积。
2.3.6洗脱曲线的绘制由图7可知,洗脱液用量在3号试
管之前,随洗脱液用量增加,流出液中黄酮的质量浓度不断增加;洗脱液用量继续增大,流出液中黄酮的质量浓度逐渐减小。在第10管时,黄酮质量浓度基本无变化,此时洗脱液用量为70 mL。因此,确定洗脱液最佳体积为70 mL。
2.4正交试验优化纯化工艺结果
由表3可以看出,各因素對黄酮动态吸附率的影响程度依次为D>B>A>C,且最佳组合为A1B3C2D1,即最佳吸附条件为pH值=3,流速为3 mL/min,洗脱剂浓度70%,上样浓度0.35 mg/mL,而该试验组在正交试验中未涉及,所以要经过验证试验,其吸附率可以达到93.39%,高于以上试验组合。
3结论
通过静态吸附试验发现AB-8树脂在6种常用的纯化黄酮类化合物的大孔吸附树脂中对金丝小枣黄酮化合物的吸附与解吸性能较好,吸附率为88.57%,解吸率为99.71%。通过正交优化试验继续考察了AB-8树脂的动态吸附与解吸条件,最佳工艺条件为上样液pH值=3,吸附流速为 3 mL/min,上样浓度为0.35 mg/mL,洗脱剂为70%乙醇,总黄酮收率可达到93.39%,同时测定了最佳上样体积与洗脱剂体积分别为40、70 mL。
参考文献:
[1]Kou X,Chen Q,Li X,et al. Quantitative assessment of bioactive compounds and the antioxidant activity of 15 jujube cultivars[J]. Food Chemistry,2015,173:1037-1044.
[2]杨永祥,陈锦屏,吴曼. 红枣营养保健价值及其加工利用的研究进展[J]. 农产品加工,2009(1):52-53,56.
[3]Gao Q H,Wu P T,Liu J R,et al. Physico-chemical properties and antioxidant capacity of different jujube (Ziziphus jujuba Mill.) cultivars grown in loess plateau of China[J]. Scientia Horticulturae,2011,130(1):67-72.
[4]张平平,李黎,张东东,等. 金丝新4号枣果中黄酮类物质提取及纯化工艺的研究[J]. 食品与机械,2009,25(6):75-79.
[5]孙智敏,李发堂,殷蓉,等. 黄酮类化合物提取工艺研究进展[J]. 河北化工,2005(4):7-8,30.
[6]Yoon S Y,Choi W J,Moon Park J,et al. Selective adsorption of flavonoid compounds from the leaf extract of Ginkgo biloba L.[J]. Biotechnology Techniques,1997,11(8):553-556.
[7]李国丽,李春霞,王威强. 银杏叶黄酮类化合物提取分离研究现状和展望[J]. 山东轻工业学院学报(自然科学版),2005,19(3):18-23.
